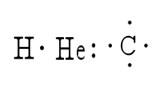Gilbert Newton Lewis foi um renomado químico americano nascido em 23 de outubro de 1875 em Weymouth, Massachusetts. Ele é conhecido por suas importantes contribuições para a ciência, especialmente no campo da química. Lewis desenvolveu a teoria do par de elétrons, que revolucionou a compreensão da ligação química e da estrutura molecular. Além disso, ele também introduziu o conceito de ácidos e bases de Lewis, expandindo o entendimento dos processos químicos fundamentais. Sua obra teve um impacto significativo no desenvolvimento da química moderna e seu legado continua a inspirar cientistas em todo o mundo.
Principais contribuições de Gilbert Newton Lewis para a química moderna.
Gilbert Newton Lewis foi um renomado químico americano que fez importantes contribuições para a ciência, especialmente no campo da química moderna. Nascido em 1875 em Massachusetts, Lewis estudou em Harvard e depois fez seu doutorado na Universidade de Göttingen, na Alemanha.
Uma das principais contribuições de Lewis para a química foi a teoria do par de elétrons de Lewis, que revolucionou a compreensão da ligação química. Segundo essa teoria, os átomos compartilham elétrons para formar ligações covalentes, e os pares de elétrons não compartilhados são responsáveis por determinar a geometria das moléculas.
Outra importante contribuição de Lewis foi a introdução do conceito de ácidos e bases de Lewis. Enquanto a definição de ácidos e bases de Arrhenius e de Brønsted-Lowry se baseavam na doação ou aceitação de prótons, a definição de Lewis se baseava na doação ou aceitação de pares de elétrons.
Além disso, Lewis desenvolveu a teoria dos orbitais moleculares, que descreve a distribuição dos elétrons em moléculas complexas. Essa teoria é fundamental para a compreensão da reatividade química e da formação de ligações em compostos orgânicos e inorgânicos.
Em resumo, as contribuições de Gilbert Newton Lewis para a química moderna foram fundamentais para o desenvolvimento da teoria da ligação química e para a compreensão das interações entre átomos e moléculas. Seu legado continua a influenciar a pesquisa científica até os dias de hoje.
Qual foi a criação de Lewis?
Gilbert Newton Lewis, um renomado químico e físico americano, fez uma contribuição significativa para a ciência com sua criação da teoria dos pares de elétrons de valência. Esta teoria revolucionária, proposta por Lewis em 1916, ajudou a explicar a formação de ligações químicas entre átomos.
De acordo com a teoria de Lewis, os átomos tendem a compartilhar elétrons de valência para alcançar a estabilidade. Ele desenvolveu o conceito de pares de elétrons de valência, que são os elétrons mais externos de um átomo que participam das ligações químicas. Esses pares de elétrons podem ser compartilhados entre átomos para formar ligações covalentes ou transferidos de um átomo para outro para formar ligações iônicas.
A teoria dos pares de elétrons de valência de Lewis foi fundamental para o entendimento da estrutura molecular e das propriedades dos compostos químicos. Ela ainda é amplamente utilizada hoje em dia na química orgânica e inorgânica para prever a geometria molecular e a reatividade dos compostos.
Portanto, a criação de Lewis da teoria dos pares de elétrons de valência foi um marco na história da química, que revolucionou nossa compreensão das ligações químicas e da estrutura molecular.
Qual foi a contribuição de Lewis para a química?
Gilbert Newton Lewis foi um renomado químico americano que fez importantes contribuições para a ciência. Uma de suas principais realizações foi a teoria do par de elétrons de Lewis, que revolucionou a compreensão da ligação química. Essa teoria descreve como os átomos compartilham ou transferem elétrons para formar ligações químicas. Lewis também introduziu o conceito de ácido-base de Lewis, que ampliou o conceito tradicional de ácido-base de Arrhenius e de Brønsted-Lowry.
Além disso, Lewis desenvolveu a notação de Lewis, que é amplamente utilizada para representar a estrutura molecular de compostos químicos. Essa notação é baseada em pares de elétrons e permite visualizar facilmente como os átomos estão ligados em uma molécula. A contribuição de Lewis para a química foi fundamental para o avanço do conhecimento nessa área e ainda é amplamente estudada e aplicada nos dias de hoje.
Fórmula de Lewis: Como é representada a distribuição de elétrons em uma molécula.
A Fórmula de Lewis é uma representação gráfica da distribuição de elétrons em uma molécula. Desenvolvida pelo químico Gilbert Newton Lewis, essa representação mostra os elétrons de valência de átomos individuais e como eles são compartilhados entre átomos na formação de ligações químicas.
Na Fórmula de Lewis, os elétrons de valência são representados por pontos ou pares de pontos ao redor dos símbolos dos átomos. Cada ponto representa um elétron não emparelhado, enquanto um par de pontos representa um elétron emparelhado. Os elétrons são distribuídos de forma a completar o octeto dos átomos, seguindo a regra do octeto de Lewis.
Essa representação é útil para visualizar a estrutura das moléculas e prever como elas interagem quimicamente. A Fórmula de Lewis ajuda a determinar a geometria molecular, a polaridade da molécula e até mesmo a reatividade química.
Em resumo, a Fórmula de Lewis é uma ferramenta importante na química para entender a distribuição de elétrons em uma molécula e suas propriedades químicas. Graças ao trabalho de Gilbert Newton Lewis, essa representação se tornou fundamental para os estudos na área da química.
Gilbert Newton Lewis: Biografia e contribuições para a ciência
Gilbert Newton Lewis foi um dos cientistas americanos mais importantes do século XX. Seu trabalho produziu uma revolução estrutural nos estudos químicos, graças às muitas contribuições que ele fez ao longo de sua vida para o desenvolvimento da ciência.
Entre as contribuições desse físico-químico está a fórmula que leva seu nome, com a qual apenas os pares de elétrons são representados graficamente. O trabalho de pesquisa de Lewis era muito amplo, embora sua fama se devesse basicamente à teoria das ligações químicas e à definição de ácido-base formulada em 1923.
Lewis passou a ter grande influência no mundo científico e acadêmico dos Estados Unidos, especialmente na Universidade de Harvard, onde foi treinado e ensinado. Seu trabalho para o Exército dos EUA durante a Primeira Guerra Mundial lhe rendeu o maior reconhecimento e honras.
Ele treinou nas universidades de Nebraska, Harvard, Leipzig e Göttingen na Alemanha. Ele trabalhou no Instituto de Tecnologia de Massachusetts (MIT), na Universidade de Harvard e na Universidade da Califórnia, onde morreu trabalhando.
Ao longo de sua vida, ele recebeu inúmeros prêmios e prêmios, entre os quais destacam-se vários doutorados honorários das universidades de Chicago, Madri, Liverpool, Wisconsin e Pensilvânia. Ele era membro honorário de várias instituições científicas na Inglaterra, Índia, Suécia, Dinamarca e Estados Unidos.
Biografia
Gilbert Newton Lewis nasceu em Weymouth, Massachusetts, em 23 de outubro de 1875. Seus pais eram Frank Wesley Lewis e Mary Burr White Lewis. Durante seus primeiros anos, ele recebeu ensinamentos em sua própria casa e, aos 10 anos, ingressou na escola pública, onde se formou em 1889.
Em 1884, Lewis teve que se estabelecer com sua família em Lincoln, Nebraska. Aos 13 anos, ele foi admitido no ensino médio da Universidade de Nebraska.
Estudos
Após a formatura, ele continuou seus estudos universitários por dois anos e depois se matriculou na Universidade de Harvard em 1893.
Inicialmente, ele se interessou por economia, mas finalmente optou por física e química. Gilbert se formou em química em 1896 e por um ano lecionou na Phillips Academy, uma escola particular em Andover.
Ele voltou a Harvard para fazer um trabalho de pós-graduação e obter um mestrado em 1898 com sua tese sobre O elétron e uma molécula . Um ano depois, ele obteve o doutorado e sua tese foi intitulada Algumas relações eletroquímicas e termoquímicas de amálgamas de zinco e cádmio .
Em Harvard, ele serviu como instrutor por um ano e depois viajou para a Europa com uma bolsa de estudos. Ele estudou com os grandes físico-químicos da época.
Em 1899 ele viajou para a Alemanha para estudar com Wilhelm Ostwald Leipzig e depois com Walter Nernst na Universidade de Göttingen; Ele então trabalhou para o governo das Filipinas.
Trabalho acadêmico e participação na guerra
Entre 1999 e 1906, ensinou química na Universidade de Harvard e depois foi contratado pelo Massachusetts Institute of Technology, onde foi de 1907 a 1912.
Mais tarde, tornou-se professor de físico-química na Universidade da Califórnia (Berkeley), onde obteve o grau de reitor da Escola de Química.
Em 1908, ele publicou seu primeiro artigo sobre a teoria da relatividade em paralelo com Albert Einstein. Nesse sentido, estabelece que existe um elo entre a massa de energia, mas em uma direção diferente daquela usada por Einstein.
Em 21 de junho de 1912, Lewis casou-se com Mary Hinckley Sheldon, com quem teve três filhos: Margery S. Lewis, Edward S. Lewis e Richard Newton Lewis.
Seu trabalho na Califórnia I foi interrompida pela eclosão da Primeira Guerra Mundial . Em 1917, ele foi contratado para trabalhar para o exército dos EUA, onde se tornou chefe da Divisão de Defesa da Guerra Química.
A capacidade de entrega e trabalho de Lewis permitiu que o exército reduzisse o número de baixas que até então eram consequência do uso de gás pelos exércitos inimigos. No final da guerra, ele foi condecorado por seus serviços com as mais altas honras.
Morte em laboratório
Gilbert N. Lewis morreu aos 70 anos de ataque cardíaco enquanto trabalhava em seu laboratório na Universidade de Berkeley, em 23 de março de 1946.
Talvez devido à sua personalidade introvertida, esse eminente cientista nunca recebeu o Prêmio Nobel. Quase no final de sua carreira, ele conseguiu provar que a fosforescência das moléculas orgânicas é governada por um estado trigêmeo excitado, até calculando suas propriedades magnéticas.
Contribuições para a ciência
Algumas das contribuições mais importantes de Gilbert Newton Lewis para a ciência são as seguintes:
Estruturas de Lewis
São vários métodos que servem para representar a estrutura de uma molécula. Nestes, os símbolos dos elementos representam os átomos, enquanto os pontos representam os elétrons que os cercam. Um exemplo disso é a representação de hidrogênio, hélio e carbono:
Lewis foi o primeiro a propor a idéia de que os átomos poderiam permanecer unidos comparando pares de elétrons; Por isso, ele criou o simbolismo das estruturas.
A teoria do vínculo amplo proposta por Lewis serviu para agrupar todos os tipos de ligações químicas em um único conceito. Dessa forma, foi possível demonstrar as relações entre substâncias iônicas, moleculares, covalentes e metálicas. Até aquele momento, esses elementos não tinham conexão conceitual.
Ligação covalente
Ele conceituou a ligação covalente que se forma entre dois átomos quando eles se unem para alcançar o octeto estável e compartilhar elétrons do último nível, exceto o hidrogênio, que alcança estabilidade por ter 2 elétrons.
Teoria do octeto
Foi enunciado por Lewis em 1916. Nesse sentido, é estabelecido que os íons pertencentes aos elementos do sistema periódico tendem a completar seus últimos níveis de energia com um número de 8 elétrons. Isso permite que eles adquiram uma configuração muito estável.
Photon
Ele foi o criador em 1926 do termo fóton para designar a menor unidade de energia da luz. Essa partícula de energia transmite todas as formas existentes de radiação eletromagnética (raios X, infravermelho, gama, ultravioleta, microondas, ondas de rádio etc.).
Atração química e valência
Juntamente com seu colega químico Irwing Langmuir, ele desenvolveu a teoria da atração e valência químicas, conhecida como teoria de Langmuir-Lewis. Isso foi baseado na estrutura atômica das substâncias.
Água pesada
Lewis também foi o primeiro cientista a estudar e produzir água pesada (deutério) em sua forma mais pura. Ele também foi o primeiro a aplicar os princípios da termodinâmica no estudo de problemas químicos.
Teoria das soluções
Da mesma forma, Lewis é reconhecido por seu trabalho na teoria das soluções; isto é, as misturas homogêneas obtidas a partir da interposição dos átomos, moléculas ou íons presentes em duas ou mais substâncias. Essas substâncias chamadas componentes intervêm em proporções variadas.
Referências
- Gilbert Newton Lewis (1875-1946). Academia Nacional de Ciências (PDF). Consultado em nasonline.org.
- Figuras históricas em Química: Gilbert Newton Lewis (1875-1946). Consultado em uv.es
- Gilbert Newton Lewis Consultado de historia-biografia.com
- Gilbert Newton Lewis Consultado em biografiasyvidas.com
- Biografia de Gilbert N. Lewis. Consultado em biografias.wiki
- 7 coisas que você realmente precisa saber sobre Gilbert Newton Lewis, o cientista que quase venceu Einstein. Consultado em vix.com
- Gilbert Lewis e o centenário da teoria da ligação de pares de elétrons (Parte 1). Consultado em bicsociety.org