- Mapa completo dos tópicos de Química AP com ênfase em estrutura eletrónica, reações, equilíbrios, cinética, termoquímica, eletroquímica e orgânica.
- Alinhamento com ementas lusófonas (FQA 10.º/11.º e exames de acesso) para detalhar conteúdos e níveis de profundidade.
- Integração de competências de Física, Matemática e comunicação científica que sustentam o desempenho no exame.
- Referências e recursos oficiais para estudo orientado e treino com critérios de avaliação consistentes.
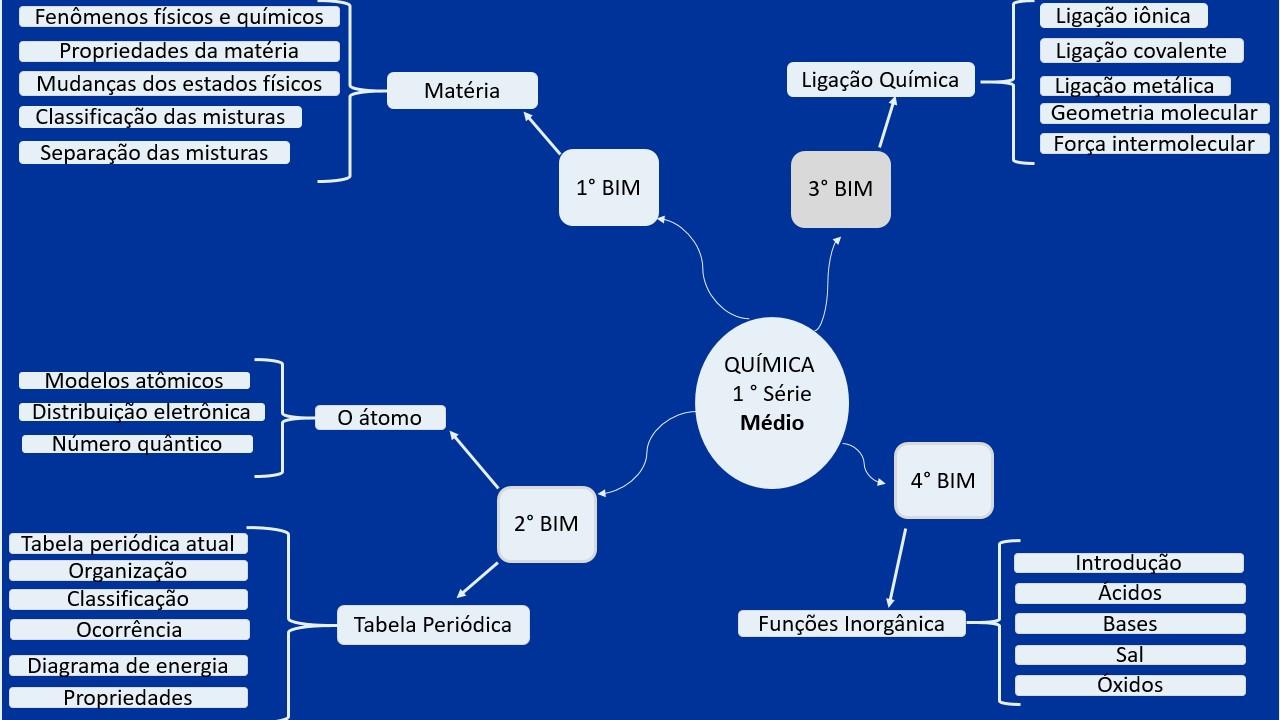
Se estás a preparar-te para o exigente universo da Química AP, vale a pena organizar a matéria com uma visão completa do curso e do exame. O programa cobre desde fundamentos atómicos e moleculares até temas avançados como equilíbrio, cinética, eletroquímica, termoquímica e química orgânica, sempre com foco em competências de resolução de problemas, raciocínio químico e análise de dados experimentais.
Para que estudes com o máximo de contexto, reunimos e cruzámos o escopo clássico da Química AP com guias e programas lusófonos de referência (Física e Química A 10.º/11.º, exames nacionais e pautas de admissão), além de apontar recursos oficiais. O resultado é um guia que alinha tópicos, profundidade e conexões interdisciplinares em matemática e física, essenciais para teres um desempenho sólido no exame.
Estrutura geral do curso de Química AP
O curso de Química AP é ministrado ao nível universitário e visa preparar o aluno para conquistar créditos nas instituições que reconhecem o exame. Os manuais utilizados são de nível superior e a ementa segue a descrição oficial da disciplina, cobrindo um espectro amplo de conceitos e aplicações.
Entre os grandes blocos de estudo, destacam-se: a química como estudo da mudança, gases e as suas leis, termoquímica (incluindo fluxos de calor, entalpia e Lei de Hess), teoria quântica e estrutura eletrónica, ligações químicas (modelo de orbitais, geometria e hibridação), estados da matéria (cristais, mudanças de fase), soluções (propriedades e concentrações), cinética e mecanismos de reação, equilíbrio químico (constantes e deslocamentos), ácidos e bases, entropia e espontaneidade, e eletroquímica.
O programa também inclui áreas de aplicação e extensão: química nuclear, metalurgia, famílias periódicas como metais alcalinos e alcalino-terrosos, características de não metálicos e metais de transição, além de uma incursão consistente por química orgânica e polímeros (naturais e sintéticos) com ênfase em estruturas, propriedades e transformações.
Para acompanhar esta amplitude, é crucial desenvolver: competência matemática (estequiometria, manipulação algébrica, logaritmos), literacia experimental (tratamento de dados, incertezas), e leitura crítica de critérios de avaliação. A secção seguinte mapeia estes tópicos a ementas lusófonas de grande qualidade, para aprofundares o estudo.
Tópicos de Química detalhados segundo ementas lusófonas
As ementas de acesso e de cursos preparatórios lusófonos ajudam a granular os temas com o nível de detalhe que a Química AP costuma exigir. Segue um alinhamento prático por temas, útil para rever a matéria com profundidade e sem lacunas.
Tema 1 — Estrutura do átomo e das moléculas
Nesta base conceitual, revê: modelos atómicos (de Dalton ao modelo quântico de nuvem eletrónica), números quânticos, princípio de exclusão de Pauli e regra de Hund. Pratica a configuração eletrónica usando notação nlx e discute carga nuclear efetiva, lei periódica e propriedades periódicas (raio atómico/iónico, energia de ionização, afinidade eletrónica, carácter metálico).
Para ligações químicas, o foco vai para moléculas diatómicas e poliatómicas, modelos de ligação iónica e covalente, geometria eletrónica e molecular e hibridação. Vale incluir exemplos de polaridade e estrutura em 3D, pois a compreensão geométrica é indispensável na Química AP.
Tema 2 — Soluções e equilíbrio líquido-vapor
Consolida o conceito de solução com critérios de classificação e propriedades macroscópicas. Trabalha solubilidade, curvas de solubilidade e fatores que a influenciam, além das múltiplas formas de expressar concentração (molaridade, molalidade, fração molar, percentagens).
Inclui dissociação eletrolítica (fortes vs. fracos) e propriedades coligativas (tonoscopia, ebulioscopia, crioscopia, pressão osmótica). No equilíbrio líquido-vapor, aprofunda pressão de vapor, transições de fase e interpretação de gráficos P-T, úteis para raciocinar sobre mudanças de fase no exame.
Tema 3 — Extensão das reações químicas e equilíbrios
Em estequiometria, revisa balanço de equações, massas molares, relações mol-mol e rendimento de reação (teórico, real e percentagem). A seguir, entra no equilíbrio químico em sistemas homogéneos e heterogéneos: características do equilíbrio dinâmico, constantes Kc e Kp, e sua interpretação.
Analisa fatores de deslocamento do equilíbrio por concentração, pressão/volume, temperatura e a leitura do princípio de Le Châtelier. Em equilíbrio de solubilidade, estuda produto de solubilidade (Kps), previsão de precipitação e comuns efeitos de ião comum. Essa malha conceitual é central na Química AP.
Tema 4 — Equilíbrio ácido-base
Revisa as teorias ácido-base (Arrhenius, Brønsted-Lowry) e o conceito de pares conjugados. Trabalha constantes de acidez e basicidade (Ka e Kb), a relação Ka.Kb e força relativa, e o produto iónico da água.
A prática diária deve envolver pH e pOH, escalas e classificação de soluções, grau de ionização, e cálculos com soluções tampão quando aplicável ao nível AP. Problemas que combinam ácido-base e equilíbrio são frequentes e exigem organização algébrica clara.
Tema 5 — Redox e eletroquímica
Começa com conceitos de oxidação e redução e o cálculo do número de oxidação. Aprende e treina métodos de acerto de reações redox (variação de número de oxidação e método ião-eletrão), incluindo meios ácido e básico.
Na eletroquímica, foca em pilhas e eletrólise, potenciais padrão, equação de Nernst e relação entre ΔG, E e K. A Química AP exige conforto a ligar energia livre, espontaneidade e constantes de equilíbrio.
Tema 6 — Cinética química
Define velocidade de reação (média e instantânea) e os fatores que a influenciam: concentração, temperatura, superfície de contacto e catalisadores. Estuda ordem de reação, lei de velocidade e mecanismos, com a ligação a passo determinante e perfis energéticos.
Usa dados experimentais para determinar ordens parciais e globais, constantes de velocidade e testar modelos de mecanismo. Gráficos integrados de leis de velocidade são ferramentas-valência nesta secção.
Tema 7 — Energia nas reações (Termoquímica)
Diferencia claramente reações endotérmicas e exotérmicas, traça diagramas de energia e domina a Lei de Hess para estimar variações de entalpia. Integra cálculos com capacidade calorífica e mudanças de estado sempre que for útil para estimativas rápidas.
Na Química AP, liga estes conceitos à termodinâmica mais ampla: entropia e energia livre para avaliar espontaneidade, contextualizando com a temperatura como variável que pode inverter tendências.
Tema 8 — Química orgânica e polímeros
Revê conceitos e classificações: hidrocarbonetos (alcanos, alcenos, alcinos), nomenclatura IUPAC, isomeria e propriedades físico-químicas. Estende aos compostos oxigenados (álcoois, aldeídos, cetonas, ácidos carboxílicos) e aminas com ênfase em grupos funcionais, reatividade típica e métodos de obtenção.
Inclui mecanismos prototípicos (adição, substituição, eliminação), cálculo de fórmulas empíricas e moleculares e uma visão geral de polímeros naturais e sintéticos, articulando aplicações industriais e biológicas. Exemplos contextualizados ancoram a memorização.
Equilíbrios, cálculos e problemas típicos do exame
Ao resolver problemas AP, vais cruzar tópicos: estequiometria com gases (PV=nRT), soluções com pH e neutralizações, equilíbrio com K e Q, e cinética com ajuste de modelos. A gestão algébrica é determinante para a precisão das respostas.
Em acerto de equações, pratica aproximações estratégicas (por exemplo, omitir x quando justificável numa ICE table) e valida o erro relativo. Em propriedades coligativas, repara na ligação a massa molar desconhecida e na distinção entre eletrólitos fortes e não eletrólitos.
Para eletroquímica, acostuma-te a converter potenciais em energia livre e a relacionar constantes de equilíbrio com a viabilidade de reações. Questões conceituais pedem interpretação de diagramas e argumentos sobre direção de processos.
Nas reações orgânicas, domina padrões de reatividade e prevê produtos maiores com base em estabilidade intermediária e regiogeoquímica (quando aplicável ao nível AP). Reconhecer o tipo de mecanismo poupa tempo precioso no exame.
Recursos oficiais e alinhamento com FQ A 10.º/11.º
Para aprofundar temas que a Química AP cobre, o programa de Física e Química A (10.º/11.º) é um apoio excelente. Consulta o documento orientador disponibilizado pela DGE no seguinte endereço: Programa FQA 10.º/11.º. A experiência mostra que reforçar estes tópicos melhora a intuição e o vocabulário científico no exame AP.
Em contexto académico, materiais institucionais complementares podem ser úteis: por exemplo, ficheiros técnicos e programas partilhados via portais universitários como este repositório. Trabalhar com documentos estruturados ajuda a priorizar conteúdos e exemplos.
Se também estás a treinar provas nacionais, há plataformas que reúnem enunciados, resoluções e critérios oficiais do IAVE (documentos do Ministério da Educação). Esses critérios são ouro para entender o nível de detalhe esperado e vale acompanhar oportunidades de apoio extra com centros especializados.
Recorda que, segundo as notas informativas, as provas e respetivas grelhas de classificação são documentos oficiais do IAVE disponibilizados em iave.pt. Sempre que estudares com base neles, confere o ano, a versão e a errata, para evitares divergências.
Exames de admissão e treino prático em Química
Um bom treino prático vem de provas com questões curtas de raciocínio e cálculo. Um exemplo típico de materiais de treino inclui conjuntos com dezenas de questões sobre evaporação, classificação de elementos, tipos de ligação, estequiometria, reações e pH, que espelham a variedade do exame AP.
Ao praticar, tenta simular a prova: limita o tempo, evita consulta e faz revisão ativa depois. Errar é parte do processo: analisa por que erraste (definição, fórmula, distração, arredondamento) e anota o “antídoto” para o próximo exercício.
Conexões com Física, Matemática e Língua Portuguesa
A Química AP é um “esporte de equipa” com Física e Matemática: movimento, energia, termodinâmica, campos, funções, logaritmos, trigonometria e análise de dados aparecem direta ou indiretamente nas questões. E comunicar ciência com clareza, em língua portuguesa, também conta.
Física essencial para a Química AP
Revisão proveitosa inclui: cinemática e dinâmica (leis de Newton), trabalho-energia, conservação da energia e do momento; movimento oscilatório e harmónico; circuitos em regime estacionário (corrente, d.d.p., resistência, associação de resistores e efeito de Joule); mecânica dos fluidos (hidrostática, Arquimedes, continuidade); termodinâmica (calor, 0.ª, 1.ª e 2.ª leis, entropia, transformações isotérmicas/isobáricas/isocóricas/adiabáticas).
Em campos e interações, reforça: gravitação universal, carga e conservação, lei de Coulomb, permitividade; campos elétrico e gravitacional, potenciais e energia potencial; e campo magnético (movimento de cargas, condutor retilíneo, interação entre correntes). Estes pilares ajudam a interpretar energia livre, potenciais e processos espontâneos na Química AP.
Matemática que faz diferença
Em álgebra, consolida: polinómios (adição, subtração, multiplicação, divisão, fatoração e casos notáveis), radicais (transformações e racionalização), frações (simplificação, somas e subtrações, frações compostas) e potências de expoente racional.
Nas equações, trabalha lineares e inequações, sistemas lineares, quadráticas e equivalentes, valores absolutos. Nas funções especiais, estuda exponenciais e logarítmicas, com ênfase nas propriedades e na resolução de equações/inequações. Logaritmos estão por todo lado em pH e cinética.
Em trigonometria, retorna ao círculo trigonométrico, funções seno, cosseno, tangente (e as recíprocas), redução ao primeiro quadrante, identidades e equações trigonométricas. Em geometria analítica, revê equação da reta, declive, paralelismo/perpendicularidade, distância entre pontos e cónicas (circunferência, elipse, hipérbole, parábola).
Para números complexos, pratica módulo e argumento, operações nas formas algébrica e trigonométrica. Em análise combinatória, exercita arranjos, permutações, combinações e o Binómio de Newton. Em algumas ementas avançadas, surgem limites, derivadas (incluindo de compostas) e derivadas de ordem superior para estudo de funções. Tudo isto melhora o teu controlo algébrico na prova.
Língua Portuguesa: precisão e clareza
Para comunicar resultados com rigor, vale afiar o idioma: classes de palavras, concordância verbal, pontuação, acentuação, classificação de orações, tipos de discurso, funções da linguagem e versificação. A interpretação de textos (literários e não literários) com autores de referência também surge em ementas, e exercitar esta competência ajuda a ler enunciados com menos ambiguidades.
Em cursos preparatórios, reforçam-se ainda: ortografia com maiúsculas, pronominalização, marcadores discursivos, formação de palavras, relações lexicais e semânticas, redução e transformação de frases, e processos sintáticos (coordenação/subordinação). Quanto melhor a linguagem, mais limpos ficam os teus raciocínios escritos.
Biologia e conexões interdisciplinares
Em ementas de ciências da vida, encontrarás pilares úteis para bioquímica e materiais: organização celular e microscopia, ultraestrutura (células eucariotas vs. procariotas), enzimas e fatores que afetam a atividade; ciclo celular (mitose e meiose) e seus significados biológicos.
Em bioenergética, revisam-se glicólise, formação de acetil-CoA, ciclo de Krebs e cadeia respiratória. Em genética, foca em ácidos nucleicos, replicação, síntese proteica e código genético, transmissão hereditária, além de origem da vida e evolução. Em fisiologia animal, entram transportes (sangue e linfa), superfícies respiratórias, sistema nervoso e glândulas endócrinas. Esses temas ajudam a contextualizar aplicações químicas em sistemas biológicos.
Bibliografia e materiais de apoio
Para química geral e orgânica, obras como Feltre (Fundamentos de Química), Petrucci (Química Geral), McMurry (Química Orgânica), Constantino (Química Orgânica, vols. 1-3), e títulos focados em nomenclatura segundo a IUPAC são basilares. Compêndios teóricos e de problemas (como Rosenberg) complementam a prática.
Em orgânica aplicada e introdução, aparecem autores como Barbosa (Química Orgânica para ciências agrárias) e Kamogawa. Para físico-química e sínteses de conteúdos, Usberco & Salvador e obras teóricas de referência ajudam a consolidar conceitos e exercícios.
Para Física, coleções de Ventura, Paixão, Fiolhais, compêndios de ensino médio, e textos sobre termodinâmica e campos são opções sólidas. Em Matemática, livros de Neves, Boulos e coleções de ensino médio cobrem desde polinómios a cálculo diferencial e integral. Guias de gramática e análise textual reforçam a precisão linguística.
Por fim, documentos institucionais e oficiais dão rumo e confiabilidade: programa de FQA 10.º/11.º da DGE (ver PDF), repositórios académicos (ficheiro UA) e outros materiais curriculares (exemplo DGES). Consultar fontes oficiais reduz ruído e garante alinhamento.
O mapa de tópicos da Química AP cruza fundamentos atómicos e moleculares, soluções, cinética, equilíbrios, termoquímica, eletroquímica e orgânica, com o reforço de Física, Matemática e competências linguísticas. Estudar por objetivos, treinar com qualidade e confrontar-te com critérios oficiais é a tríade que mais rende na preparação; com esta estrutura e as leituras certas, ganhas fluência conceitual e confiança para a prova.