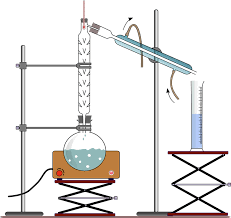
- Destilação fracionada separa líquidos miscíveis com pontos de ebulição próximos usando coluna de fracionamento.
- Equipamentos-chave: balão, fonte de calor, coluna, termômetro, condensador e frasco coletor.
- Aplicações vão do refino de petróleo à química fina e à separação do ar liquefeito.
- Escolha entre simples e fracionada depende da diferença de PE, miscibilidade e objetivo analítico.

Na prática de laboratório e em inúmeras cadeias industriais, a separação de líquidos miscíveis é um desafio comum e extremamente relevante. A destilação fracionária surge como a técnica-chave quando os componentes da mistura apresentam pontos de ebulição próximos, permitindo obter frações com elevada pureza de forma controlada e eficiente.
Antes de decidir qual equipamento comprar ou qual montagem utilizar, vale relembrar o panorama geral: destilar é aquecer uma mistura homogênea até gerar vapor e, em seguida, condensá-lo para recolher o líquido de interesse. Quando as diferenças de ebulição são pequenas (em regra, da ordem de 25 °C ou menos), recorre-se ao fracionamento com uma coluna especializada; já quando há grande diferença ou há sólido dissolvido no líquido, a destilação simples costuma dar conta do recado.
Definição de destilação e por que usar o fracionamento
Em termos gerais, a destilação é um processo físico de separação aplicado a misturas homogêneas que se baseia na volatilidade relativa de seus constituintes. Ao aquecer a mistura, forma-se um vapor enriquecido no componente de menor ponto de ebulição, enquanto o líquido remanescente no recipiente vai ficando mais rico nos componentes menos voláteis.
Esse vapor é conduzido a um condensador, onde retorna ao estado líquido e é coletado em um frasco. Em linguagem prática, o que sai pelo condensador é o destilado (rico nos compostos mais voláteis), e o que permanece no balão é o resíduo (rico nos compostos de maior ponto de ebulição). Em um sistema fracionado, esse mecanismo de enriquecimento é multiplicado ao longo da coluna, realizando várias “destilações internas” em sequência.
Quando os pontos de ebulição dos líquidos estão muito próximos, uma destilação simples falha em entregar separações nítidas. É aí que entra a coluna de fracionamento (ou de destilação), um tubo recheado com obstáculos (como anéis, contas de vidro ou porcelana) que promovem contato íntimo entre vapor ascendente e líquido descendente. Esse contato repetido cria um gradiente de temperatura e composição ao longo da coluna, ajudando o componente mais volátil a seguir para o topo, enquanto o menos volátil retorna ao balão.
Um detalhe operacional importante: durante a ebulição de uma fração relativamente pura, a temperatura tende a ficar estável em torno do ponto de ebulição desse componente; uma variação brusca no termômetro costuma indicar que a destilação daquela fração terminou e a próxima está começando, sendo a hora de alternar o recipiente coletor, se for o caso.
Como a destilação fracionada funciona na prática
O processo fracionado começa com a mistura sendo aquecida no balão. À medida que a temperatura sobe, o componente com ebulição mais baixa vaporiza primeiro. Esse vapor passa para a coluna fracionadora, onde encontra superfícies mais frias e parte condensa; simultaneamente, recebe calor do vapor que sobe e volta a evaporar. Esse vai e vem constitui o chamado equilíbrio líquido-vapor ao longo da coluna, fator decisivo na eficiência do método.
Por causa desse mecanismo, a região superior da coluna tende a ficar enriquecida no componente mais volátil, enquanto a parte inferior concentra o menos volátil. O vapor que alcança o topo segue para o condensador, onde um fluido de arrefecimento remove calor, e o líquido condensado é então coletado. Mantendo o aquecimento com cuidado, é possível obter a primeira fração com alta pureza, e depois, elevando gradualmente a temperatura, coletar as frações subsequentes.
Um truque que melhora a estabilidade da ebulição no balão é adicionar grânulos anti-colisão, que evitam fervura tumultuada e respingos. Além disso, monitorar constantemente o termômetro – sem permitir superaquecimento – é crucial para impedir que componentes mais pesados subam inadvertidamente pela coluna.
Vale lembrar que, quando os pontos de ebulição são muito próximos, um leve excesso de energia pode causar arraste conjunto dos vapores, prejudicando a separação; por isso, controlar o aquecimento com manta, chapa ou chama regulada é parte central da boa prática.
Equipamentos essenciais de bancada
Em laboratório, um arranjo típico de destilação fracionada inclui uma série de peças, cada uma com função específica. Ter o conjunto correto não só melhora os resultados como eleva a segurança durante a operação.
No conjunto básico, destacam-se os seguintes itens, amplamente citados em manuais e aulas práticas: balão de destilação (fundo redondo ou chato), fonte de calor (manta aquecedora, chapa ou bico de Bunsen), coluna de fracionamento (com recheio ou bandejas internas em escala industrial), termômetro, condensador e frasco coletor (como erlenmeyer, proveta ou balão receptor).
- : recipiente onde fica a mistura; pode receber grânulos anti-colisão para ebulição regular.
- Fonte de calor: manta, chapa ou bico de Bunsen, escolhidos conforme o controle térmico desejado.
- Coluna de fracionamento: tubo com recheio (contas de vidro/porcelana, peças de enchimento) que gera múltiplos equilíbrios líquido-vapor.
- Termômetro: acompanha a temperatura do vapor na cabeça da coluna, guiando a coleta das frações.
- Condensador: resfria o vapor e o transforma novamente em líquido.
- Recipiente de coleta: erlenmeyer, proveta ou balão, onde o destilado é recolhido com segurança.
Além do conjunto principal, muitos procedimentos incluem tripé de ferro e tela de amianto para suporte quando se usa chama, ajudando a distribuir o calor e proteger o vidro; acessórios de fixação e mangueiras bem conectadas garantem estanqueidade e evitam perdas de vapor.

Passo a passo no laboratório: exemplo água + acetona
Para visualizar a lógica do método, uma montagem didática muito comum usa uma mistura de água e acetona. A acetona possui ponto de ebulição mais baixo, então é a primeira a sair pelo condensador quando o aquecimento é bem conduzido.
- Coloque a mistura no balão de destilação e adicione grânulos anti-colisão para suavizar a ebulição.
- Monte a coluna fracionadora no balão, conecte o termômetro na posição correta (na cabeça da coluna) e ligue o condensador ao sistema de resfriamento.
- Aqueça gradualmente até iniciar a formação de vapor. No interior do balão haverá vapores de água e de acetona; o vapor sobe pela coluna e começa a interagir com o recheio.
- Na base da coluna, os vapores competem por espaço entre as superfícies do recheio; por ser mais volátil, a acetona atravessa preferencialmente a coluna e segue para o topo.
- No condensador, o vapor de acetona perde calor e retorna ao estado líquido, sendo coletado no recipiente de coleta.
- Quando a acetona se esgota, a leitura de temperatura muda, e a água passa a tentar subir; nesse momento, ajuste a coleta ou encerre, conforme o objetivo.
Um alerta importante frequentemente dado em aulas: para evitar que a água atravesse a coluna junto com os últimos traços de acetona, mantenha o aquecimento sob controle. Em arranjos comuns, recomenda-se não ultrapassar cerca de 58 °C enquanto se coleta a fração mais volátil, pois acima disso a acetona já terá sido praticamente toda removida e o vapor de água começará a chegar ao condensador.
Outro ponto didático é a relação entre ponto de ebulição e densidade do vapor: em geral, quanto menor o ponto de ebulição, menor tende a ser a densidade do vapor; a recíproca também costuma ocorrer. Essa correlação ajuda a entender por que a fração mais leve sobe com mais facilidade pela coluna, sobretudo quando o perfil térmico está bem estabelecido.
Destilação fracionada do petróleo
O caso industrial mais emblemático é o refino do petróleo, uma mistura complexa de hidrocarbonetos que dá origem a várias frações comerciais. A separação ocorre numa torre de destilação (torre de fracionamento) alta, com bandejas internas e um forte gradiente de temperatura: mais quente na base e mais frio no topo.
Primeiro, o petróleo bruto é pré-aquecido em uma fornalha e alimentado na base ou em pontos inferiores da torre. À medida que a mistura sobe, compostos de cadeia mais longa (e maior ponto de ebulição) condensam nas regiões inferiores e são retirados como frações pesadas – normalmente escuras, viscosas e de difícil evaporação; por sua vez, os compostos mais leves, de cadeias menores e pontos de ebulição baixos, sobem e condensam em bandejas mais altas, sendo coletados separadamente.
Para fins didáticos, vale citar exemplos e ordens de saída apontados em materiais educativos: GLP ou gás do petróleo pode aparecer por volta de ≈20 °C; a gasolina é coletada em um intervalo aproximado de ≈120-150 °C; o querosene pode surgir entre ≈170-300 °C; frações como diesel tendem a surgir em faixas superiores, frequentemente por volta de ≈270 °C ou acima; lubrificantes surgem mais acima (≈340 °C), óleos pesados podem exigir ≈500 °C, e resíduos para asfalto chegam a patamares ainda maiores, da ordem de ≈600 °C. Esses números são indicativos e variam com a origem do petróleo, a configuração da unidade e a especificação do produto.
É comum em textos introdutórios destacar também a ordem crescente de pontos de ebulição, como butano → gasolina → querosene, para fixar a lógica de que os mais voláteis saem primeiro. Em escala industrial, parte da separação pode envolver recirculações e estágios adicionais, mas o princípio é o mesmo do laboratório: aproveitar diferenças de volatilidade sob um perfil térmico controlado.
Destilação simples x fracionada: quando usar cada uma
Embora ambas se apoiem na mesma base física, a escolha do método depende do tipo de mistura e da diferença entre os pontos de ebulição. Em linhas gerais, a destilação simples é indicada quando queremos separar um sólido dissolvido em um líquido (por exemplo, água e sal) ou quando os líquidos possuem grande diferença de ebulição. Em muitos guias, cita-se também a conveniência quando o solvente ferve abaixo de ≈150 °C a 1 atm.
Já a destilação fracionada é a solução para separar líquidos miscíveis com pontos de ebulição próximos. A presença da coluna fracionadora é o que viabiliza a eficiência, pois ela impõe múltiplos equilíbrios interno ao sistema. Em contrapartida, o processo costuma ser mais demorado e exigente em energia e controle térmico quando comparado à destilação simples.
| Característica | Destilação simples | Destilação fracionada |
|---|---|---|
| Tipo de mistura | Sólido + líquido ou líquidos com grande diferença de PE | Líquidos miscíveis com PE próximos (≈ até 25 °C) |
| Equipamentos | Arranjo básico: balão, condensador, coletor | Inclui coluna fracionadora e controle fino de temperatura |
| Eficiência | Alta para misturas simples; baixa para PE próximos | Alta eficiência para misturas com PE semelhantes |
| Exemplos | Água + sal; purificação de solventes | Refino de petróleo; separação água + acetona |
Uma observação que gera dúvidas: por vezes se menciona o uso de vapor para separar óleos e outros líquidos imiscíveis com água; esse arranjo é conhecido como destilação a vapor (ou hidrodestilação) e não é a fracionada clássica. Ainda assim, o raciocínio de empregar diferenças de volatilidade permanece, e a escolha do método depende do objetivo analítico ou produtivo.
Aplicações e exemplos relevantes
Para além do petróleo, a destilação fracionada encontra lugar em várias frentes. Em laboratórios de química orgânica, é rotina separar misturas de solventes e frações com volatilidade parecida para purificação de compostos finos. Em escala piloto e industrial, a técnica viabiliza processos de síntese e a produção de intermediários farmacêuticos.
Na indústria de bebidas, colunas e alambiques contribuem para separar etanol de outros constituintes do mosto fermentado, controlando o perfil aromático e o teor alcoólico. Embora o desenho do equipamento varie muito, a lógica de volatilidade e condensação se mantém.
Outra aplicação dita em materiais de ensino é a separação dos componentes do ar liquefeito, obtendo oxigênio, nitrogênio e argônio em etapas com controle rigoroso de temperatura e pressão. Em tecnologia de materiais, há processos envolvendo compostos como clorossilanos, a partir dos quais se pode alcançar silício de alta pureza para a indústria de semicondutores, ilustrando bem o impacto econômico do fracionamento.
Em atividades analíticas e de P&D, é comum complementar a destilação com técnicas como cromatografia líquida (HPLC) e espectrometria de massa quando se busca caracterização fina das frações; muitas organizações adquirem inclusive equipamentos recondicionados, viabilizando custo-benefício melhor em laboratórios de menor porte.
Escolha do método, escala e segurança
Como escolher o arranjo adequado? Em testes simples e de pequena escala, um setup de laboratório padrão atende bem. Se o objetivo é operar com volumes maiores ou temperaturas elevadas, considere adquirir equipamentos especializados e prever estrutura física (capelas, bancadas, pontos de água e energia) compatível com a demanda.
Independentemente do porte, é imprescindível seguir normas de saúde e segurança. Isso inclui seleção de vidrarias e juntas compatíveis, conexões bem vedadas, uso correto do fluido de resfriamento, manipulação adequada de materiais perigosos e planos de contenção de derrames e vapores. A limpeza do ambiente e a organização dos materiais (com rotulagem e registro) reduzem riscos e elevam a reprodutibilidade.
Outro ponto de decisão é a natureza da mistura. Se há grande diferença de PE ou sólidos dissolvidos, destilação simples pode bastar. Se os líquidos são miscíveis e os pontos estão próximos, opte pela fracionada com coluna apropriada; quando há imiscibilidade, considere destilação a vapor. O termômetro é seu aliado: patamares de temperatura estáveis ajudam a identificar qual fração está saindo.
Por fim, lembre que a eficiência da coluna depende do número de pratos teóricos (ou do tipo de recheio) e da taxa de refluxo efetiva. Ajustes na potência de aquecimento e na condensação permitem encontrar o ponto ótimo entre pureza, rendimento e tempo de operação.
Perguntas rápidas (FAQ)
Quando devo usar destilação fracionada? Use quando os componentes da mistura líquida têm pontos de ebulição próximos e são miscíveis entre si; a coluna fracionadora garante a separação com precisão superior à destilação simples.
Quais setores mais utilizam a técnica? Refinarias de petróleo, indústria de bebidas, química fina e laboratórios acadêmicos/industriais fazem uso extensivo, assim como processos de separação de gases criogênicos.
Qual a principal diferença para a destilação simples? A simples funciona muito bem quando há grande diferença de PE (ou sólido dissolvido), enquanto a fracionada emprega uma coluna para separar líquidos de PE semelhantes.
Que sinais indicam troca de fração? Normalmente, uma variação abrupta na leitura do termômetro indica o fim de uma fração e o início da próxima; é o momento de ajustar a coleta.
Partindo do conceito e das diferenças fundamentais, passando pelos equipamentos, pelo passo a passo e por casos emblemáticos como o refino do petróleo, fica claro que a destilação fracionada é uma das operações de separação mais versáteis e didáticas da química. Com atenção ao controle de temperatura, ao dimensionamento da coluna e à segurança, ela entrega frações limpas em laboratório e em grande escala, cobrindo desde a purificação de solventes até cadeias industriais complexas.