A acetilcolinesterase é uma enzima encontrada no sistema nervoso que desempenha um papel crucial na regulação da atividade do neurotransmissor acetilcolina. Sua principal função é a degradar a acetilcolina, permitindo a transmissão de sinais nervosos de forma eficiente e controlada. Este processo é essencial para a comunicação entre os neurônios e para a coordenação de diversas funções fisiológicas.
Além disso, a acetilcolinesterase também é alvo de diversos inibidores que podem interferir em sua atividade, resultando em efeitos variados no organismo. Estes inibidores podem ser utilizados como pesticidas, agentes terapêuticos ou até mesmo como armas químicas. Portanto, compreender a estrutura e as funções da acetilcolinesterase, bem como os mecanismos de ação de seus inibidores, é de extrema importância para o desenvolvimento de novas terapias e para a prevenção de intoxicações.
Qual é o papel desempenhado pela enzima acetilcolinesterase no organismo humano?
A acetilcolinesterase é uma enzima essencial para o funcionamento do organismo humano. Ela atua como um regulador do neurotransmissor acetilcolina, que desempenha um papel fundamental na comunicação entre os neurônios.
Quando um impulso nervoso é transmitido de um neurônio para outro, a acetilcolinesterase quebra a acetilcolina, evitando que ela se acumule na sinapse e permitindo que o impulso nervoso seja interrompido de forma eficaz. Isso ajuda a manter a comunicação entre os neurônios sob controle e evita a superexcitação do sistema nervoso.
Além disso, a acetilcolinesterase desempenha um papel importante na regulação da atividade muscular. Ela é responsável por degradar a acetilcolina liberada nas junções neuromusculares, permitindo que os músculos relaxem após a contração. Sem a ação dessa enzima, os músculos poderiam ficar constantemente contraídos, levando a problemas como espasmos musculares e rigidez.
Em resumo, a acetilcolinesterase é crucial para o funcionamento adequado do sistema nervoso e muscular no organismo humano. Qualquer desregulação ou inibição dessa enzima pode levar a sérios problemas de saúde, como a síndrome da desregulação colinérgica.
Inibidores da enzima acetilcolinesterase: conheça suas características e efeitos no organismo.
Inibidores da enzima acetilcolinesterase: são substâncias que bloqueiam a ação da enzima acetilcolinesterase, responsável pela quebra do neurotransmissor acetilcolina. Esses inibidores podem ser de origem natural ou sintética e têm diferentes efeitos no organismo.
A acetilcolinesterase é uma enzima presente em diversos tecidos do corpo, especialmente no sistema nervoso, onde atua na regulação da transmissão de sinais nervosos. Sua principal função é degradar a acetilcolina, um neurotransmissor importante para a comunicação entre os neurônios.
Quando os inibidores da acetilcolinesterase entram em contato com a enzima, impedem que ela cumpra sua função de degradação da acetilcolina. Isso leva a um acúmulo do neurotransmissor na fenda sináptica, prolongando a ação da acetilcolina nos receptores pós-sinápticos.
Os inibidores da enzima acetilcolinesterase são amplamente utilizados em medicamentos para tratar doenças como o mal de Alzheimer, onde a deficiência de acetilcolina está associada à perda de memória e outras funções cognitivas. No entanto, esses medicamentos também podem ter efeitos colaterais, como náuseas, vômitos e diarreia.
É importante ressaltar que o uso de inibidores da acetilcolinesterase deve ser feito sob orientação médica, pois seu uso inadequado pode causar sérios danos à saúde. Além disso, é essencial monitorar os efeitos colaterais e ajustar a dose conforme necessário.
Inibidores da colinesterase: entenda o seu funcionamento e aplicações na saúde.
Os inibidores da colinesterase são substâncias que atuam bloqueando a enzima acetilcolinesterase, responsável pela quebra do neurotransmissor acetilcolina. Essa ação resulta em um aumento da concentração de acetilcolina na sinapse, promovendo uma maior transmissão de impulsos nervosos.
A acetilcolinesterase, também conhecida como AChE, desempenha um papel fundamental no sistema nervoso, facilitando a transmissão de sinais entre os neurônios. Quando essa enzima é inibida, a acetilcolina permanece ativa por mais tempo, o que pode ter diversas aplicações na saúde.
Os inibidores da colinesterase são comumente utilizados no tratamento de doenças como o Alzheimer, onde a deterioração das funções cognitivas está associada à deficiência de acetilcolina no cérebro. Ao bloquear a enzima que degrada esse neurotransmissor, os inibidores ajudam a melhorar a comunicação entre os neurônios e a retardar o avanço da doença.
Além do Alzheimer, os inibidores da colinesterase também são empregados no tratamento de outras condições, como o glaucoma e a miastenia gravis. Em ambos os casos, a inibição da acetilcolinesterase visa melhorar a função muscular e reduzir os sintomas associados a essas doenças.
Em resumo, os inibidores da colinesterase atuam bloqueando a enzima acetilcolinesterase, o que resulta em um aumento da concentração de acetilcolina e uma melhoria na transmissão de impulsos nervosos. Essas substâncias têm diversas aplicações na saúde, sendo especialmente importantes no tratamento de doenças neurodegenerativas e distúrbios neuromusculares.
Métodos para bloquear a ação da acetilcolinesterase no organismo de forma eficaz.
A acetilcolinesterase é uma enzima responsável por quebrar o neurotransmissor acetilcolina, desempenhando um papel fundamental na transmissão de impulsos nervosos no organismo. No entanto, em certas situações, é desejável bloquear a ação dessa enzima, como no tratamento de certas doenças ou envenenamentos.
Existem diferentes métodos para bloquear a ação da acetilcolinesterase de forma eficaz. Um dos principais é o uso de inibidores da enzima, que se ligam ao sítio ativo da acetilcolinesterase e impedem que ela quebre a acetilcolina. Exemplos de inibidores incluem a fisostigmina e o neostigmina, que são utilizados no tratamento de miastenia gravis e em casos de intoxicação por agentes neurotóxicos.
Outra forma de bloquear a ação da acetilcolinesterase é através do uso de agentes químicos que se ligam de forma irreversível à enzima, inibindo-a permanentemente. Esses agentes são frequentemente utilizados como armas químicas e representam um sério risco para a saúde pública.
Além disso, a pesquisa tem se concentrado no desenvolvimento de novos inibidores da acetilcolinesterase com maior eficácia e seletividade, visando minimizar os efeitos colaterais e melhorar o tratamento de doenças relacionadas ao sistema nervoso.
Em resumo, a inibição da acetilcolinesterase é um processo crucial para o tratamento de diversas condições médicas, e o desenvolvimento de novos métodos e compostos inibidores representa uma área importante de pesquisa na busca por terapias mais eficazes e seguras.
Acetilcolinesterase: estrutura, funções e inibidores
A acetilcolinesterase (acetil hidrolase acetilcolina, EC 3.1.1.7) é uma enzima encontrada principalmente no sistema nervoso central . Sua tarefa, como o nome indica, é o processamento hidrolítico do neurotransmissor acetilcolina.
É uma enzima associada à membrana celular que trabalha em conjunto com o receptor de acetilcolina para mediar a excitação de células pós-sinápticas e cujo mecanismo catalítico é surpreendentemente rápido.
Do ponto de vista mecânico, esta enzima pode ser vista como uma serina hidrolase e, no domínio catalítico de seu sítio ativo, contém a tríade de aminoácidos característicos das serina proteases: serina, histidina e um resíduo ácido. No entanto, o resíduo ácido é um glutamato, enquanto as serina proteases normalmente possuem aspartato.

Uma das primeiras observações que ligaram a atividade catalítica da acetilcolinesterase com tecidos nervosos colinérgicos e tecidos musculares foi feita por Dale em 1914; subsequentemente, foi determinado que também está presente em neurônios não colinérgicos e em células hematopoiéticas, osteogênicas e neoplásicas.
Atualmente, graças ao estudo de vários organismos, sabe-se que a enzima está presente na membrana de diferentes tipos de células, como eritrócitos, células nervosas e musculares, órgãos elétricos e outros.
Estrutura
Estrutura terciária e quaternária
Sob condições naturais ou ” in vivo” , a acetilcolinesterase é uma enzima polimórfica composta por várias subunidades catalíticas de mais ou menos 80 kDa, que são montadas para formar uma estrutura oligomérica (de várias subunidades).
A quantidade e complexidade dessas subunidades depende do tipo de célula e das espécies consideradas.
Algumas das formas enzimáticas mais complexas têm subunidades catalíticas com formas globulares (G) ou assimétricas (A) ligadas por pontes dissulfeto. Pontes dissulfeto são ligações covalentes formadas entre duas moléculas de enxofre dos grupos tiol (-SH) de dois resíduos do aminoácido cisteína.
Cada subunidade G contém um único local ativo, enquanto as subunidades A, em geral, são caracterizadas por possuir três domínios estruturais, a saber: subunidades catalíticas, algumas caudas do tipo colágeno, ricas em resíduos de glicina, hidroxiprolina e hidroxilisina, entre outras. caudas não colagênicas (exceto colágeno).
As formas assimétricas de acetilcolinesterase são conhecidas como A12, A8 e A4, que possuem 12, 8 e 4 subunidades catalíticas, respectivamente.
Geralmente, os resíduos do domínio catalítico no local ativo estão em uma região “profunda” das subunidades, o que pode ser visto como contraditório quanto à taxa de reação rápida que catalisa essa enzima e à aparente inacessibilidade do substrato a esses locais. .
Independentemente do polimorfismo enzimático, as subunidades globulares e assimétricas têm atividades catalíticas semelhantes.
Variantes
Algumas células que não as nervosas, como os eritrócitos, produzem enzimas predominantemente globulares, diméricas e acetilcolinesterase, principalmente associadas à face externa da membrana plasmática.
A enzima eritrocitária, embora de menor complexidade estrutural, também é uma enzima anfipática, cujo domínio catalítico ativo é encontrado na grande região hidrofílica, enquanto o domínio hidrofóbico, que contém a região carboxila terminal, é responsável por apoiá-lo na membrana. .
Estrutura primária
Grande parte do conhecimento atual sobre a sequência da acetilcolinesterase surgiu do estudo da enzima Torpedo californica, um peixe-raio que habita o Oceano Pacífico e tem sido tradicionalmente usado como organismo modelo para o estudo de diferentes proteínas do sistema nervoso.
As subunidades da acetilcolinesterase são sintetizadas como pró-proteínas que são então processadas para dar origem a subunidades maduras. Cada subunidade consiste em um polipeptídeo de cerca de 575 aminoácidos e peso molecular de 65 kDa, que é aumentado pela adição de 7-8% de resíduos de carboidratos (glicosilação).
A atividade catalítica do local ativo das subunidades é determinada por um resíduo serina na posição 200, que está localizado em uma região “profunda” das subunidades catalíticas.
Diferentes variantes ou isoformas da enzima existem nos organismos, graças a diferentes locais para a ” emenda alternativa” dos pré-RNAs mensageiros nas duas extremidades (5 ‘e 3’) . A sequência do terminal carboxil da isoforma de cada subunidade é o que determina a montagem dos oligômeros entre si.
Funções
A acetilcolinesterase é uma enzima com múltiplas funções biológicas não necessariamente relacionadas entre si. Fato testemunhado por sua expressão diferencial durante a embriogênese, extensão neural embrionária, desenvolvimento muscular e sinaptogênese.
Como observado acima, ele tem uma função importante na rápida hidrólise da acetilcolina e, portanto, na regulação de seu efeito no espaço sináptico neuromuscular ou nos espaços sinápticos colinérgicos do sistema nervoso central.
Um exemplo de suas funções é a contração do músculo esquelético, que ocorre graças a um tipo de sinapse química conhecida como placa motora, localizada entre um neurônio motor e uma fibra muscular.
Nesta sinapse, são obtidas centenas de vesículas carregadas com acetilcolina, que são liberadas pelo neurônio motor para a propagação de um impulso elétrico.
Esse processo de neurotransmissão é bastante complexo, no entanto, a participação da acetilcolinesterase é crucial para o término da transmissão sináptica que depende do neurotransmissor acetilcolina, uma vez que deve ser degradada e depois difundida da fenda sináptica para culminar com a excitação de membrana.
Assim, a enzima acetilcolinesterase é responsável por regular a concentração desse transmissor na sinapse neuromotora.
Outras funções “não clássicas” da enzima estão relacionadas à neurogênese ou crescimento de células nervosas; com os processos de adesão celular, sinaptogênese, ativação dos neurônios-dopamina na substância negra do mesencéfalo, processos hematopoiéticos e trombo poético, entre outros.
Inibidores
Os inibidores da acetilcolinesterase funcionam impedindo a hidrólise em acetilcolina, aumentando assim o nível e a duração da ação desse neurotransmissor. Eles podem ser classificados, de acordo com seu mecanismo de ação, como reversíveis e irreversíveis.
Inibidores irreversíveis
São aqueles que inibem irreversivelmente a atividade hidrolítica da acetilcolinesterase por sua ligação covalente ao resíduo serina no local ativo da enzima. Este grupo é composto principalmente de organofosforados.
Em geral, são compostos ativos presentes em muitos inseticidas e são responsáveis por um grande número de mortes acidentais por envenenamento. São ésteres ou tióis derivados de ácido fosfórico, fosfônico, fosfônico ou fosforâmico.
Sarin, tabun, soman e ciclososarina estão entre os compostos mais tóxicos sintetizados pelo homem, pois podem matar um ser humano ao induzir falhas respiratórias e circulatórias ao bloquear a acetilcolinesterase no sistema nervoso periférico .
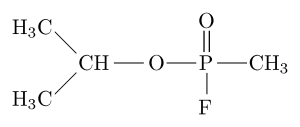
Sarin, por exemplo, é um “gás nervoso” que tem sido usado como arma química para uso terrorista.
Inibidores reversíveis
Essa ordem de classificação agrupa inibidores competitivos e não competitivos que funcionam por carbamilação transitória e reversível de um resíduo de serina no local ativo e muitos foram sintetizados e purificados a partir de fontes vegetais ou fúngicas.
Os carbamatos, como a fisostigmina e a neostigmina, são inibidores reversíveis utilizados como fármacos para o tratamento de doenças como glaucoma e miastenia gravis, respectivamente.
Outros agentes terapêuticos deste grupo também são utilizados para o tratamento da doença de Alzheimer, Parkinson, obstruções intestinais pós-operatórias (íleo pós-operatório), distensão da bexiga e como antídotos para overdose de anticolinérgicos.
Butirilcolinesterase
Um mecanismo natural interessante contra algumas substâncias inibidoras da acetilcolinesterase tem a ver com a participação de uma enzima menos específica conhecida como butirilcolinesterase.
Essa enzima também é capaz de hidrolisar a acetilcolina e, ao mesmo tempo, pode atuar como uma atração molecular que reage com essas toxinas antes que exerçam seu efeito negativo sobre a acetilcolinesterase.
Acetilcolinesterase e doença de Alzheimer
Foi demonstrado que a acetilcolinesterase forma um complexo estável com os componentes das placas senis características da patologia. Além disso, alguns padrões alterados de glicosilação dessa enzima têm sido relacionados à presença e formação de placas amilóides no cérebro.
Muitos dos inibidores reversíveis da acetilcolinesterase, portanto, têm sido utilizados como fármacos de primeira geração para o tratamento desta doença e outras condições neurodegenerativas relacionadas. Entre eles estão donepezil, rivastigmina e galantamina.
Referências
- Dvir, H., Silman, I., Harel, M., Rosenberry, TL, & Sussman, JL (2010). Acetilcolinesterase: da estrutura 3D para a função. Interações químico-biológicas , 187 , 10–22.
- Houghton, P., Ren, Y., & Howes, M. (2006). Inibidores da acetilcolinesterase de plantas e fungos. Natural Product Reports , 23 , 181-199.
- Krsti, DZ, Lazarevi, TD, Bond, AM e Vasi, VM (2013). Inibidores da acetilcolinesterase: Farmacologia e Toxicologia. Current Neuropharmacology , 11 , 315–335.
- Mukherjee, PK, Kumar, V., Mal, M., & Houghton, PJ (2007). Inibidores da acetilcolinesterase de plantas. Phytomedicine , 14 , 289-300.
- Quinn, DM (1987). Acetilcolinesterase: estrutura enzimática, dinâmica de reação e estados de transição virtual. Chem. Rev. , 87 , 955-979.
- Racchi, M., Mazzucchelli, M., Porrello, E., Lanni, C., & Govoni, S. (2004). Inibidores da acetilcolinesterase: novas atividades de moléculas antigas. Pesquisa Farmacológica , 50 , 441–451.
- Rosenberry, T. (1975). Acetilcolinesterase. Avanços em Enzimologia e Áreas Relacionadas da Biologia Molecular , 43 , 103-218.
- Soreq, H. & Seidman, S. (2001). Acetilcolinesterase – novos papéis para um ator antigo. Nature Reviews , 2 , 294-302.
- Talesa, VN (2001). Acetilcolinesterase na doença de Alzheimer. Mecanismos de envelhecimento e desenvolvimento , 122 , 1961-1969.