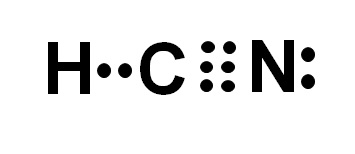O ácido hidrociânico, também conhecido como ácido cianídrico, é um composto químico extremamente tóxico, composto por um átomo de hidrogênio, um átomo de carbono e um átomo de nitrogênio. Sua fórmula química é HCN. Ele possui uma estrutura molecular linear e é considerado um ácido fraco em solução aquosa. Devido à sua toxicidade, o ácido hidrociânico é utilizado principalmente na indústria química, na produção de cianetos metálicos e na síntese de diversos compostos orgânicos. Além disso, ele também é utilizado na produção de pesticidas, na indústria de galvanoplastia e em processos de purificação de metais. Devido ao seu alto grau de toxicidade, o manuseio e armazenamento do ácido hidrociânico devem ser feitos com extrema cautela e seguindo todas as normas de segurança.
Principais características do ácido cianídrico: conheça suas propriedades e usos na indústria química.
O ácido cianídrico, também conhecido como ácido prússico, é um composto químico altamente tóxico com a fórmula HCN. Sua estrutura molecular é formada por um átomo de hidrogênio ligado a um átomo de carbono, que por sua vez está ligado a um átomo de nitrogênio. Esta ligação é extremamente instável, o que torna o ácido cianídrico um composto altamente volátil e perigoso.
Uma das principais características do ácido cianídrico é sua capacidade de inibir a respiração celular, levando à asfixia e à morte em doses elevadas. Por ser altamente tóxico, seu manuseio requer extrema precaução e equipamentos de proteção adequados. No entanto, apesar de sua periculosidade, o ácido cianídrico possui diversos usos na indústria química.
Na indústria, o ácido cianídrico é utilizado na produção de plásticos, adesivos e produtos químicos. Além disso, é empregado na metalurgia para extrair ouro e prata de minérios, através do processo de cianetação. Seu papel como agente de complexação também é explorado em processos de galvanização e na fabricação de produtos farmacêuticos.
Suas propriedades e usos são amplamente explorados em diversos setores, apesar dos riscos associados à sua manipulação.
Descubra a fórmula molecular do ácido cianídrico.
O ácido hidrociânico, também conhecido como ácido cianídrico, é um composto químico extremamente tóxico e volátil. Sua fórmula molecular é HCN, onde H representa um átomo de hidrogênio, C representa um átomo de carbono e N representa um átomo de nitrogênio.
A estrutura molecular do ácido cianídrico consiste em um átomo de carbono ligado a um átomo de nitrogênio por uma ligação tripla, e o átomo de hidrogênio está ligado ao átomo de carbono. Essa estrutura confere ao composto suas propriedades altamente tóxicas e voláteis.
As propriedades físico-químicas do ácido hidrociânico incluem um odor característico de amêndoas amargas, uma densidade maior que a do ar e uma solubilidade em água. Suas propriedades tóxicas são devidas à capacidade do composto de inibir a enzima citocromo c oxidase, o que interfere no processo de respiração celular.
O ácido cianídrico é utilizado em diversas aplicações industriais, como na produção de plásticos, na extração de metais preciosos e na fabricação de pesticidas. No entanto, devido à sua alta toxicidade, o manuseio e o armazenamento desse composto requerem cuidados especiais para garantir a segurança dos trabalhadores e do meio ambiente.
Qual a utilidade do HCN?
O Ácido hidrociânico, também conhecido como cianeto de hidrogênio, é uma substância extremamente tóxica e volátil, com a fórmula química HCN. Sua estrutura molecular consiste em um átomo de carbono ligado a um átomo de nitrogênio e a um átomo de hidrogênio.
Devido à sua alta toxicidade, o HCN é usado principalmente na indústria química para a produção de uma variedade de compostos, como cianetos metálicos e plásticos. Além disso, o ácido hidrociânico também é utilizado na fabricação de pesticidas e herbicidas.
Uma das propriedades mais perigosas do HCN é sua capacidade de inibir a respiração celular, o que pode levar à asfixia e à morte em doses elevadas. Por esse motivo, é essencial manusear essa substância com extrema precaução e seguir todas as medidas de segurança recomendadas.
Seu uso requer cuidados especiais devido ao seu potencial letal em caso de exposição inadequada.
Locais de ocorrência do ácido cianídrico.
O ácido cianídrico, também conhecido como ácido prússico, é uma substância química altamente tóxica que pode ser encontrada em diversos locais. Uma das principais fontes naturais de ácido cianídrico são algumas plantas, como a mandioca brava e as sementes de maçã. Além disso, o ácido cianídrico pode ser produzido a partir da queima de materiais contendo cianeto, como plásticos e tecidos.
Outro local onde o ácido cianídrico pode ser encontrado é na indústria química, onde é utilizado na fabricação de produtos como plásticos, corantes e pesticidas. Devido à sua alta toxicidade, o ácido cianídrico é manuseado com extremo cuidado nessas indústrias, a fim de evitar acidentes e contaminações.
Sua toxicidade exige atenção redobrada em seu manuseio e armazenamento, a fim de prevenir danos à saúde humana e ao meio ambiente.
Ácido hidrociânico: estrutura molecular, propriedades, usos
O ácido cianídrico ou cianeto de hidrogénio é um composto orgânico, cuja fórmula química é HCN. Também é conhecido como metanonitrila ou formonitrila e, até vários anos atrás, como ácido prússico, embora este seja realmente outro composto.
O ácido cianídrico é um gás incolor e extremamente venenoso, obtido através do tratamento de cianetos com ácidos. Este ácido é encontrado na semente de pêssego, conhecida em muitos lugares também como pêssego.
A uma temperatura ambiente inferior a 25 ° C, é um líquido e, acima dessa temperatura, é um gás. Nos dois casos, é extremamente tóxico para seres humanos, animais e até a maioria dos microrganismos não acostumados a ele.É um bom solvente para íons. É muito instável porque tende a polimerizar facilmente.
É encontrado no reino vegetal incorporado nas moléculas de alguns glicosídeos, pois quando são hidrolisados pelas enzimas da planta, são obtidos HCN, glicose e benzaldeído.
Esses glicosídeos estão dentro das sementes de certas frutas, como pêssegos, damascos, cerejas, ameixas e amêndoas amargas, portanto nunca devem ser ingeridas.
Também é encontrado em glicosídeos vegetais, como alguns tipos de sorgo. Além disso, algumas bactérias produzem durante o seu metabolismo.É usado principalmente na produção de polímeros e em alguns processos metalúrgicos.
HCN é um veneno letal por inalação, ingestão e contato. Está presente na fumaça do cigarro e no fogo de plásticos e materiais que contêm carbono e nitrogênio. É considerado poluente do ar porque ocorre durante a combustão de material orgânico de grandes áreas do planeta.
Estrutura molecular e configuração eletrônica
O cianeto de hidrogênio ou cianeto de hidrogênio é um composto molecular covalente com um átomo de hidrogênio, um carbono e um nitrogênio.
Os átomos de carbono e nitrogênio compartilham 3 pares de elétrons, formando uma ligação tripla. O hidrogênio está ligado ao carbono, que nessa união tem sua valência de quatro e seu octeto de elétrons completo.
O nitrogênio tem uma valência de cinco e, para completar seu octeto, possui um par de elétrons ausentes ou solitários localizados lateralmente.
O HCN é, portanto, uma molécula completamente linear, com um par de elétrons ausentes localizados lateralmente no nitrogênio.
Nomenclatura
– ácido cianídrico
– Cianeto de hidrogénio
– Metanonitrilo
– Formonitrilo
– ácido cianídrico
Propriedades
Estado físico
Abaixo de 25,6 ° C, se for anidro e estabilizado, é um líquido azul incolor ou azul claro que é muito instável e tóxico. Se estiver acima dessa temperatura, é um gás incolor extremamente venenoso.
Peso molecular
27,03 g / mol
Ponto de fusão
-13.28 ° C
Ponto de ebulição
25,63 ° C (observe que ferve um pouco acima da temperatura ambiente).
Ponto de inflamação
-18 ºC (método do copo fechado)
Temperatura de auto-ignição
538 ° C
Densidade
0,6875 g / cm 3 a 20 ° C
Solubilidade
Totalmente miscível com água, álcool etílico e éter etílico.
Constante de dissociação
K = 2,1 x 10 -9
pK a = 9,2 (é um ácido muito fraco)
Algumas propriedades químicas
O HCN possui uma constante dielétrica muito alta (107 a 25 ° C). Isto é porque as suas moléculas são polares e estão associados por pontes de hidrogénio, tal como no caso de água H 2 O.
Por ter uma constante dielétrica tão alta, o HCN acaba sendo um bom solvente ionizante.
O HCN anidro líquido é muito instável, tende a polimerizar violentamente. Para evitar este é adicionado estabilizantes tais como uma pequena percentagem de H 2 SO 4 .
Em solução aquosa e na presença de amônia e alta pressão forma-se adenina, um composto que faz parte do DNA e RNA, ou seja, uma molécula biologicamente importante.
É um ácido muito fraco, já que sua constante de ionização é muito pequena, portanto apenas ioniza parcialmente em água, originando o ânion CN – cianeto . Forme sais com as bases, mas não com carbonatos.
Suas soluções aquosas não protegidas da luz se decompõem lentamente, gerando formato de amônio HCOONH 4 .
Em solução, tem um cheiro fraco de amêndoa.
Corrosividade
Ser um ácido fraco geralmente não é corrosivo.
No entanto, soluções aquosas de HCN contendo ácido sulfúrico como estabilizador atacam fortemente o aço a temperaturas superiores a 40 ° C e o aço inoxidável a temperaturas superiores a 80 ° C.
Além disso, soluções aquosas diluídas de HCN podem causar estresse no aço carbono, mesmo em temperatura ambiente.
Também pode atacar alguns tipos de borracha, plásticos e revestimentos.
Localização da natureza
É relativamente abundante no reino vegetal como parte dos glicosídeos.
Por exemplo, é gerada a partir de tonsilas C 6 H 5 -CH (CN) -O-glicose-O-glicose, o composto presente nas amêndoas amargas. A amigdalina é um beta-glicosídeo cianogênico, porque hidrolisa forma duas moléculas de glicose, uma de benzaldeído e uma de HCN. A enzima que os libera é a beta-glucoxidase.
A amígdala pode ser encontrada nas sementes de pêssegos, damascos, amêndoas amargas, cerejas e ameixas.
Alguns tipos de plantas de sorgo contêm o glicosídeo cianogênico chamado durrin (ou seja, p-hidroxi- ( S ) -mandelonitrila-beta-D-glucosídeo). Este composto pode ser degradado por uma hidrólise enzimática em duas etapas.
Em primeiro lugar, a enzima durrinase, endógena nas plantas de sorgo, a hidrolisa em glicose e p-hidroxi- ( S ) -mandelonitrila. Então, este último rapidamente se torna livre de HCN e p-hidroxibenzaldeído.
O HCN é responsável pela resistência das plantas de sorgo a pragas e patógenos.
Isso é explicado pelo fato de a durrina e a enzima durrinase terem locais diferentes nessas plantas e entrarem em contato apenas quando os tecidos são feridos ou destruídos, liberando HCN e protegendo a planta contra infecções que podem penetrar na parte lesada. .
Além disso, algumas bactérias patogênicas humanas como Pseudomonas aeruginosa e P. gingivalis a produzem durante sua atividade metabólica.
Usos
Na preparação de outros compostos químicos e polímeros
O uso que envolve a maior parte do HCN produzido no nível industrial é a preparação de intermediários para a síntese orgânica.
Ele é utilizado na síntese de adiponitrilo NC- (CH 2 ) 4 ? CN, o qual é utilizado para preparar o nylon ou de nylon, uma poliamida. É também serve para preparar acrilonitrilo ou cianoetileno CH 2 = CH-CN, utilizado para preparar fibras acrílicas e plásticos.
Seu cianeto de sódio derivado NaCN é utilizado para a recuperação de ouro na mineração deste metal.
Outro de seus derivados, o cloreto de cianogênio ClCN, serve para fórmulas de pesticidas.
O HCN é utilizado para a preparação de agentes quelantes, como o EDTA (etileno-diamino-tetra-acetato).
É usado para a fabricação de ferrocianetos e alguns produtos farmacêuticos.
Vários usos
O gás HCN tem sido usado como inseticida, fungicida e desinfetante na fumigação de navios e edifícios. Também para fumigar móveis, a fim de restaurá-los.
O HCN tem sido utilizado em polimento de metais, eletrodeposição de metais, processos fotográficos e processos metalúrgicos.
Devido à sua toxicidade muito alta, foi designado como agente de guerra química.
Na agricultura
Tem sido usado como herbicida e pesticida em pomares. Foi usado para controlar escamas e outros patógenos de árvores cítricas, mas algumas dessas pragas se tornaram resistentes à HCN.
Também tem sido usado para fumigar silos de grãos. O gás HCN preparado no local tem sido utilizado na fumigação de grãos de trigo para preservá-los de pragas, como insetos, fungos e roedores. Para esse uso, é essencial que as sementes a serem fumigadas tolerem o agente pesticida.
Testes foram realizados fumigando sementes de trigo com HCN e verificou-se que isso não afeta negativamente o potencial de germinação destes, pelo contrário, parece favorecê-lo.
No entanto, altas doses de HCN podem reduzir significativamente o comprimento das pequenas folhas que brotam da semente.
Por outro lado, devido ao fato de ser um nematicida potente e que algumas plantas de sorgo o possuem em seus tecidos, o potencial das plantas de sorgo a serem usadas como adubo verde biocida está sendo investigado.
Seu uso serviria para melhorar o solo, suprimir ervas daninhas e controlar doenças e danos causados por nematóides fitoparasitários.
Riscos
Para os seres humanos, o HCN é um veneno letal em todas as vias: inalação, ingestão e contato.
A inalação pode ser letal. Estima-se que cerca de 60-70% da população possa detectar o cheiro de amêndoas amargas do HCN quando está no ar a uma concentração de 1-5 ppm.
Mas há 20% da população que não pode detectá-lo, mesmo em concentrações letais, porque eles são geneticamente incapazes de fazê-lo.
Ingerido é um veneno de ação aguda e imediata.
Se suas soluções entrarem em contato com a pele, o cianeto associado pode ser letal.
O HCN está presente na fumaça do cigarro e é gerado quando se queima plásticos que contêm nitrogênio.
Mecanismo de ação letal dentro do organismo
É um asfixiante químico e é rapidamente tóxico, muitas vezes levando à morte. Ao entrar no corpo, ele se liga às metaloenzimas (enzimas que contêm um íon metálico) que as inativam. É um agente tóxico para vários órgãos do corpo humano
Seu principal efeito tóxico é a inibição da respiração celular, pois desativa uma enzima que influencia a fosforilação nas mitocôndrias, organelas que interferem, entre outras coisas, na função respiratória das células.
Risco de fumaça de cigarro
HCN está presente na fumaça do cigarro.
Embora muitas pessoas conheçam o efeito do envenenamento por HCN, poucas pessoas percebem que estão expostas ao seu efeito prejudicial pela fumaça do cigarro.
O HCN é uma das causas da inibição de várias enzimas respiratórias celulares. A quantidade de HCN presente na fumaça do cigarro tem um efeito prejudicial, particularmente no sistema nervoso.
Foram relatados níveis de HCN na fumaça do cigarro entre 10 e 400 μg por cigarro para fumaça inalada diretamente e 0,006 a 0,27 μg / cigarro para inalação secundária (fumante passivo). O HCN produz efeitos tóxicos a partir de 40 μM.
Quando inalado, entra rapidamente na corrente sanguínea, onde é liberado no plasma ou se liga à hemoglobina. Uma pequena parte é convertida em tiocianato e é excretada na urina.
Riscos de aquecimento do HCN
A exposição prolongada ao HCN líquido em recipientes fechados pode causar ruptura violenta e inesperada destes. Pode polimerizar explosivamente a 50-60 ° C na presença de traços de álcalis e na ausência de inibidores.
Presença de HCN na fumaça do fogo
O HCN é liberado durante a combustão de polímeros contendo nitrogênio, como lã, seda, poliacrilonitrila e nylon, entre outros. Esses materiais estão presentes em nossas casas e na maioria dos locais de atividade humana.
Por esse motivo, durante incêndios, o HCN pode ser potencialmente a causa da morte por inalação.
Poluente atmosférico
HCN é um contaminante da troposfera. É resistente à fotólise e, nas condições ambientais da atmosfera, não sofre hidrólise.
Os radicais hidroxila produzidos OH fotoquimicamente podem reagir com o HCN, mas a reação é muito lenta, portanto a meia-vida do HCN na atmosfera é de 2 anos.
Quando a biomassa é queimada, principalmente a turfa, o HCN é liberado na atmosfera e também durante as atividades industriais. No entanto, a combustão de turfa é 5 a 10 vezes mais poluente do que a queima de outros tipos de biomassa.
Alguns pesquisadores descobriram que altas temperaturas e secas causadas pelo fenômeno El Niño em certas áreas do planeta exacerbam incêndios sazonais em áreas com alto conteúdo de matéria vegetal decomposta.
Isso leva à queima intensa de biomassa nas estações secas.
Esses eventos são a fonte de altas concentrações de HCN na troposfera, que são eventualmente transportadas para a baixa estratosfera, permanecendo por muito tempo.
Referências
- Cotton, F. Albert e Wilkinson, Geoffrey. (1980). Química Inorgânica Avançada. Quarta Edição John Wiley & Sons.
- Biblioteca Nacional de Medicina dos EUA. (2019). Cianeto de hidrogênio Recuperado de pubchem.ncbi.nlm.nih.gov.
- Gidlow, D. (2017). Atualização de cianeto de hidrogênio. Medicina do Trabalho 2017; 67: 662-663. Recuperado de ncbi.nlm.nih.gov.
- Enciclopédia Científica de Van Nostrand. (2005). Cianeto de hidrogênio 9 th Recuperado de onlinelibrary.wiley.com.
- Ren, Y.-L. et al. (1996). Efeito do cianeto de hidrogênio e do sulfeto de carbonila na germinação e no vigor da pluma do trigo. Pesticida Sci. 1996, 47, 1-5. Recuperado de onlinelibrary.wiley.com.
- De Nicola, GR et al. (2011). Um método analítico simples para avaliação do conteúdo de dhurrin em plantas cianogênicas para sua utilização em forragens e biofumigação. J. Agric. Food Chem.2011, 59, 8065-8069. Recuperado de pubs.acs.org.
- Sheese, PE et al. (2017). Um aprimoramento global de cianeto de hidrogênio na estratosfera inferior ao longo de 2016. Geophys. Res. Lett., 44, 5791-5797. Recuperado de agupubs.onlinelibrary.wiley.com.
- Surleva, AR e Drochioiu, G. (2013). Visualizando o risco de fumar: uma simples determinação espectrofotométrica de cianeto de hidrogênio na fumaça e nos filtros de cigarro. J. Chem. Educ. 2013, 90, 1654-1657. Recuperado de pubs.acs.org.
- Alarie, Y. et al. (1990). Papel do cianeto de hidrogênio em mortes humanas em incêndio. Em Fogo e Polímeros. Capítulo 3. Série do Simpósio ACS. Recuperado de pubs.acs.org.