O Google Chrome é um dos navegadores mais populares e amplamente utilizados em todo o mundo. Com uma interface simples e intuitiva, o Chrome oferece uma série de recursos e propriedades que o tornam uma escolha popular entre os usuários. Neste artigo, exploraremos algumas das principais propriedades, recursos e usos do Google Chrome, destacando sua flexibilidade, segurança e desempenho.
Recursos do Google Chrome: descubra todas as funcionalidades essenciais deste navegador popular.
O Google Chrome é um dos navegadores mais populares do mundo, conhecido por sua rapidez, simplicidade e segurança. Com uma interface limpa e intuitiva, o Chrome oferece uma série de recursos que tornam a navegação na internet mais eficiente e prática.
Uma das principais propriedades do Chrome é a sua capacidade de sincronização entre dispositivos. Com uma conta do Google, você pode acessar seus favoritos, histórico de navegação e senhas em qualquer dispositivo em que esteja logado. Isso garante uma experiência contínua, independentemente do aparelho que esteja utilizando.
Além disso, o Chrome conta com uma ampla variedade de extensões disponíveis na Chrome Web Store. Estas extensões permitem personalizar o navegador de acordo com suas necessidades, adicionando funcionalidades extras como bloqueadores de anúncios, tradutores automáticos e gerenciadores de senhas.
Outro recurso interessante do Chrome é o modo de navegação anônima, que permite explorar a internet sem que suas atividades sejam registradas no histórico de navegação. Isso é útil para manter a privacidade ao realizar pesquisas sensíveis ou acessar conteúdos que não deseja que fiquem registrados.
Em resumo, o Google Chrome é um navegador poderoso e versátil, que oferece uma série de recursos essenciais para uma experiência de navegação completa. Com a sua velocidade, segurança e praticidade, o Chrome se tornou a escolha preferida de milhões de usuários em todo o mundo.
Principais características do Google Chrome: o que torna esse navegador tão popular.
O Google Chrome é um dos navegadores mais populares da atualidade, conquistando milhões de usuários em todo o mundo. Mas o que torna esse navegador tão especial? Vamos conhecer algumas de suas principais características.
Uma das propriedades mais marcantes do Google Chrome é a sua velocidade. Ele é conhecido por ser um dos navegadores mais rápidos do mercado, permitindo uma navegação fluida e sem travamentos.
Além disso, o Chrome possui uma interface limpa e intuitiva, facilitando a experiência do usuário. Suas guias podem ser organizadas de forma simples e prática, tornando a navegação mais eficiente.
Outro recurso interessante do Google Chrome é a sincronização de dados. Com uma conta do Google, é possível acessar seus favoritos, histórico de navegação e senhas em qualquer dispositivo, garantindo uma experiência unificada.
O Chrome também conta com uma ampla variedade de extensões disponíveis na Chrome Web Store, que permitem personalizar o navegador de acordo com as necessidades de cada usuário. Desde bloqueadores de anúncios até ferramentas de produtividade, as possibilidades são praticamente infinitas.
Em resumo, o Google Chrome se destaca pela sua rapidez, interface amigável, sincronização de dados e extensões variadas. Essas características fazem dele uma escolha popular entre os usuários que buscam uma experiência de navegação eficiente e personalizável.
Entenda a função do Chrome e como ele pode otimizar sua navegação na internet.
O Chrome é um navegador web desenvolvido pela Google e lançado em 2008. Com uma interface simples e intuitiva, ele se tornou um dos navegadores mais populares do mundo, sendo utilizado por milhões de pessoas em todo o planeta.
Uma das principais funções do Chrome é permitir que os usuários acessem e naveguem na internet de forma rápida e segura. Com recursos como a barra de endereços inteligente, os favoritos sincronizados e a navegação privativa, o Chrome oferece uma experiência completa para quem busca praticidade e eficiência.
Além disso, o Chrome conta com uma ampla gama de extensões e aplicativos disponíveis na Chrome Web Store, que permitem personalizar e expandir as funcionalidades do navegador de acordo com as necessidades de cada usuário. Com extensões como adblockers, tradutores e gerenciadores de senhas, o Chrome se torna uma ferramenta versátil e adaptável a diferentes perfis de usuários.
Em termos de desempenho, o Chrome é conhecido por sua velocidade e eficiência na renderização de páginas web. Com um motor de renderização poderoso e otimizado, o navegador garante uma experiência de navegação fluida e sem travamentos, mesmo em sites mais pesados.
Portanto, se você busca otimizar sua navegação na internet, o Chrome é uma excelente opção. Com sua interface amigável, recursos avançados e velocidade de carregamento, ele pode tornar sua experiência online mais produtiva e agradável. Experimente o Chrome e descubra como ele pode facilitar sua vida na web!
Aprenda a acessar as configurações do Google Chrome de maneira simples e rápida.
O Google Chrome é um dos navegadores mais populares e utilizados em todo o mundo, conhecido por sua rapidez, segurança e facilidade de uso. Uma das vantagens do Chrome é a possibilidade de personalizar suas configurações de acordo com as preferências de cada usuário. Neste artigo, vamos ensinar como acessar as configurações do Google Chrome de maneira simples e rápida.
Para acessar as configurações do Google Chrome, basta seguir alguns passos simples. Primeiramente, abra o navegador e clique no ícone de três pontos localizado no canto superior direito da tela. Em seguida, selecione a opção “Configurações” no menu suspenso que aparece.
Uma vez dentro das configurações do Chrome, você terá acesso a diversas opções para personalizar o navegador de acordo com suas necessidades. Você poderá alterar configurações relacionadas à privacidade, segurança, aparência e muito mais. Além disso, é possível acessar configurações avançadas para um controle ainda maior sobre o navegador.
É importante lembrar que as configurações do Google Chrome podem variar de acordo com a versão do navegador que você está utilizando. Por isso, é sempre bom manter seu navegador atualizado para ter acesso às últimas funcionalidades e melhorias.
Em resumo, aprender a acessar as configurações do Google Chrome é uma tarefa simples e rápida que permite personalizar o navegador de acordo com suas preferências. Experimente explorar as configurações do Chrome e descubra todas as possibilidades que o navegador oferece.
Chrome: propriedades, recursos e usos
O crómio (Cr) é um elemento metálico do Grupo 6 (VIB) da tabela periódica. Toneladas deste metal são produzidas anualmente extraindo o minério de ferro ou cromito de magnésio (FeCr 2 O 4 , MgCr 2 O 4 ), que são reduzidos com carbono para obter o metal. É muito reativo, e somente em condições muito redutoras é na sua forma pura.
Seu nome deriva da palavra grega ‘chroma’, que significa cor. Ele recebeu esse nome devido às cores múltiplas e intensas exibidas pelos compostos de cromo, inorgânicos ou orgânicos; de soluções sólidas ou pretas a amarelo, laranja, verde, violeta, azul e vermelho.
No entanto, a cor do cromo metálico e seus carbonetos são prateados acinzentados. Esse recurso é usado na técnica de cromagem para dar brilho a muitas estruturas em prata (como as vistas no crocodilo na imagem acima). Assim, “banhando com cromo” as peças recebem brilho e uma grande resistência à corrosão.
O cromo em solução reage rapidamente com o oxigênio do ar para formar óxidos. Dependendo do pH e das condições oxidativas do meio, ele pode adquirir diferentes números de oxidação, sendo (III) (Cr 3+ ) o mais estável de todos. Consequentemente, o óxido verde de cromo (III) (Cr 2 O 3 ) é o mais estável de seus óxidos.
Esses óxidos podem interagir com outros metais no ambiente, causando, por exemplo, o pigmento de chumbo vermelho da Sibéria (PbCrO 4 ). Este pigmento é amarelo-laranja ou vermelho (de acordo com sua alcalinidade), e dele o cientista francês Louis Nicolas Vauquelin isolou o cobre metálico, razão pela qual é premiado como seu descobridor.
Seus minerais e óxidos, além de uma pequena porção de cobre metálico, fazem com que esse elemento ocupe o número 22 dos mais abundantes na crosta terrestre.
A química do cromo é muito diversa porque pode formar ligações com quase toda a tabela periódica inteira. Cada um de seus compostos exibe cores que dependem do número de oxidação, bem como das espécies que interagem com ele. Também forma ligações com carbono, intervindo em um grande número de compostos organometálicos.
[Sumário]
Características e propriedades
O cromo é um metal prateado em sua forma pura, com um número atômico de 24 e um peso molecular de aproximadamente 52 g / mol ( 52 Cr, seu isótopo mais estável).
Dadas suas fortes ligações metálicas, possui altos pontos de fusão (1907 ° C) e ebulição (2671 ° C). Além disso, sua estrutura cristalina o torna um metal muito denso (7,19 g / mL).
Não reage com a água para formar hidróxidos , mas com ácidos. Oxida com o oxigênio no ar, geralmente produzindo óxido crômico, que é um pigmento verde amplamente utilizado.
Essas camadas de óxido criam o que é conhecido como passivação , protegendo o metal da subsequente corrosão, uma vez que o oxigênio não pode penetrar no seio do metal.
Sua configuração eletrônica é [Ar] 4s 1 3d 5 , com todos os elétrons ausentes e, portanto, exibe propriedades paramagnéticas. No entanto, o acasalamento dos spins eletrônicos pode ocorrer se o metal for submetido a baixas temperaturas, adquirindo outras propriedades, como o antiferromagnetismo.
Estrutura química do cromo
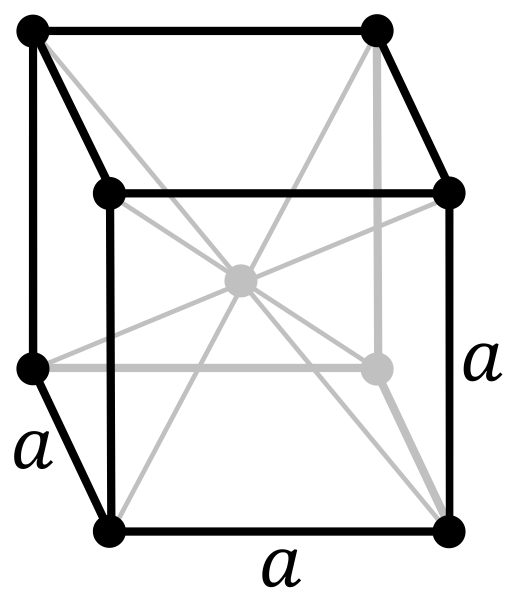
Qual é a estrutura do metal cromado? Em sua forma pura, o cromo adota uma estrutura cristalina cúbica centrada no corpo (cc ou cco). Isso significa que o átomo de cromo está localizado no centro de um cubo, cujas bordas são ocupadas por outros cromos (como na imagem acima).
Essa estrutura é responsável pelo cromo que possui altos pontos de fusão e ebulição, além de alta dureza. Os átomos de cobre se sobrepõem aos seus orbitais syd para formar bandas condutoras de acordo com a teoria das bandas.
Assim, ambas as bandas estão meio cheias. Porque Porque sua configuração eletrônica é [Ar] 4s 1 3d 5 e como o orbital pode abrigar dois elétrons, e os orbitais d dez. Então, apenas metade das bandas formadas por suas sobreposições são ocupadas por elétrons.
Com essas duas perspectivas – a estrutura cristalina e a ligação metálica – muitas das propriedades físicas desse metal podem ser explicadas na teoria. No entanto, nem explica por que o cromo pode ter vários estados ou números de oxidação.
Isso exigiria uma compreensão profunda da estabilidade do átomo em relação aos spins eletrônicos.
Número de oxidação
Como a configuração eletrônica do cromo é [Ar] 4s 1 3d 5, ela pode ganhar até um ou dois elétrons (Cr 1– e Cr 2– ) ou perdê-los para adquirir números de oxidação diferentes.
Assim, se o cromo perder um elétron, ele permanecerá como [Ar] 4s 0 3d 5 ; se você perder três, [Ar] 4s 0 3d 3 ; e se ele perder todos eles, [Ar], ou o que é o mesmo, seria isoeletrônico para o argônio.
O cromo não perde ou ganha elétrons por capricho: deve haver uma espécie que os doa ou os aceita para passar de um número de oxidação para outro.
O cromo tem os seguintes números de oxidação: -2, -1, 0, +1, +2, +3, +4, +5 e +6. Deles, o +3, Cr3 + , é o mais estável e, portanto, predominante de todos; seguido por +6, Cr 6+ .
Cr (-2, -1 e 0)
É muito improvável que o cromo ganhe elétrons, porque é um metal e, portanto, sua natureza é doá-los. No entanto, pode ser coordenado com ligantes, isto é, moléculas que interagem com o centro do metal através de uma ligação dativa.
Um dos mais conhecidos é o monóxido de carbono (CO), que forma o composto hexacarbonil de cromo.
Esse composto possui a fórmula molecular Cr (CO) 6 e, como os ligantes são neutros e não fornecem carga, o Cr possui um número de oxidação igual a 0.
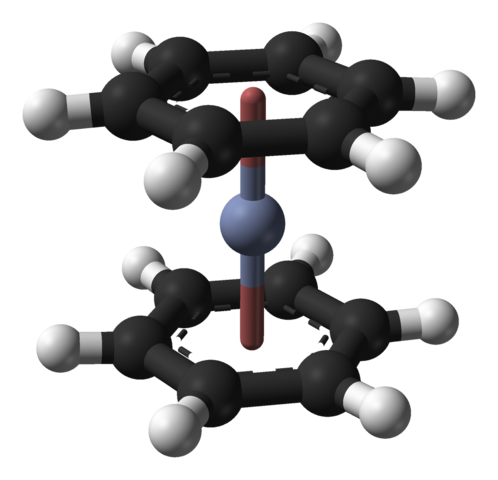
Isso também pode ser observado em outros compostos organometálicos, como o bis (benzeno) cromo. Neste último, o cromo é cercado por dois anéis de benzeno em uma estrutura molecular do tipo sanduíche:
Desses dois compostos organometálicos, muitos outros de Cr (0) podem surgir.
Foram encontrados sais onde eles interagem com cátions de sódio, o que implica que o Cr deve ter um número de oxidação negativo para atrair cargas positivas: Cr (-2), Na 2 [Cr (CO) 5 ] e Cr (-1), Na 2 [Cr 2 (CO) 10 ].
Cr (I) e Cr (II)
Cr (I) ou Cr1 + é produzido pela oxidação dos compostos organometálicos descritos acima. Isto é conseguido por ligandos de oxidação tal como CN ou NO, formando, por exemplo, o composto K 3 [Cr (CN) 5 NO].
Aqui, o fato de ter três cátions K + implica que o complexo de cromo tem três cargas negativas; também o ligante CN – fornece cinco cargas negativas, de modo que entre Cr e NO duas cargas positivas devem ser adicionadas (-5 + 2 = -3).
Se o NO é neutro, então é Cr (II), mas se tiver uma carga positiva (NO + ), é nesse caso Cr (I).
Além disso, os compostos de Cr (II), são mais abundantes, sendo entre eles o seguinte: crómio (II), cloreto de (CrCl 2 ), acetato de crómio (Cr 2 (O 2 CCH 3 ) 4 ), óxido de crómio ( II) (CrO), sulfeto de cromo (II) (CrS) e outros.
Cr (III)
De todos, é o que apresenta maior estabilidade, pois é de fato o produto de muitas reações oxidativas dos íons cromatos. Talvez sua estabilidade se deva à sua configuração eletrônica d 3 , na qual três elétrons ocupam três orbitais d de menor energia em comparação com os outros dois mais energéticos (orbitais d).
O composto mais representativo desse número de oxidação é o óxido de cromo (III) (Cr 2 O 3 ). Dependendo dos ligantes que coordenam com ele, o complexo exibirá uma cor ou outra. Exemplos destes compostos são: [CrCl 2 (H 2 O) 4 ] Cl, Cr (OH) 3 , o CRF 3 , [Cr (H 2 O) 6 ] 3+ , etc.
Embora a fórmula química não a mostre à primeira vista, o cromo geralmente possui uma esfera de coordenação octaédrica em seus complexos; isto é, está localizado no centro de um octaedro onde seus vértices posicionam os ligantes (seis no total).
Cr (IV) e Cr (V)
Os compostos nos quais o Cr5 + participa são muito poucos, devido à instabilidade eletrônica do referido átomo, além de oxidar facilmente o Cr6+ , muito mais estável, pois é isoeletrônico em relação ao gás nobre do argônio.
No entanto, os compostos Cr (V) podem ser sintetizados sob certas condições, como alta pressão. Da mesma forma, eles tendem a se decompor a temperaturas moderadas, o que impossibilita suas possíveis aplicações porque não possuem resistência térmica. Alguns deles são: CrF 5 e K 3 [Cr (O 2 ) 4 ] (O 2 2- é o ânion peróxido).
Por outro lado, o Cr 4+ é relativamente mais estável, sendo capaz de sintetizar seus compostos halogenados: CrF 4 , CrCl 4 e CrBr 4 . No entanto, eles também são suscetíveis à decomposição por reações redox para produzir átomos de cromo com melhores números de oxidação (como +3 ou +6).
Cr (VI): o par cromato-dicromato
2 [CrO 4 ] 2- + 2H + (Amarelo) => [Cr 2 O 7 ] 2- + H 2 O (Laranja)
A equação acima corresponde à dimerização ácida de dois íons cromato para produzir dicromato. A variação do pH causa uma mudança nas interações em torno do centro metálico do Cr 6+ , também sendo evidente na cor da solução (de amarelo para laranja ou vice-versa). O dicromato consiste em uma ponte O 3 Cr-O-CrO 3 .
Os compostos Cr (VI) têm as características de serem prejudiciais e até carcinogênicos para o corpo humano e os animais.
Como Estudos sustentam que os íons CrO 4 2 cruzam as membranas celulares pela ação das proteínas de transporte de sulfato (ambos os íons têm tamanhos similares).
Os agentes redutores nas células reduzem o Cr (VI) a Cr (III), que se acumula por coordenar irreversivelmente em locais específicos de macromoléculas (como a do DNA ).
Contaminada a célula por excesso de cromo, ela não pode sair devido à falta de mecanismo que a transporta de volta através das membranas.
Usos do cromo
Como corante ou pigmentos
O Chrome tem uma ampla variedade de aplicações, desde corantes para diferentes tipos de tecidos, até protetores que embelezam peças de metal no que é conhecido como cromagem, que pode ser feito com metal puro ou com compostos Cr (III) ou Cr (VI).
O fluoreto crômico (CrF 3 ), por exemplo, é usado como corante para panos de lã; sulfato crômico (Cr 2 (SO 4 ) 3 ), destina-se à coloração de esmaltes, cerâmicas, tintas, tintas, vernizes e também serve para cromatar metais; e o óxido crômico (Cr 2 O 3 ) também encontra uso onde é necessária sua atraente cor verde.
Portanto, qualquer mineral de cromo com cores intensas pode ser destinado a tingir uma estrutura, mas depois disso surge o fato de esses compostos serem perigosos ou não para o meio ambiente ou para a saúde dos indivíduos.
De fato, suas propriedades venenosas são usadas para conservar madeira e outras superfícies de ataque de insetos.
Em cromagem ou metalurgia
Além disso, pequenas quantidades de cromo são adicionadas ao aço para fortalecê-lo contra a oxidação e melhorar seu brilho. Isso ocorre porque é capaz de formar carbonetos acinzentados (Cr 3 C 2 ) muito resistentes quando se trata de reagir com o oxigênio no ar.
Como o cromo pode ser polido até obter superfícies brilhantes, os cromados têm desenhos e cores prateados como uma alternativa mais barata para esses fins.
Nutritivo
Alguns discutem se o cromo pode ser considerado um elemento essencial, ou seja, indispensável na dieta diária. Está presente em alguns alimentos em concentrações muito pequenas, como folhas verdes e tomates.
Existem também suplementos de proteína que regulam a atividade da insulina e promovem o crescimento muscular, como é o caso do polinicotinato de cromo.
Onde está?
O cromo é encontrado em uma grande variedade de minerais e pedras preciosas, como rubis e esmeraldas. O principal mineral do qual o cromo é extraído é o cromito (MCr 2 O 4 ), onde M pode ser qualquer outro metal ao qual o óxido de cromo esteja associado. Essas minas abundam na África do Sul, Índia, Turquia, Finlândia, Brasil e outros países.
Cada fonte possui uma ou mais variantes de cromita. Desse modo, para cada M (Fe, Mg, Mn, Zn, etc.), um mineral de cromo diferente surge.
Para extrair o metal, é necessário reduzir o mineral, ou seja, para fazer o centro do metal cromo ganhar elétrons pela ação de um agente redutor. Isso é feito com carbono ou alumínio:
FeCr 2 O 4 + 4C => Fe + 2Cr + 4CO
Além disso, é encontrada cromita (PbCrO 4 ).
Geralmente, em qualquer mineral em que o íon Cr 3+ possa substituir o Al 3+ , ambos com raios iônicos ligeiramente semelhantes, constitui uma impureza que resulta em outra fonte natural desse metal incrível, mas prejudicial.
Referências
- Tenenbaum E. Chromium . Retirado de: chemistry.pomona.edu
- Wikipedia (2018). Crómio Retirado de: en.wikipedia.org
- Anne Marie Helmenstine, Ph.D. (6 de abril de 2018). Qual é a diferença entre Chrome e Chromium? Retirado de: thoughtco.com
- NV Mandich. (1995). Química do cromo. [PDF]. Retirado de: citeseerx.ist.psu.edu
- Química LibreTexts. Química do cromo. Retirado de: chem.libretexts.org
- Saul 1. Shupack. (1991). A química do cromo e alguns problemas analíticos resultantes. Revisado em: ncbi.nlm.nih.gov
- Advameg, Inc. (2018). Crómio Retirado de: chemistryexplained.com