Os cicloalcenos são hidrocarbonetos cíclicos insaturados que apresentam uma ligação dupla em sua estrutura. Esses compostos possuem propriedades e características únicas que os diferenciam dos alcenos e alcanos, como maior reatividade e instabilidade devido à tensão angular presente na molécula. Além disso, a nomenclatura dos cicloalcenos segue as mesmas regras utilizadas para os alcenos, porém levando em consideração a presença do anel na estrutura. Neste contexto, é importante compreender a estrutura química, as propriedades e a nomenclatura dos cicloalcenos para melhor compreender seu comportamento e aplicações na química orgânica.
Nomenclatura dos cicloalcanos: como identificar corretamente esses compostos cíclicos de hidrocarbonetos.
Os cicloalcanos são compostos cíclicos de hidrocarbonetos que possuem uma estrutura de anel fechado. Para identificar corretamente esses compostos, é importante seguir as regras de nomenclatura da IUPAC.
Para nomear um cicloalcano, primeiro deve-se identificar o número de átomos de carbono no anel. Em seguida, utiliza-se o sufixo “-ano” para indicar que se trata de um hidrocarboneto saturado. Por exemplo, um anel de três átomos de carbono seria chamado de ciclopropano.
Além disso, quando existem grupos substituintes no anel, é necessário numerar os átomos de carbono para indicar a posição desses grupos. Os grupos substituintes são nomeados antes do nome do cicloalcano, e são precedidos por prefixos como “metil”, “etil”, “propil”, etc.
Portanto, ao seguir corretamente essas regras de nomenclatura, é possível identificar de forma precisa os diferentes cicloalcanos e seus grupos substituintes.
Cicloalcenos: Estrutura Química, Propriedades, Nomenclatura
Dicas para nomear corretamente cicloalcenos em compostos orgânicos de maneira simples e eficiente.
Para nomear corretamente cicloalcenos em compostos orgânicos, é importante seguir algumas dicas simples e eficientes. Primeiramente, é preciso identificar a estrutura do cicloalceno em questão, que consiste em um anel fechado de carbonos ligados por ligações duplas. Em seguida, é necessário determinar o número de átomos de carbono no anel, que será utilizado como base para a nomenclatura.
Uma regra importante a ser seguida na nomenclatura de cicloalcenos é utilizar o prefixo “ciclo” seguido do número de átomos de carbono no anel. Por exemplo, um anel de três carbonos seria nomeado como ciclopropano. Além disso, é importante indicar a presença de ligações duplas no anel utilizando os sufixos “eno” ou “adieno”, dependendo do número de ligações duplas presentes.
Outra dica importante é indicar a posição das ligações duplas no anel, caso haja mais de uma. Para isso, são utilizados os prefixos numéricos locantes como “1,2” ou “1,3” antes do sufixo “eno” ou “adieno”. Por exemplo, um cicloaleno com uma ligação dupla entre os carbonos 1 e 2 seria nomeado como 1,2-ciclobuteno.
Qual é o nome oficial do composto orgânico conhecido como ciclopentano?
O nome oficial do composto orgânico conhecido como ciclopentano é ciclopentano. Ciclopentano é um tipo de cicloalceno que possui uma estrutura química caracterizada por um anel de cinco átomos de carbono ligados entre si. Os cicloalcenos são hidrocarbonetos que contêm um anel cíclico de carbono e apresentam insaturações, ou seja, ligações duplas ou triplas entre os átomos de carbono.
Os cicloalcenos possuem propriedades físicas e químicas únicas devido à sua estrutura em anel. Eles são mais reativos do que os alcanos de cadeia aberta devido à tensão do anel, que resulta em uma maior instabilidade. Além disso, os cicloalcenos podem sofrer reações de adição, semelhantes às dos alcenos, devido à presença das ligações duplas no anel.
Em relação à nomenclatura dos cicloalcenos, o nome ciclopentano segue as regras da IUPAC (União Internacional de Química Pura e Aplicada) para nomear compostos orgânicos. No caso do ciclopentano, o prefixo “ciclo” indica que o composto possui um anel cíclico de cinco carbonos, enquanto o sufixo “-ano” indica que todas as ligações entre os carbonos são simples.
Sua nomenclatura oficial segue as regras da IUPAC, sendo um exemplo importante de compostos cíclicos na química orgânica.
Significado dos cicloalcenos: compostos cíclicos insaturados com ligação dupla entre átomos de carbono.
Os cicloalcenos são compostos cíclicos insaturados que possuem uma ligação dupla entre átomos de carbono. Essa característica os torna bastante reativos e úteis em diversas reações químicas. A presença da ligação dupla confere propriedades únicas aos cicloalcenos, influenciando sua estrutura e comportamento químico.
Por conta da sua estrutura cíclica, os cicloalcenos apresentam algumas propriedades físicas e químicas diferentes de seus equivalentes acíclicos. A forma do anel pode influenciar a estabilidade do composto e sua reatividade em determinadas condições. Além disso, a presença da ligação dupla pode possibilitar a realização de reações de adição, cicloadição e rearranjos intramoleculares.
A nomenclatura dos cicloalcenos segue as mesmas regras dos alcenos, sendo necessário indicar a posição da ligação dupla no anel cíclico. Por exemplo, o cicloalceno mais simples, com quatro átomos de carbono no anel, é chamado de ciclo-1,3-buteno. Já um anel com cinco átomos de carbono e uma ligação dupla é conhecido como ciclo-1,3-penteno.
Suas propriedades e nomenclatura são determinadas pela forma do anel e pela posição da ligação dupla, o que influencia diretamente seu comportamento em reações químicas.
Cicloalcenos: Estrutura Química, Propriedades, Nomenclatura
Os cicloalcenos pertencem aos compostos orgânicos binários; isto é, eles são compostos apenas de carbono e hidrogênio. O final “eno” indica que eles possuem uma ligação dupla em sua estrutura, chamada insaturação ou deficiência de hidrogênio (indica que os hidrogênios estão ausentes na fórmula).
Eles fazem parte dos compostos orgânicos insaturados da cadeia linear chamados alcenos ou olefinas, porque têm uma aparência oleosa (oleosa), mas a diferença é que os cicloalcenos têm cadeias fechadas, formando ciclos ou anéis.

Como nos alcenos , a ligação dupla corresponde a um link σ (sigma de alta energia) e a um link π (de menor energia pi). É esse último elo que permite que a reatividade ocorra, devido à sua facilidade em quebrar e formar radicais livres.

Eles têm uma fórmula geral que aparece C n H 2n-2.Nesta fórmula, n indica a quantidade de átomos de carbono que a estrutura possui. O menor cicloalqueno é o ciclopropeno, o que significa que possui apenas 3 átomos de carbono e uma ligação dupla única.

Se você deseja obter uma estrutura com um número de átomos de carbono = 3 aplicando a fórmula C n H n-2, substitua n por 3, obtendo a seguinte fórmula molecular:
C 3 H 2 (3) -2 = C 3 H 6-2 = C 3 H 4 .
Depois, há um ciclo com 3 átomos de carbono e 4 hidrogênios, exatamente como aparece na figura.
Esses compostos químicos são muito úteis no nível industrial por sua facilidade na formação de novas substâncias, como polímeros (devido à presença da ligação dupla) ou na obtenção de cicloalcanos com o mesmo número de átomos de carbono, precursores da formação. de outros compostos.
Estrutura quimica
Os cicloalcenos podem ter em sua estrutura uma ou várias ligações duplas que devem ser separadas por um único elo; Isso é conhecido como estrutura conjugada. Caso contrário, forças repulsivas são criadas entre elas, causando a ruptura da molécula.
Se na estrutura química um cicloalceno tem duas ligações duplas, é dito que é um “dieno”. Se possui três ligações duplas, é um “trieno”. E se houver quatro ligações duplas, fala-se de um “tetraeno” e assim por diante.
As estruturas de energia mais estáveis não têm muitas ligações duplas em seu ciclo, porque a estrutura molecular é distorcida devido à grande quantidade de energia causada pelos elétrons em movimento que estão nela.
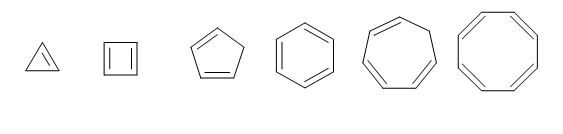
Um dos trienos mais importantes é o ciclohexatrieno, um composto que possui seis átomos de carbono e três ligações duplas. Este composto pertence a um grupo de elementos chamados areia ou aromático. É o caso do naftaleno, fenantreno e antraceno, entre outros.
Nomenclatura
Para nomear os cicloalcenos, as normas de acordo com a União Internacional de Química Pura e Aplicada (IUPAC) devem ser levadas em consideração:
Cicloalceno com uma ligação dupla única e sem substituintes alquil ou radical
– O número de carbonos contados no ciclo é contado.
– A palavra “ciclo” é escrita, seguida pela raiz que corresponde ao número de átomos de carbono (encontrado, et, prop, mas, pent, entre outros), e recebe o final “eno” porque corresponde a um alceno .

Cicloalcenos com duas ou mais ligações duplas e sem substituintes alquil ou radical
A cadeia de carbono é listada de forma que as ligações duplas estejam localizadas entre dois números consecutivos com o menor valor possível.
Os números são escritos separados por vírgulas. Depois que a numeração termina, um script é escrito para separar os números das letras.
A palavra “ciclo “ é então escrita , seguida pela raiz que corresponde ao número de átomos de carbono na estrutura. A letra “a” é escrita e, em seguida, o número de ligações duplas é escrito, usando os prefixos di (dois), tri (três), tetra (quatro), penta (cinco) e assim por diante. Termina com o sufixo “eno”.
O exemplo a seguir mostra duas enumerações: uma entre um círculo vermelho e outra entre um círculo azul.
A numeração do círculo vermelho mostra a forma correta de acordo com as regras da IUPAC, enquanto a que está dentro de um círculo azul não está correta porque a ligação dupla não cai entre números consecutivos de menor valor.
Cicloalcenos com substituintes alquil
Com um substituinte alquil
O ciclo está listado como já mencionado. O radical propil é escrito com a numeração que corresponde a ele e separado por um hífen do nome da cadeia principal:
A numeração começa com o carbono que um dos radicais possui. Isso fornece o menor valor possível, tanto para o radical quanto para a ligação dupla. Os radicais são nomeados em ordem alfabética.

Propriedades físicas
As propriedades físicas dos cicloalcenos dependem do peso molecular, da quantidade de ligações duplas que possui e dos radicais que estão ligados a eles.
O estado físico dos dois primeiros ciclos (C 3 e C 4 ) são gases, até C 10 serem líquidos e a partir de então serem sólidos.
O ponto de ebulição dos cicloalcenos é maior comparado ao dos cicloalcanos com o mesmo número de átomos de carbono. Isso ocorre devido à densidade eletrônica causada pelas ligações π (pi) da ligação dupla, enquanto o ponto de fusão diminui.
A densidade aumenta à medida que o peso molar do composto cíclico aumenta e pode aumentar ainda mais à medida que as ligações duplas aumentam.
Para ciclopenteno, a densidade é de 0,744 g / mL, enquanto para ciclopentadieno, a densidade é de 0,789 g / mL.
O mesmo número de átomos de carbono é encontrado em ambos os compostos; no entanto, o ciclopentadieno possui um peso molar menor devido à ausência de hidrogênio, mas possui duas ligações duplas. Isso torna sua densidade um pouco maior.
Os cicloalcenos são pouco solúveis na água, especialmente porque sua polaridade é muito baixa em comparação com a da água.
Eles são solúveis em compostos orgânicos e, portanto, o princípio de que “similar dissolve semelhante” é cumprido. Isso geralmente significa que substâncias que possuem estrutura e forças intermoleculares semelhantes são mutuamente mais miscíveis do que aquelas que não o são.
Propriedades químicas
Como alcenos de cadeia linear, os cicloalcenos têm reações de adição na ligação dupla porque possuem maior energia e menor comprimento do que uma ligação simples ou sigma (σ).
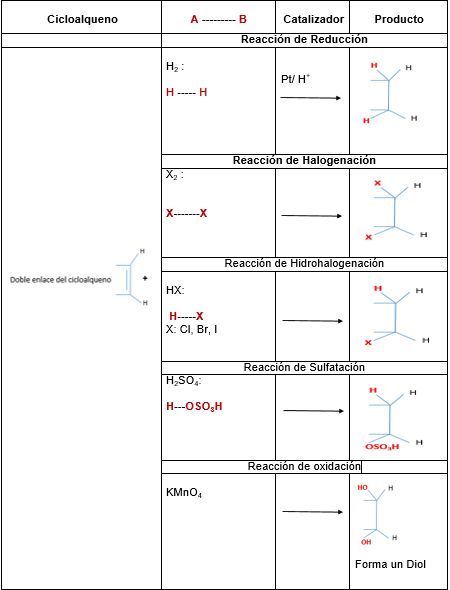
As principais reações dos cicloalcenos são de adição, mas também apresentam reações de oxidação, redução e halogenação de alil.
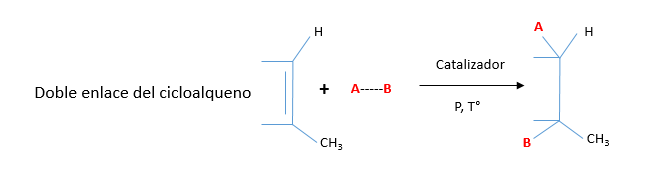
A tabela a seguir ilustra as reações mais importantes dos cicloalcenos:
Se um dos carbonos que possui a ligação dupla é substituído por um radical, o hidrogênio do reagente se liga ao carbono que possui um número maior de átomos de hidrogênio. Isso é chamado de regra de Markovnicov.
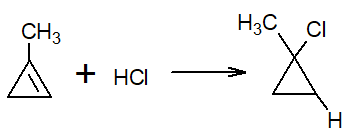
Exemplos
Ciclo-hexeno: C6H10.
Ciclobuteno: C4H6.
Ciclopenteno: C5H8.
1,5-ciclooctadieno: C8H12.
1,3-ciclobutadieno: C4H4.
1,3-ciclopentadieno: C5H6.
1,3,5,7-ciclooctatetraeno: C8H8.
Ciclopropeno
Ciclohepteno
Referências
- Tierney, J, (1988, 12) , regra de Markownikoff: O que ele disse e quando disse? J.Chem.Educ. 65, pp. 1053-1054.
- Hart, H; Craine, L; Hart, D. Organic Chemistry: A Short Course, (Nona edição), México, McGraw-Hill.
- García, A., Aubad, A., Zapata, R., (1985), Para Química 2, Bogotá: Temis
- Pine, S., Hammond, G., Hendrickson, J., Cram, D., (1980), Organic Chemistry (4ª edição), México: McGraw-Hill.
- Morrison, R., Boyd, R., (1998), Organic Chemistry, (5ª edição), Espanha, Addison Wesley Iberoamericana

