- Frações molares são adimensionais, somam 1 e derivam de n = ∑ni.
- Para ir de % (m/m) a X, converta massas em mols e divida por n total.
- Fração molar não é % (m/m): cada uma responde a perguntas diferentes.
- Densidade conecta % (m/m) à molaridade; em gases, X liga Pa e PT.

Quando o assunto é concentração de soluções, muita gente se confunde ao passar de massa para mol e vice-versa. Calcular frações molares a partir de porcentagem em massa é totalmente possível e prático, contanto que você saiba transformar massas em quantidade de matéria e organizar as contas na ordem certa.
Neste guia completo, você vai aprender, passo a passo, a converter % em massa para fração molar, entender por que a soma das frações molares é 1, como passar a fração molar para porcentagem, e ainda ver a relação com molalidade, pressão parcial e outras unidades de concentração. Para fixar de verdade, trago exemplos resolvidos e situações típicas de prova, sempre com explicações claras e checagens rápidas para evitar deslizes comuns.
O que é fração molar e por que ela vai de 0 a 1
A fração molar de um componente i (Xi) é a razão entre o número de mols desse componente (ni) e o número total de mols da mistura (n = ∑ni). Em soluções binárias, costumamos chamar de n1 o soluto e n2 o solvente, de modo que n = n1 + n2. Assim, X1 = n1/n e X2 = n2/n.
Como o denominador (n) é a soma dos mols de todos os componentes, ele sempre é maior ou igual ao numerador. Isso garante que cada Xi fica entre 0 e 1, e, por construção, a soma de todas as frações molares é exatamente 1 (X1 + X2 = 1, numa solução binária). Essa propriedade é ótima para conferir cálculos e detectar erros rapidamente.
Outra consequência útil: por serem razões entre quantidades de matéria, as frações molares são adimensionais e independentes de temperatura. Isso dá a elas uma vantagem prática sobre concentrações que dependem de volume (que, por sua vez, varia com a temperatura), facilitando comparações e balanços de massa.
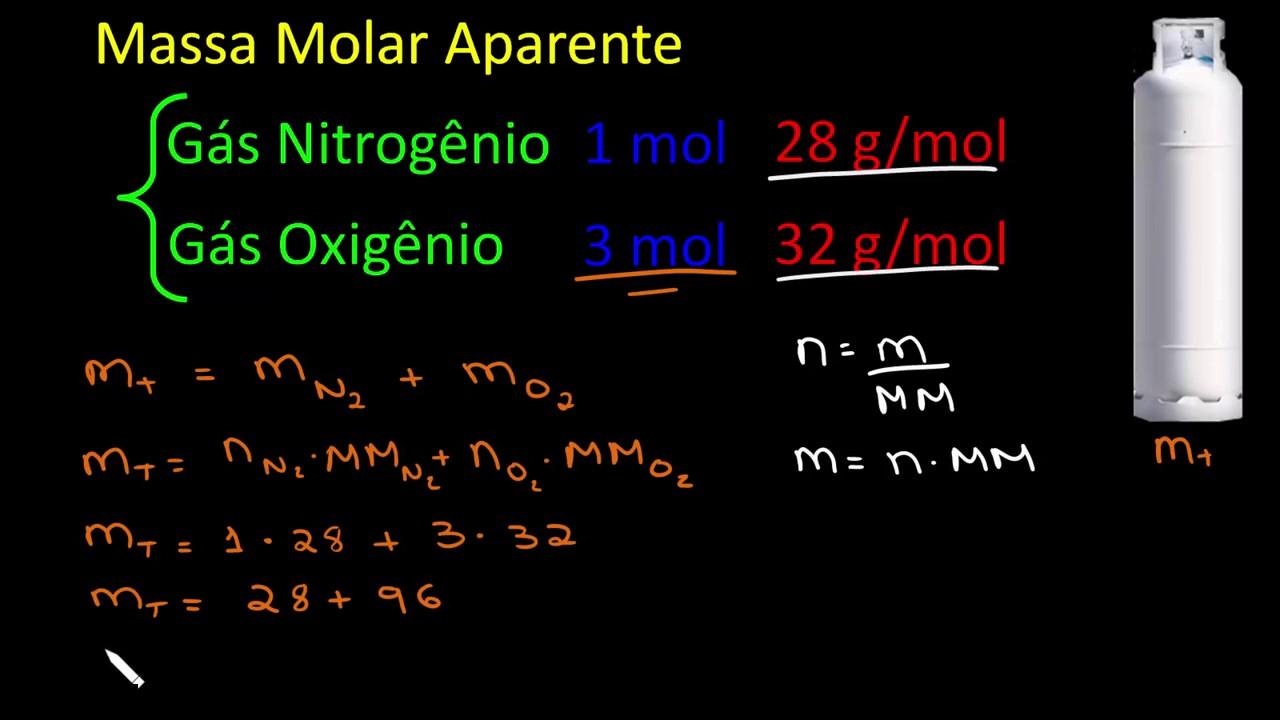
Fração molar do soluto e do solvente: definições, símbolos e atalhos
Para um sistema com soluto (1) e solvente (2), definimos: n1 (mols do soluto), n2 (mols do solvente) e n = n1 + n2. As frações molares são X1 = n1/n e X2 = n2/n. Se X1 é conhecido, X2 = 1 − X1, e vice-versa.
Quando o exercício fornece massas (m1 para o soluto e m2 para o solvente), converta-as para mols: n1 = m1/M1 e n2 = m2/M2, em que M1 e M2 são as massas molares. Esse passo “m → n” é o elo entre porcentagem em massa e fração molar.
Convenções úteis que aparecem com frequência: m1 é a massa do soluto, M1 a massa molar do soluto; m2 a massa do solvente e M2 a massa molar do solvente. Dominar esses símbolos acelera muito a resolução, especialmente ao montar a relação entre título em massa, molalidade e fração molar.
Da porcentagem em massa à fração molar (e o caminho inverso)
Porcentagem em massa indica quantas unidades de massa de um componente há em 100 unidades de massa da mistura. Matematicamente, a fração mássica wi = mi/mtotal, e a percentagem mássica é 100·wi. Exemplo clássico: HCl comercial a 37% (m/m) significa 37 g de HCl em 100 g de solução, logo w(HCl) = 0,37.
Para obter fração molar a partir de % em massa, use uma base conveniente (tipicamente 100 g de solução). Passo a passo:
– Adote 100 g de solução: msoluto = %·100/100 e msolvente = 100 − msoluto.
– Converta massas em mols: n1 = m1/M1 e n2 = m2/M2.
– Some para obter n = n1 + n2.
– Calcule X1 = n1/n e X2 = n2/n. Pronto: converteu % (m/m) em fração molar.
Se quiser voltar de fração molar para porcentagem em massa, proceda ao contrário: escolha uma base em mol (por exemplo, 1 mol de solução ou 100 mol), distribua pelos componentes respeitando as frações, converta cada n em massa usando M, some as massas e compute wi = mi/mtotal. No fim, multiplique por 100 para obter % (m/m).
Converter fração molar em porcentagem: quando multiplicar por 100 faz sentido
Frações molares estão sempre entre 0 e 1. Multiplicar X por 100 fornece a “porcentagem molar” (não confundir com % em massa), útil para comunicar a participação molar de um componente em termos percentuais.
Um detalhe importante: a soma das frações molares é 1, portanto a soma das “porcentagens molares” é 100%. Essa checagem simples evita erros de arredondamento que, somados, podem atrapalhar correções numéricas em provas e relatórios.
Exemplo rápido: em uma mistura com XNaCl = 0,4 e XH2O = 0,6, temos 40% molar de NaCl e 60% molar de água. Lembre que isso não é a mesma coisa que 40% (m/m), pois massa e mol têm escalas diferentes para cada substância.
Relação com fração mássica, título em massa e densidade
A fração mássica wi = mi/mtotal é adimensional, como a fração molar. O título em massa é, na prática, a mesma ideia de w, com ênfase na razão de massas para representar a composição da solução.
Em formulações industriais, usa-se muito % (m/m), e às vezes é necessário converter para concentração molar (mol·dm−3). Para isso, além da massa molar, você precisa da densidade da solução para transformar massa em volume. Exemplo clássico: solução comercial de HCl a 37% (m/m), ρ ≈ 1,18 g·cm−3 (a 20 °C) e M(HCl) = 36,46 g·mol−1. Em 100 g de solução temos 37 g de HCl; o volume correspondente é aproximadamente 84,7 cm3. A quantidade de HCl é 37/36,46 ≈ 1,015 mol, logo a molaridade fica ~ 1,015 mol / 0,0847 L ≈ 12 mol·dm−3. Observe como densidade e massa molar entram no cálculo para sair de % (m/m) para molaridade.
Essa mesma estratégia (adotar uma base de 100 g) permite também converter % (m/m) em fração molar, como mostrado antes. O segredo é sempre passar por n = m/M para, então, dividir pelos mols totais.
Fração molar e molalidade: como se conectam
A molalidade (m) é definida como mols de soluto por quilograma de solvente (m = n1/massa do solvente em kg). Também pode ser escrita como m = m1/(M1·m2(kg)), ressaltando a relação entre massas e massa molar.
Embora fração molar e molalidade sejam diferentes, elas se conversam via n1 e n2. Sabendo m (molalidade) e a massa do solvente, você encontra n1; somando com n2 (m2/M2), obtém n total e calcula as frações molares. Na direção inversa, de X para m, o caminho também passa por n e pelas massas dos componentes.
Pressão parcial de gases e fração molar: uma ligação direta
Essa relação é muito utilizada em problemas de lei de Dalton e em operações industriais que tratam de misturas gasosas. Mais uma vez, a fração molar aparece como “ponte” entre grandezas mensuráveis e composição química.
Exemplos práticos e exercícios resolvidos
Exemplo 1 (frações molares diretas): misture 1 mol de glicose com 99 mol de água. Temos n1 = 1 mol, n2 = 99 mol, n = 100 mol. Logo, Xglicose = 1/100 = 0,01 e Xágua = 99/100 = 0,99. Repare como a soma dá 1 e os valores ficam entre 0 e 1.
Exemplo 2 (de X para título em massa): em solução aquosa, Xglicose = 0,01. Se adotarmos n = 100 mol (porque 0,01 é um centésimo), então n1 = 1 mol (glicose) e n2 = 99 mol (água). Convertendo para massa: mglicose = 1·180 = 180 g; mágua = 99·18 = 1782 g; mtotal = 1962 g. O título em massa (w do soluto) é 180/1962 ≈ 0,0917, ou 9,17% (m/m). Portanto, a alternativa correta para o título aproximado é 9,17%.
Exemplo 3 (NaCl em água, passo a passo): uma solução foi preparada com 250 mL de água destilada (densidade ~1 g·mL−1, logo ~250 g) e 12 g de NaCl. M(NaCl) = 58,44 g·mol−1. nNaCl = 12/58,44 ≈ 0,205 mol; nH2O = 250/18 ≈ 13,89 mol; n ≈ 14,095 mol. A fração molar do sal é XNaCl ≈ 0,205/14,095 ≈ 0,0145. É um valor pequeno, como esperado, porque a quantidade de água em mol é muito maior. (Observação: em muitos materiais didáticos usa-se a aproximação de densidade 1 g·mL−1 para água pura a 20 °C.)
Exemplo 4 (NaOH e água por massas): dados m1(NaOH) = 160 g, m2(H2O) = 216 g, M(NaOH) = 40 g·mol−1 e M(H2O) = 18 g·mol−1. n1 = 160/40 = 4 mol; n2 = 216/18 = 12 mol; n = 16 mol. Portanto, XNaOH = 4/16 = 0,25 e XH2O = 12/16 = 0,75. As frações são coerentes com as quantidades e somam 1.
Exemplo 5 (lactose no leite): concentração C = 45 g·L−1, densidade do leite ≈ 1 g·mL−1, então 1 L ≈ 1000 g de solução. Para esse 1 L: msoluto = 45 g (lactose), msolução = 1000 g, logo msolvente ≈ 955 g. M(lactose, C12H22O11) = 342 g·mol−1, então n1 ≈ 45/342 ≈ 0,13 mol; n2 ≈ 955/18 ≈ 53,05 mol; n ≈ 53,18 mol. A fração molar do soluto é X1 ≈ 0,13/53,18 ≈ 0,0024. Um valor muito baixo, consistente com a diluição típica de solutos em alimentos.
Exemplo 6 (determinando massa do solvente a partir de X e n): em uma solução com n = 10 mol e X1 (soluto) = 0,05, então n1 = 0,05·10 = 0,5 mol. Logo, n2 = 10 − 0,5 = 9,5 mol. Se o solvente for água (M = 18 g·mol−1), m2 = 9,5·18 = 171 g. Esse tipo de cálculo é recorrente quando a pergunta pede massa a partir de dados de fração molar.
Exemplo 7 (recuperando n a partir de X do solvente): se X2 = 0,74 e n2 = 0,74 mol, então X2 = n2/n implica n = 0,74/0,74 = 1 mol. Assim, n1 = 1 − 0,74 = 0,26 mol. Um jeito elegante de usar a propriedade X1 + X2 = 1 e evitar cálculos desnecessários.
Molaridade, % (m/v) e % (v/v): diferenças que evitam confusão
Molaridade (M) é mol de soluto por litro de solução. Já % (m/v) é a massa do soluto (g) por volume de solução (mL) × 100, e % (v/v) é volume de soluto por volume de solução × 100. Essas unidades não são fração molar e cada uma serve para um contexto.
Exemplo de % (m/v): uma solução a 10% (m/v) de NaCl tem 10 g de NaCl em 100 mL de solução. Procedimento correto: dissolva a massa do soluto em um volume parcial de água e só então complete até o volume final desejado (não some 10 g diretamente a 100 mL, pois o volume final muda e a concentração fica errada).
Exemplo de % (v/v): para preparar 1000 mL de solução a 5% (v/v) de etilenoglicol em água, use 50 mL de etilenoglicol e complete com água até 1000 mL. Note que, em misturas de líquidos, volumes não são estritamente aditivos, razão pela qual se recomenda completar até o volume final, e não somar volumes isoladamente.
Para soluções molares de NaCl: M(NaCl) = 58,44 g·mol−1. Uma solução 1,0 M contém 58,44 g de NaCl por 1 L de solução; já 0,1 M exige 5,844 g/L; 0,5 M pede 29,22 g/L; e 2,0 M requer 116,88 g/L. Sempre ajuste o volume final no balão volumétrico após dissolver o soluto para garantir exatidão.
Checklist para converter % (m/m) em fração molar sem tropeços
1) Base de 100 g: com % (m/m), assuma 100 g de solução; isso torna msoluto e msolvente imediatos. Se não houver densidade no enunciado, você não precisa de volume para fração molar.
2) m → n: calcule n1 = m1/M1 e n2 = m2/M2. Esse passo é o coração da conversão, transformando massa em quantidade de matéria.
3) Some e divida: n = n1 + n2 e Xi = ni/n. Faça a checagem X1 + X2 = 1 para validar o resultado final.
4) Quer porcentagem molar? Multiplique cada X por 100. Só não confunda com % (m/m): porcentagem molar é “% em mols”, enquanto % (m/m) é “% em massa”.
Quando usar fração molar, molalidade ou molaridade
Use fração molar quando a proporção relativa dos componentes for o foco, como em balanços de massa, misturas gasosas e análises termodinâmicas (equilíbrios, propriedades coligativas, etc.). A independência de unidade e temperatura é uma mão na roda nesses contextos.
Prefira molalidade quando houver variação de temperatura significativa, já que ela se baseia em massa do solvente, que não muda com temperatura como o volume muda. Molalidade é especialmente útil em propriedades coligativas (ebulição, congelamento, pressão osmótica, etc.).
Use molaridade para rotinas de laboratório com soluções aquosas e titulações, pela praticidade de medir volumes. Para converter % (m/m) em M muitas vezes será necessário conhecer a densidade, exatamente como no exemplo do HCl 37%.
Dicas rápidas, validações e erros comuns
Soma igual a 1: se X1 + X2 ≠ 1, há erro. Refaça n = n1 + n2 e as divisões — essa verificação simples salva pontos em provas.
Não confunda “% molar” com “% (m/m)”: a primeira vem de fração molar × 100; a segunda é massa do componente sobre massa total × 100. Essa troca indevida gera respostas incompatíveis com o enunciado.
Volume não é massa: em % (m/v) e % (v/v), siga o procedimento correto de preparar a solução e completar até o volume final. Evite simplesmente somar volumes ou massas sem considerar o volume final de solução.
Molalidade ≠ molaridade: a primeira usa massa do solvente (kg), a segunda usa volume de solução (L). Em temperaturas diferentes, a molaridade pode variar; já a molalidade permanece estável.
Por fim, lembre do conceito de mol, base de toda a estequiometria: ele conecta a escala de massa ao número de partículas. Quando surgirem massas no enunciado, a pergunta silenciosa sempre é: qual é a massa molar e como passo para mol?
Com a definição nítida de fração molar (Xi = ni/n), o uso consistente das conversões m ↔ n via massa molar, e a leitura atenta do tipo de porcentagem indicada no problema, você consegue converter com segurança entre % (m/m), frações molares e outras unidades. Exercícios como os de glicose/água, NaOH/H2O e lactose solidificam a técnica, enquanto o caso do HCl 37% ilustra a importância da densidade para ligar % (m/m) à molaridade. Para misturas gasosas, a ponte com pressão parcial é direta por Pa/PT = Xa, mostrando como a fração molar permeia diferentes áreas da química de modo elegante e eficiente.
