Enantiômeros são moléculas que possuem a mesma fórmula molecular e estrutura química, mas que se diferem pela disposição espacial dos átomos em relação a um plano de simetria. Essas moléculas são imagens espelhadas não superponíveis, chamadas de formas dextrogiras (D) e levogiras (L). Os enantiômeros apresentam propriedades físicas e químicas semelhantes, com exceção da interação com a luz polarizada, na qual eles se comportam de maneira oposta. Alguns exemplos de enantiômeros incluem a D-glicose e a L-glicose, que são importantes na bioquímica e na indústria farmacêutica.
Enantiômeros: exemplos e definição da quiralidade molecular em compostos orgânicos.
Os enantiômeros são isômeros que possuem a mesma fórmula molecular e grupos funcionais, porém apresentam estruturas espaciais diferentes, sendo imagens espelhadas não sobreponíveis entre si. Essa propriedade é conhecida como quiralidade molecular, que é a capacidade de uma molécula não sobreponível à sua imagem especular. Em outras palavras, os enantiômeros são moléculas que não são superponíveis com suas imagens espelhadas.
Um exemplo clássico de enantiômeros são o L e o D-gliceraldeído, que são compostos de três carbonos com um grupo aldeído e dois grupos hidroxila. Ambos os enantiômeros possuem a mesma fórmula molecular (C₃H₆O₃), no entanto, suas estruturas espaciais são diferentes, tornando-os enantiômeros.
As propriedades físicas e químicas dos enantiômeros são muito semelhantes, no entanto, em sistemas biológicos, eles podem apresentar atividades biológicas diferentes. Isso acontece porque muitos organismos possuem moléculas quiralmente específicas, como enzimas, que reconhecem apenas um dos enantiômeros, levando a diferentes respostas biológicas.
Em resumo, os enantiômeros são isômeros que possuem a mesma fórmula molecular e grupos funcionais, porém apresentam estruturas espaciais diferentes. Essa propriedade é conhecida como quiralidade molecular e é de extrema importância na química orgânica e em muitos processos biológicos.
Identificando enantiômeros: dicas para diferenciar moléculas com quiralidade oposta.
Os enantiômeros são moléculas que possuem a mesma fórmula molecular e estrutura, mas que são não superponíveis na forma de imagem espelhada. Para diferenciar moléculas com quiralidade oposta, é importante observar algumas dicas.
Uma dica importante é verificar a orientação dos grupos funcionais em relação ao átomo de carbono quiral. Os enantiômeros possuem arranjos espaciais diferentes, o que resulta em propriedades ópticas distintas, como a capacidade de desviar a luz polarizada.
Além disso, é fundamental analisar a atividade óptica das moléculas. Os enantiômeros apresentam rotação óptica oposta, ou seja, um enantiômero desvia a luz polarizada para a direita (dextrogiro) e o outro para a esquerda (levogiro).
Outra dica importante é observar a configuração absoluta dos átomos de carbono quiral. Os enantiômeros possuem configurações espaciais diferentes, o que pode ser determinado pela sequência de prioridade dos grupos ligados ao átomo de carbono quiral.
Por fim, é essencial utilizar técnicas de separação, como cromatografia quiral, para diferenciar e isolar os enantiômeros. Essas técnicas são fundamentais para identificar e estudar as propriedades dos enantiômeros em laboratório.
A compreensão e identificação dos enantiômeros são fundamentais para diversas áreas da química, como a farmacologia e a síntese de compostos químicos. Por isso, é importante estar atento às características, propriedades e dicas para diferenciar moléculas com quiralidade oposta.
Principais características da isomeria: entenda as diferenças entre os diferentes tipos de isômeros.
A isomeria é um fenômeno muito comum na química orgânica, onde moléculas com a mesma fórmula molecular podem ter estruturas diferentes. Existem diversos tipos de isômeros, sendo os principais: isômeros constitucionais, isômeros estereoisômeros e isômeros conformacionais.
Os isômeros constitucionais, também conhecidos como isômeros estruturais, possuem diferentes arranjos de átomos em suas estruturas, resultando em propriedades físicas e químicas distintas. Já os isômeros estereoisômeros se diferenciam pela disposição espacial dos átomos, sendo subdivididos em enantiômeros e diastereoisômeros.
Os enantiômeros são isômeros que se diferenciam pela disposição espacial dos átomos em torno de um átomo de carbono assimétrico, também conhecido como carbono quiral. Essas moléculas são imagens especulares não sobreponíveis, ou seja, são não superponíveis e apresentam atividade óptica, podendo desviar o plano da luz polarizada.
As propriedades físicas dos enantiômeros são muito semelhantes, no entanto, suas propriedades químicas podem ser diferentes, o que pode ter implicações importantes em diversas áreas, como na farmacologia. Por exemplo, o fármaco Talidomida possui dois enantiômeros, sendo um deles responsável pelos efeitos terapêuticos desejados e o outro pelos efeitos teratogênicos indesejados.
Em resumo, os enantiômeros são isômeros que se diferenciam pela disposição espacial dos átomos em torno de um carbono quiral, apresentando atividade óptica e propriedades químicas distintas. É importante compreender essas diferenças para garantir a eficácia e segurança de compostos químicos utilizados em diversos setores, como na indústria farmacêutica.
Propriedades físicas e químicas idênticas, apenas a rotação óptica dos enantiômeros difere.
Os enantiômeros são isômeros especiais que possuem a mesma fórmula molecular e a mesma estrutura, mas diferem na disposição tridimensional dos átomos. Isso faz com que os enantiômeros tenham propriedades físicas e químicas idênticas, com exceção da rotação óptica, que é a capacidade de desviar a luz polarizada em direções opostas.
A rotação óptica dos enantiômeros ocorre devido à assimetria que eles apresentam, o que os torna não superponíveis na forma de imagem especular. Um enantiômero pode desviar a luz polarizada para a direita, sendo chamado de dextrógiro (+), ou para a esquerda, sendo chamado de levógiro (-).
Essa propriedade dos enantiômeros é de extrema importância, especialmente em áreas como a farmacologia, onde a atividade biológica de um composto pode variar dependendo do enantiômero presente. Um exemplo clássico é o da talidomida, onde um dos enantiômeros causava malformações fetais, enquanto o outro possuía propriedades terapêuticas.
Em síntese, os enantiômeros são moléculas que possuem propriedades físicas e químicas idênticas, mas que se diferenciam pela rotação óptica. Essa característica é fundamental para a compreensão de diversos processos químicos e biológicos, assim como para o desenvolvimento de novos fármacos e materiais.
Enantiômeros: características, propriedades e exemplos
Os enantiômeros são aqueles pares de compostos orgânicos (e inorgânicos) que consistem em duas imagens espelhadas que não podem ser sobrepostas. Quando ocorre o contrário – por exemplo, no caso de uma bola, um taco de golfe ou um garfo – eles são objetos aquirais.
O termo quiralidade foi cunhado por William Thomson (Lord Kelvin), que definiu que um objeto é quiral se não puder ser sobreposto à sua imagem no espelho. Por exemplo, as mãos são elementos quirais, porque o reflexo da mão esquerda, mesmo se for girado, nunca coincidirá com o original.

Uma maneira de demonstrar o exposto é colocando a mão direita à esquerda, descobrindo que os únicos dedos que se sobrepõem são os do meio. De fato, a palavra quiral deriva da palavra grega cheir , que significa “mão”.
No caso do detentor da imagem superior, se seu reflexo fosse girado, ele se encaixaria perfeitamente sob o original, que se traduz como um objeto aquiral.
Carbono assimétrico
Que forma geométrica um conjunto de átomos deve considerar quiral? A resposta é tetraédrica; isto é, para um composto orgânico, o átomo de carbono deve ter um arranjo tetraédrico ao seu redor. No entanto, embora isso se aplique à maioria dos compostos, nem sempre é o caso.
Para este composto CW hipotético 4 é quiral, todos os substituintes devem ser diferentes. Se não fosse assim, o reflexo do tetraedro poderia se sobrepor após as rotações.
Assim, o composto C (ABCD) é quiral. Quando isso ocorre, o átomo de carbono ligado a quatro substituintes diferentes é conhecido como carbono assimétrico (ou carbono estereogênico). Quando esse carbono “olha” para o espelho, seu reflexo e isso formam o par enantiomérico.
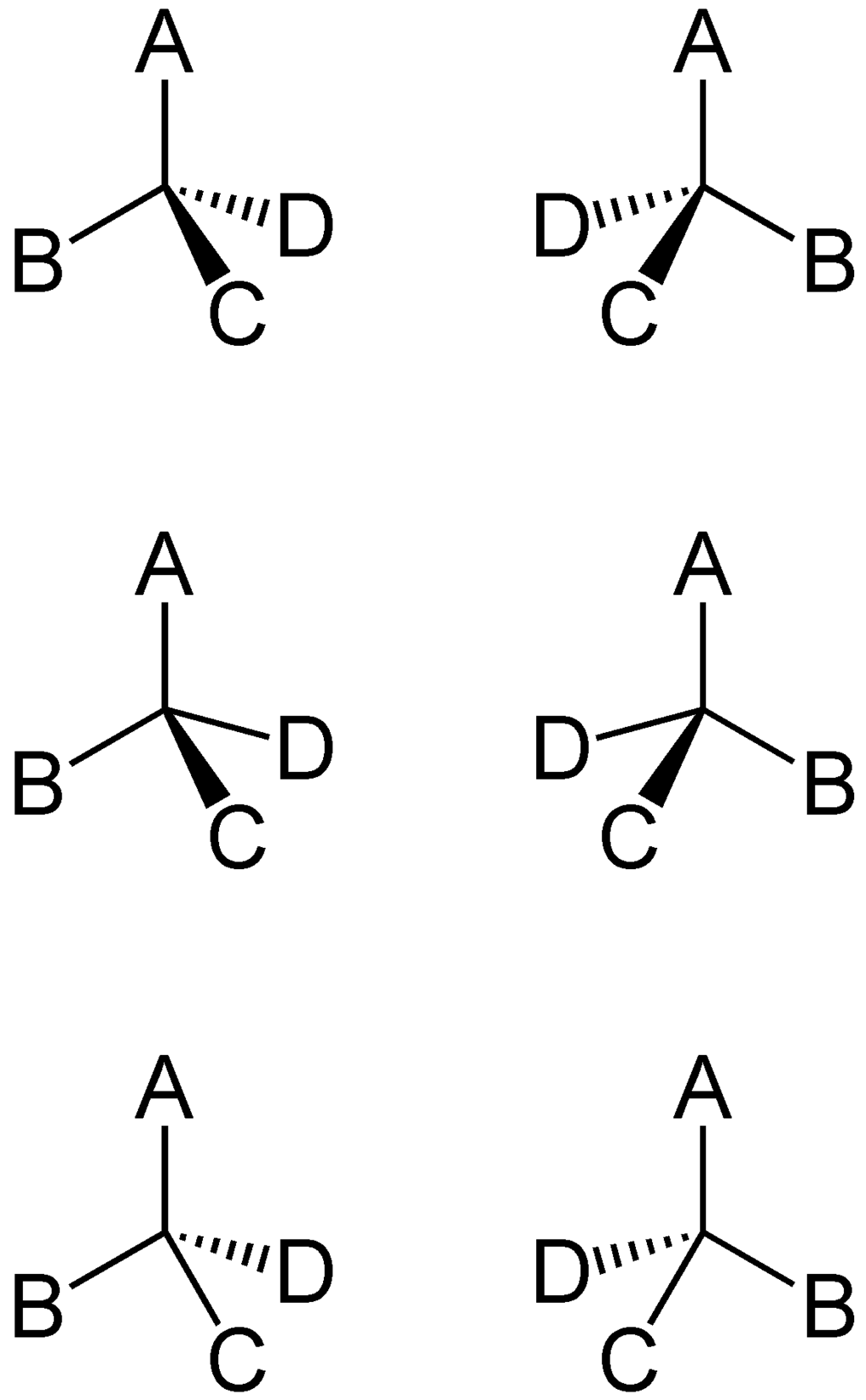
Três pares enantioméricos do composto C (ABCD) são ilustrados na imagem acima. Considerando apenas o primeiro par, seu reflexo não é sobreposto, pois ao girar apenas as letras A e D coincidem, mas não C e B.
Que relação os outros pares de enantiômeros têm entre si? O composto e sua imagem do primeiro par enantiomérico são diastereômeros dos outros pares.
Em outras palavras, os diastereômeros são estereoisômeros do mesmo composto, mas sem serem produtos de seus próprios reflexos; isto é, eles não são sua imagem no espelho.
Uma maneira prática de assimilar esse conceito é através do uso de modelos, alguns deles tão simples quanto aqueles armados com uma bola de anime, paus e massas de plasticina para representar átomos ou grupos.
Nomenclatura
A mudança de local de duas letras produz outro enantiômero, mas se três letras forem alteradas, a operação retornará ao composto original com orientação espacial diferente.
Assim, mudar duas letras dá origem a dois novos enantiómeros e, ao mesmo tempo, a dois novos diastereómeros do par inicial.
No entanto, como diferenciar esses enantiômeros um do outro? É quando a configuração absoluta do RS surge.
Os pesquisadores que o implementaram foram Cahn, Sir Christopher Ingold e Vladimir Prelog. Por esse motivo, é conhecido como sistema de notação Cahn-Ingold-Prelog (RS).
Regras ou prioridades de sequência
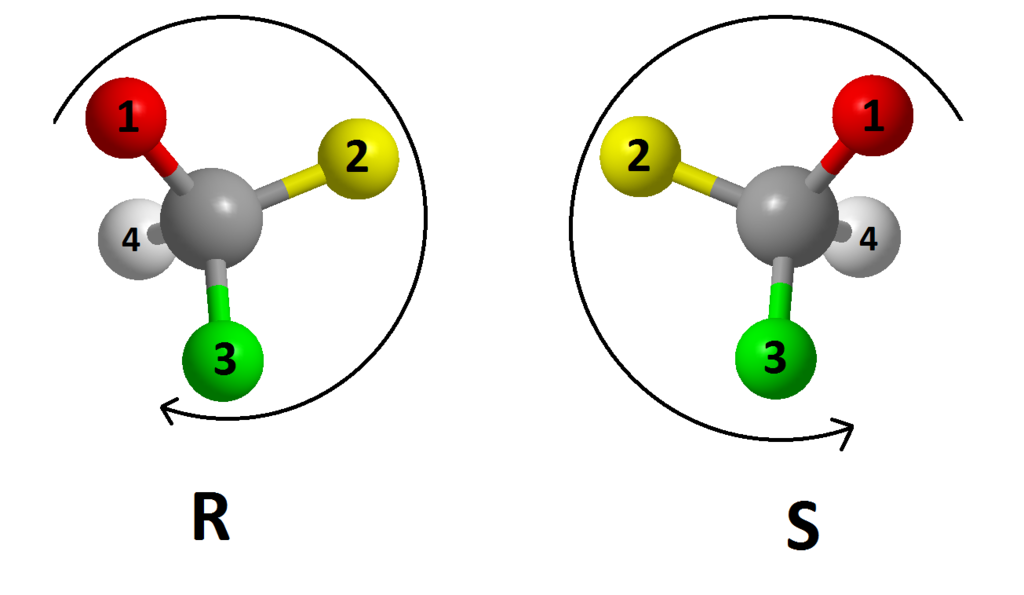
Como aplicar essa configuração absoluta? Primeiro, o termo “configuração absoluta” refere-se ao arranjo espacial exato dos substituintes no carbono assimétrico . Assim, cada arranjo espacial tem sua própria configuração R ou S.
A imagem acima ilustra duas configurações absolutas para um par de enantiômeros. Para designar um dos dois como R ou S, as regras de sequência ou prioridade devem ser seguidas:
1- O substituinte com o maior número atômico é aquele com a maior prioridade.
2- A molécula é orientada de modo que o átomo ou grupo de menor prioridade aponte atrás do plano.
3- As setas dos links são desenhadas e um círculo é desenhado na direção descendente de prioridade. Se essa direção for a mesma que no sentido horário, a configuração é R; se estiver no sentido anti-horário, a configuração será S.
No caso da imagem, a esfera vermelha marcada com o número 1 corresponde ao substituinte de maior prioridade e assim por diante.
A esfera branca, a do número 4, quase sempre corresponde ao átomo de hidrogênio. Em outras palavras: hidrogênio é o substituinte de menor prioridade e é contado por último.
Exemplo de configuração absoluta

No composto da imagem acima (amino ácido L-serina), o carbono assimrico com os seguintes substituintes: CH 2 OH, H, COOH e NH 2 .
As regras acima referidas para este composto, o substituinte de maior prioridade é NH 2 , COOH, seguida e, finalmente, o CH 2 OH. O quarto substituinte é entendido como H.
O grupo COOH tem prioridade sobre o CH 2 OH, porque o carbono forma três ligações com átomos de oxigênio (O, O, O), enquanto o outro forma apenas uma com OH (H, H, O).
Características dos enantiómeros
Os enantiômeros carecem de elementos de simetria. Esses elementos podem ser o plano ou o centro de simetria.
Quando estes estão presentes na estrutura molecular, é muito provável que o composto seja aquiral e, portanto, não possa formar enantiômeros.
Propriedades
Um par de enantiômeros exibe as mesmas propriedades físicas, como ponto de ebulição, ponto de fusão ou pressão de vapor.
No entanto, uma propriedade que os diferencia é a capacidade de girar a luz polarizada, ou o que é o mesmo: cada enantiômero tem suas próprias atividades ópticas.
Os enantiômeros que giram a luz polarizada no sentido horário adquirem a configuração (+), enquanto os que a rodam no sentido anti-horário adquirem a configuração (-).
Essas rotações são independentes do arranjo espacial dos substituintes no carbono assimétrico. Consequentemente, um composto de configuração R ou S pode ser (+) e (-).
Além disso, se as concentrações dos enantiômeros (+) e (-) forem iguais, a luz polarizada não se desvia de sua trajetória e a mistura é opticamente inativa. Quando isso acontece, a mistura é chamada mistura racêmica.
Por sua vez, os arranjos espaciais governam a reatividade desses compostos contra substratos estereoespecíficos. Um exemplo dessa estereoespecificidade ocorre no caso de enzimas, que só podem atuar em um determinado enantiômero, mas não em sua imagem no espelho.
Exemplos
De muitos enantiômeros possíveis, os três compostos a seguir são usados como exemplos:
Talidomida

Qual das duas moléculas tem a configuração S? O da esquerda. A ordem de prioridade é a seguinte: primeiro o átomo de nitrogênio, depois o grupo carbonil (C = O) e terceiro o grupo metileno (–CH 2 -).
Ao viajar pelos grupos, a direção no sentido horário (R) é usada; no entanto, quando o hidrogênio aponta para fora do plano, a configuração vista pelo ângulo traseiro realmente corresponde ao S, enquanto no caso da molécula à direita, o hidrogênio (a prioridade mais baixa) aponta uma vez para trás do avião.
Salbutamol e Limoneno
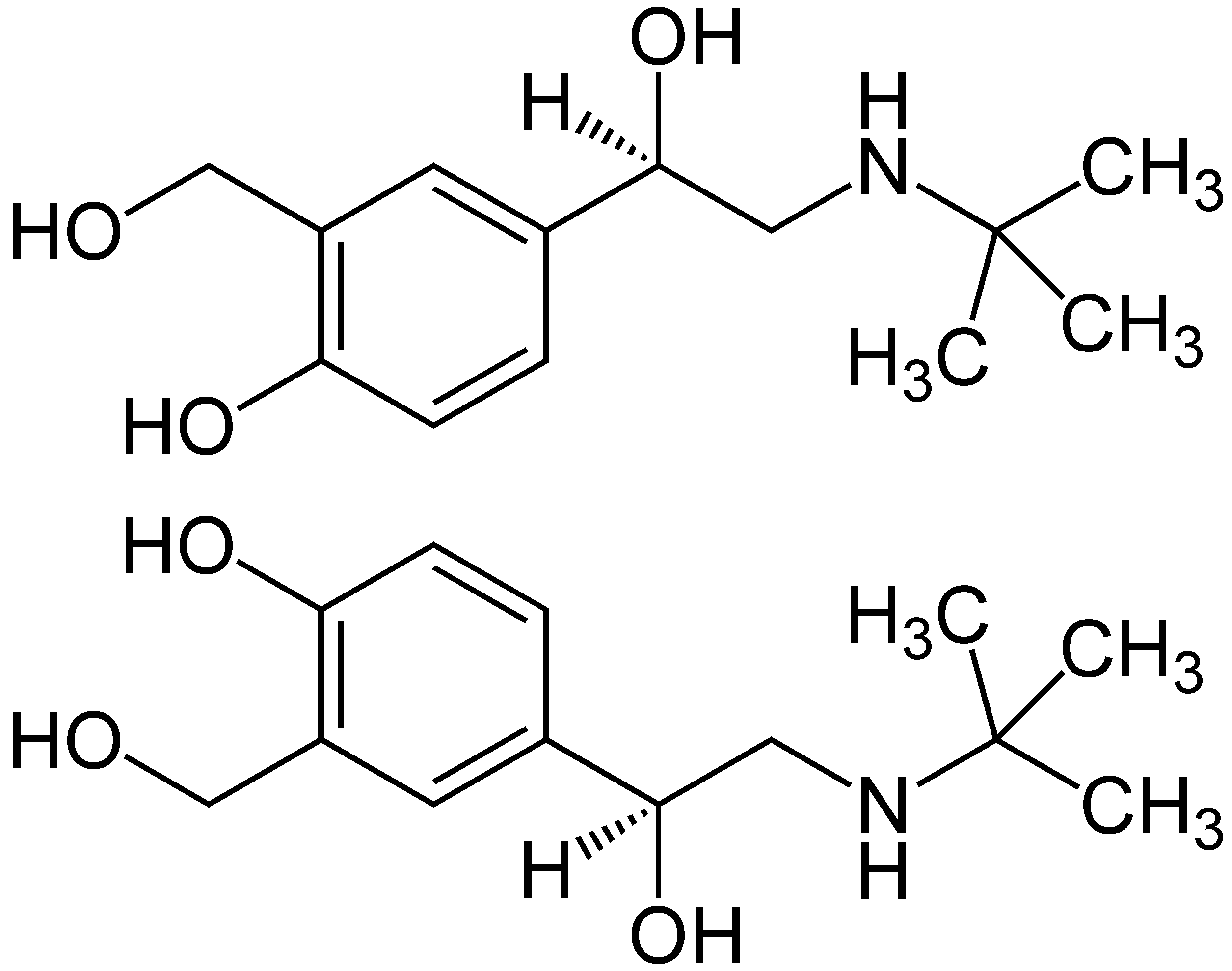
Qual das duas moléculas é o enantiômero R: a acima ou a abaixo? Nas duas moléculas, o carbono assimétrico está ligado ao grupo OH.
Estabelecendo a ordem de prioridades para a molécula abaixo que fornece: primeiro o OH, depois o anel aromático e terceiro o grupo CH 2 – NH – C (CH 3 ) 3 .
Percorrendo os grupos, um círculo é desenhado no sentido horário; portanto, é o enantiômero R. Assim, a molécula abaixo é o enantiômero R e o S está acima.
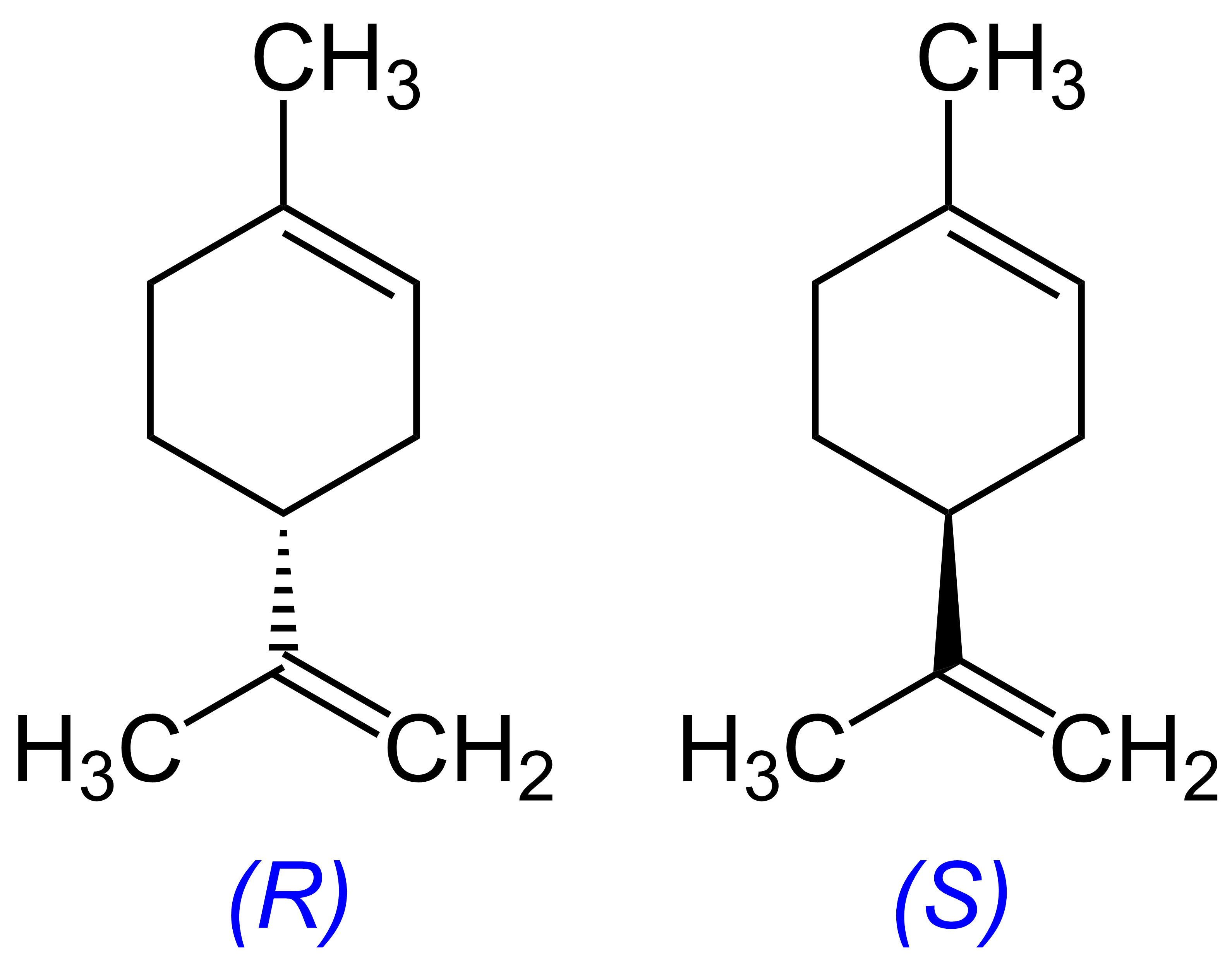
No caso do composto (R) – (+) – limoneno e (S) – (-) – limoneno, as diferenças estão em suas fontes e odores. O enantiómero R é caracterizado por ter um odor de laranjas, enquanto o enantiómero S tem um odor de limões.
Referências
- TW Graham Solomons, Craigh B. Fryhle. Química Orgânica (Décima Edição, p. 188-301) Wiley Plus.
- Francis A. Carey. Quimica Organica. Em estereoquímica . (Sexta edição., P. 288-301). Mc Graw Hill
- Zeevveez (1 de agosto de 2010). Reflexão de espelho de garfo. [Figura]: Recuperado em 17 de abril de 2018, de: flickr.com
- GP Moss Terminologia básica da estereoquímica (Recomendações da IUPAC 1996) Pure and Applied Chemistry, Volume 68, Edição 12, Páginas 2193–2222, ISSN (Online) 1365-3075, ISSN (Print) 0033-4545, DOI: doi.org
- Arquivo da molécula da semana. (1 de setembro de 2014). Talidomida Recuperado em 17 de abril de 2018, de: acs.org
- Jordi picart. (29 de julho de 2011). Atribuição das configurações R e S em um centro quiral. [Figura]. Recuperado em 17 de abril de 2018, de: commons.wikimedia.org