A hibridação química é um conceito fundamental da química orgânica que descreve a combinação de orbitais atômicos para formar novos orbitais híbridos, resultando em estruturas moleculares estáveis. Os principais tipos de hibridação são sp, sp2 e sp3, que estão relacionados com a geometria e propriedades das moléculas. Neste contexto, os orbitais s e p se combinam de diferentes maneiras, dependendo do número de ligações que o átomo central da molécula forma. Este processo de hibridação é crucial para entender a formação de ligações químicas e a estrutura das moléculas orgânicas.
Quando ocorre a hibridização sp3 nos átomos de carbono?
A hibridização sp3 ocorre nos átomos de carbono quando estes estão ligados a quatro outros átomos. Nesse processo, um orbital 2s e três orbitais 2p se combinam para formar quatro orbitais híbridos sp3, que possuem uma geometria tetraédrica. Isso permite que o carbono forme quatro ligações sigma com outros átomos, resultando em moléculas com tetraedro simétrico.
Essa hibridização é comum em compostos orgânicos como metano, etano, propano e muitos outros. A formação dos orbitais híbridos sp3 nos átomos de carbono permite que eles atinjam uma configuração eletrônica mais estável, maximizando a distância entre as ligações e minimizando as repulsões eletrônicas.
Em resumo, a hibridização sp3 nos átomos de carbono ocorre quando estes estão ligados a quatro outros átomos, resultando em orbitais híbridos que permitem a formação de quatro ligações sigma. Esse processo é fundamental para a estabilidade e geometria das moléculas orgânicas.
Entendendo a ligação sp2: características, propriedades e aplicações na química orgânica e inorgânica.
A hibridação química é um conceito fundamental na química orgânica e inorgânica que descreve a combinação de orbitais atômicos para formar orbitais híbridos. Entre os tipos de hibridação, o sp2 é um dos mais importantes e amplamente estudados.
Na hibridação sp2, um átomo de carbono forma três orbitais híbridos sp2 e um orbital puro p. Isso resulta em uma geometria trigonal planar, onde os três orbitais sp2 são direcionados para os vértices de um triângulo equilátero. Essa geometria permite a formação de ligações sigma e ligações pi, conferindo propriedades únicas às moléculas que contêm ligações sp2.
As ligações sp2 são mais fortes do que ligações sp3 devido à maior sobreposição de orbitais, tornando as moléculas mais estáveis. Além disso, a presença de ligações pi nas moléculas com hibridação sp2 confere maior reatividade química, tornando-as importantes em diversas aplicações na química orgânica e inorgânica.
Na química orgânica, as ligações sp2 são encontradas em compostos como alcenos e enóis, que são importantes na síntese de diversos produtos químicos. Já na química inorgânica, os compostos de coordenação que envolvem átomos de carbono com hibridação sp2 são essenciais em catalisadores e materiais avançados.
Em resumo, a hibridação sp2 confere propriedades únicas às moléculas, tornando-as essenciais em diversas aplicações na química orgânica e inorgânica. Compreender a ligação sp2 é fundamental para o estudo e desenvolvimento de novos materiais e compostos químicos.
Entenda o processo de hibridização SP e sua influência na geometria molecular.
Hibridação química é um conceito fundamental na química orgânica que desempenha um papel crucial na determinação da geometria molecular das moléculas. A hibridização SP é um dos tipos de hibridização mais comuns e influencia diretamente a forma como os átomos se organizam em uma molécula.
Na hibridização SP, um orbital s e um orbital p se combinam para formar dois orbitais híbridos SP. Isso ocorre quando um átomo central, como o carbono, está ligado a dois grupos diferentes. Os orbitais híbridos SP possuem uma maior energia e uma forma mais linear, o que influencia a geometria da molécula.
Por exemplo, o metano (CH4) apresenta hibridização SP3, onde os quatro orbitais híbridos SP3 se combinam com os quatro átomos de hidrogênio de forma a criar uma geometria tetraédrica. Já o etileno (C2H4) apresenta hibridização SP2, onde os três orbitais híbridos SP2 se combinam com os átomos de hidrogênio e carbono de forma a criar uma geometria trigonal planar.
Em resumo, a hibridização SP é um processo importante na química orgânica que influencia diretamente a geometria molecular das moléculas. Compreender esse processo é essencial para prever como os átomos se organizam e como as ligações químicas são formadas em uma molécula.
Descubra facilmente o tipo de hibridação em moléculas através de simples métodos.
A hibridação química é um conceito fundamental na química orgânica que descreve a combinação de orbitais atômicos para formar novos orbitais híbridos. Esses orbitais híbridos são essenciais para prever a geometria molecular e as propriedades dos compostos químicos. Existem três tipos principais de hibridação: sp, sp2 e sp3.
Para determinar o tipo de hibridação em uma molécula, um método simples é contar o número de ligações sigma e pares de elétrons não compartilhados em torno do átomo central. Para átomos com duas ligações sigma, a hibridação é sp. Para átomos com três ligações sigma, a hibridação é sp2. E para átomos com quatro ligações sigma, a hibridação é sp3.
Por exemplo, o carbono no metano (CH4) tem quatro ligações sigma, o que indica uma hibridação sp3. Já o carbono no eteno (C2H4) tem três ligações sigma e uma ligação pi, indicando uma hibridação sp2. E o carbono no etino (C2H2) tem duas ligações sigma e duas ligações pi, indicando uma hibridação sp.
Portanto, ao entender os conceitos básicos da hibridação química e utilizar métodos simples para identificar o tipo de hibridação em moléculas, é possível prever a geometria molecular e compreender melhor as propriedades dos compostos químicos.
Hibridação química: sp, sp2, sp3
A hibridação química é a “mistura” dos orbitais atómicas, cujo conceito foi introduzido pelo químico Pauling, em 1931, para cobrir as imperfeições ligação de valência (TEV). Que imperfeições? São elas: geometrias moleculares e comprimentos de ligação equivalentes em moléculas como o metano (CH 4 ).
De acordo com a VTE, no metano os orbitais atômicos de C formam quatro ligações σ com quatro átomos de H. Os orbitais 2p, com image (imagem inferior) de C, são perpendiculares entre si, portanto os Hs devem ser separados por dos outros em um ângulo de 90º.

Além disso, a orbital 2s (esférica) liga-se a C 1s H orbital a um ângulo de 135 ° em relação aos outros três H. No entanto, experimentalmente encontrados que ângulos na CH 4 são 109,5º e Além disso, os comprimentos dos links C – H são equivalentes.
Para explicar isso, uma combinação dos orbitais atômicos originais para formar quatro orbitais híbridos degenerados (de energia igual) deve ser considerada. A hibridação química entra em jogo aqui. Como são os orbitais híbridos? Depende dos orbitais atômicos que os geram. Eles também exibem uma mistura de suas características eletrônicas.
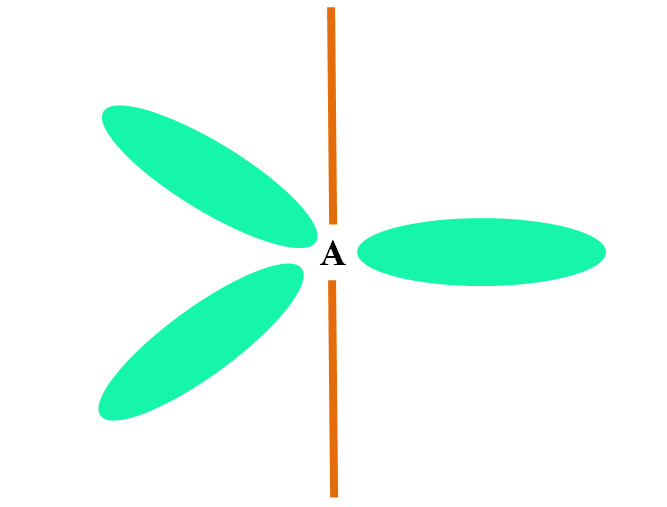
Hibridização Sp 3
No caso de CH 4 , C é a hibridação sp 3 . A partir dessa abordagem, a geometria molecular é explicada com quatro orbitais sp 3 separados a 109,5º e apontando para os vértices de um tetraedro.
A imagem acima mostra como os orbitais sp 3 (verde) estabelecem um ambiente eletrônico tetraédrico ao redor do átomo (A, que é C para CH 4 ).
Por que 109,5º e não outros ângulos, para “traçar” uma geometria diferente? O motivo é que esse ângulo minimiza as repulsões eletrônicas dos quatro átomos que se ligam a A.
Assim, a molécula de CH 4 pode ser representada como um tetraedro (geometria tetraédrica molecular).
Se, em vez de H, C formar ligações com outros grupos de átomos, qual seria sua hibridação? Enquanto o carbono formar quatro ligações σ (C – A), sua hibridação será sp 3 .
Por conseguinte, pode presumir-se que outros compostos orgânicos, tais como CH 3 OH, CCl 4 , C (CH 3 ) 4 , C 6 H 12 (ciclo-hexano), etc, o carbono tem uma hibridação sp 3 .
Isso é essencial para esboçar estruturas orgânicas, onde carbonos com ligações simples representam pontos de divergência; isto é, a estrutura não permanece em um único plano.
Interpretação
Qual é a interpretação mais simples para esses orbitais híbridos sem abordar os aspectos matemáticos (funções de onda)? Os orbitais sp 3 implicam que eles foram originados por quatro orbitais: um se três p.
Como a combinação desses orbitais atômicos é ideal, os quatro orbitais sp 3 resultantes são idênticos e ocupam orientações diferentes no espaço (como nos orbitais p x , p e yp z ).
O exposto acima se aplica ao restante das possíveis hibridizações: o número de orbitais híbridos formados é o mesmo que o dos orbitais atômicos combinados. Por exemplo, os orbitais híbridos sp 3 d 2 são formados a partir de seis orbitais atômicos: um s, três p e dois d.
Desvios dos ângulos de ligação
Segundo a Teoria da Repulsão dos Pares Eletrônicos da Camada de Valência (RPECV), um par de elétrons livres ocupa mais volume que um átomo ligado. Isso faz com que os elos se afastem, reduzindo a tensão eletrônica e desviando os ângulos de 109,5º:
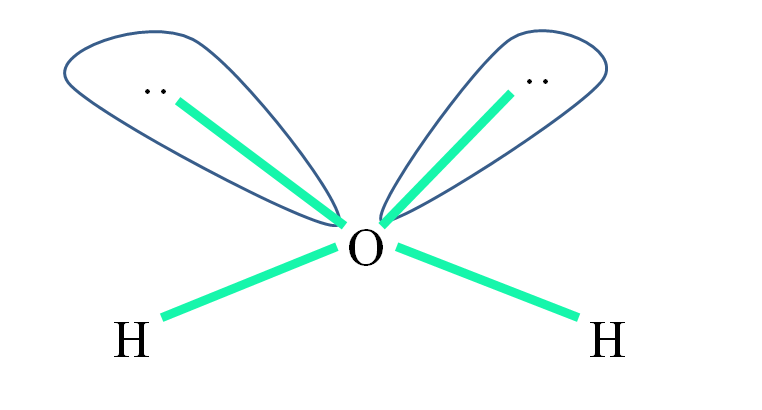
Por exemplo, na molécula de água, os átomos de H estão ligados aos orbitais sp 3 (em verde) e também aos pares de elétrons não compartilhados “:” ocupam esses orbitais.
As repulsões desses pares de elétrons são geralmente representadas como “dois balões com olhos”, os quais, devido ao seu volume, repelem as duas ligações σ O – H.
Assim, na água, os ângulos de ligação são realmente 105º, em vez dos 109,5º esperados para a geometria tetraédrica.
O que, em seguida, tem a geometria H 2 O? Tem uma geometria angular. Porque Porque enquanto a geometria eletrônica é tetraédrica, dois pares de elétrons não compartilhados a distorcem na geometria molecular angular.
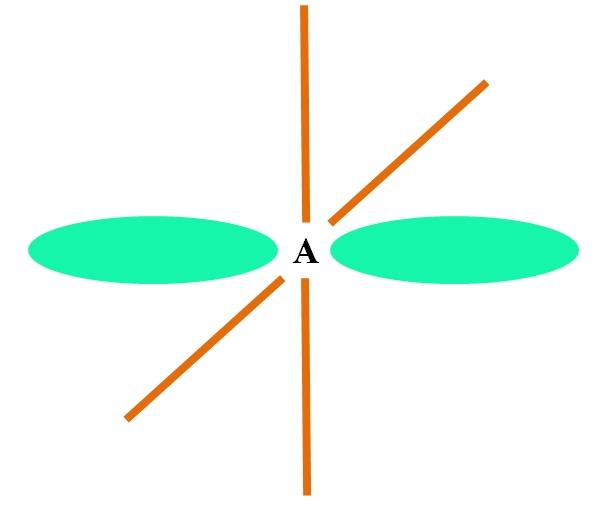
Hibridação Sp 2
Quando um um átomo de orbitais p combina dois s, gera três orbitais híbridos sp 2 ; no entanto, um orbital p permanece inalterado (porque existem três), que é representado como uma barra laranja na imagem acima.
Aqui, os três sp orbital 2 são verdes para destacar sua diferença a partir da barra de laranja: a orbital p “puro”.
Átomo hibridado sp 2 pode ser visto como um chão plano trigonal (o triângulo desenhado com orbitais sp 2 verde), com os seus vértices separados por 120 ° e ângulos perpendiculares a uma haste.
E qual o papel do orbital p puro? O de formar uma ligação dupla (=). Os orbitais sp 2 permite a formação de três ligações σ, enquanto puro p uma orbital π ligação (uma ligação dupla ou tripla ou duas ligações envolvem π).
Por exemplo, para desenhar o grupo carbonila e a estrutura da molécula de formaldeído (H 2 C = O), proceda da seguinte maneira:
O orbitais sp 2 C e S, formam uma ligação σ, enquanto que a sua forma pura, um orbitais títulos π (rectângulo laranja).
Pode-se ver como o restante dos grupos eletrônicos (átomos de H e os pares de elétrons não compartilhados) estão localizados nos outros orbitais sp 2 , separados por 120º.
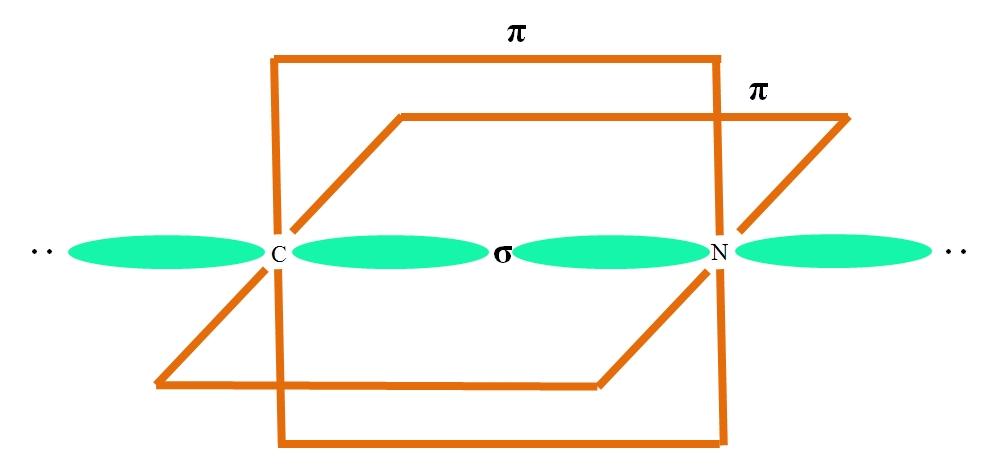
Hibridação Sp
Um átomo A com hibridação sp é ilustrado na imagem acima. Aqui, um orbital se um orbital p se combinam para causar dois orbitais sp degenerados. No entanto, dois orbitais p puros permanecem inalterados, o que permite A formar duas ligações duplas ou tripla (≡).
Em outras palavras: se em uma estrutura um C encontra o acima (= C = ou C≡C), então sua hibridação é sp. Para outros átomos menos ilustrativos – como metais de transição – a descrição das geometrias eletrônicas e moleculares é complicada porque os orbitais dy ef também são considerados.
Os orbitais híbridos são separados por um ângulo de 180º. Por esse motivo, os átomos ligados estão dispostos em uma geometria molecular linear (BAB). Finalmente, a estrutura do ânion cianeto pode ser vista na imagem abaixo:
Referências
- Sven (3 de junho de 2006). SP-orbitais . [Figura]. Recuperado em 24 de maio de 2018, de: commons.wikimedia.org
- Richard C. Banks (Maio de 2002). Colagem e hibridação . Recuperado em 24 de maio de 2018, de: chemistry.boisestate.edu
- James (2018). Para atalho de hibridação . Recuperado em 24 de maio de 2018, de: masterorganicchemistry.com
- Dr. Ian Hunt Departamento de Química, Universidade de Calgary. hibridação sp3 . Recuperado em 24 de maio de 2018, de: chem.ucalgary.ca
- Ligação Química II: Geometria Molecular e Hibridização de Orbitais Atômicos Capítulo 10. [PDF]. Recuperado em 24 de maio de 2018, de: wou.edu
- Quimitube (2015). Ligação covalente: Introdução à hibridação de orbitais atômicos . Recuperado em 24 de maio de 2018, de: quimitube.com
- Shiver & Atkins. (2008). Química Inorgânica (Quarta edição., P. 51). Mc Graw Hill