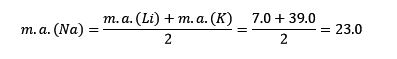As tríades Döbereiner são um conceito proposto pelo químico alemão Johann Wolfgang Döbereiner no século XIX. Ele observou que alguns elementos químicos possuíam propriedades semelhantes e poderiam ser agrupados em conjuntos de três, denominados tríades. Döbereiner percebeu que o peso atômico do elemento do meio de uma tríade era aproximadamente a média dos pesos atômicos dos outros dois elementos. Esse conceito foi importante para o desenvolvimento da Tabela Periódica dos Elementos e para a compreensão das relações entre os elementos químicos.
A definição e importância das tríades na história da China antiga.
As tríades são um sistema de organização criminosa originário da China antiga, que remonta a mais de dois mil anos atrás. Tradicionalmente, as tríades eram compostas por três grupos principais: os membros, os soldados e os associados. Cada grupo tinha funções específicas dentro da organização, desde a liderança e tomada de decisões até a execução de atividades ilícitas.
A importância das tríades na história da China antiga era significativa, pois influenciaram não apenas a criminalidade, mas também a política e a sociedade como um todo. As tríades desempenharam um papel crucial na manutenção do poder e no controle de territórios, muitas vezes em oposição ao governo imperial.
Döbereiner foi um químico alemão que desenvolveu a teoria das tríades na química, que consistia em agrupar elementos químicos em conjuntos de três com propriedades semelhantes. Essa teoria foi fundamental para o desenvolvimento da tabela periódica dos elementos e contribuiu significativamente para o avanço da química moderna.
Descubra a proposta de Johann Döbereiner para a tabela periódica dos elementos.
O que são as tríades Döbereiner? Johann Döbereiner, um químico alemão do século XIX, propôs um sistema de classificação dos elementos químicos chamado tríades. Segundo sua teoria, os elementos poderiam ser agrupados em grupos de três, onde o elemento do meio tinha propriedades químicas intermediárias aos elementos que o rodeavam.
Por exemplo, Döbereiner observou que o cloro, o bromo e o iodo formavam uma tríade, onde o peso atômico do bromo era a média dos pesos atômicos do cloro e do iodo. Além disso, esses elementos tinham propriedades químicas semelhantes.
Apesar de sua contribuição pioneira para a organização dos elementos químicos, a teoria das tríades de Döbereiner foi posteriormente substituída por sistemas de classificação mais complexos, como a tabela periódica de Mendeleev. No entanto, sua proposta foi importante para o desenvolvimento da química moderna e da tabela periódica que utilizamos atualmente.
Por que a tabela de Dobereiner é conhecida como tríade na química?
A tabela de Dobereiner é conhecida como tríade na química porque o químico alemão Johann Wolfgang Döbereiner agrupou os elementos químicos em grupos de três, chamados tríades, com base em suas propriedades químicas semelhantes. Cada tríade era formada por três elementos em que o peso atômico do elemento do meio era a média dos pesos atômicos dos outros dois elementos da tríade.
Essas tríades de Dobereiner foram um dos primeiros esforços para organizar os elementos químicos de uma maneira sistemática, antes do desenvolvimento da tabela periódica moderna. Apesar de não serem perfeitas e terem algumas falhas, as tríades de Dobereiner contribuíram para o avanço da compreensão da química e da relação entre os elementos.
Portanto, a tabela de Dobereiner é conhecida como tríade na química devido à sua organização dos elementos em grupos de três com propriedades químicas semelhantes, representando uma das primeiras tentativas de classificação dos elementos químicos.
Quais grupos da Tabela Periódica antiga são considerados parte das tríades?
As tríades de Döbereiner são um conceito proposto pelo químico alemão Johann Wolfgang Döbereiner no século XIX. Ele observou que alguns elementos podiam ser agrupados em conjuntos de três, com propriedades químicas semelhantes. Esses grupos ficaram conhecidos como tríades de Döbereiner.
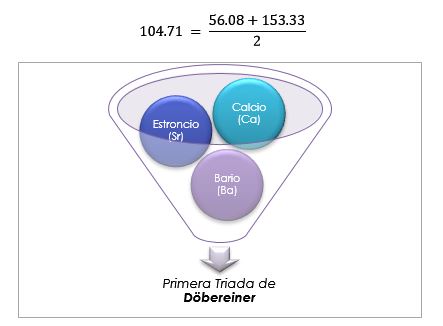
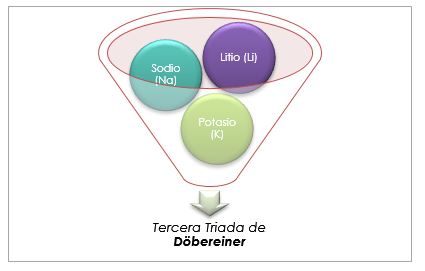
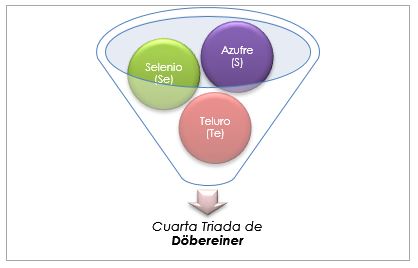
Na Tabela Periódica antiga de Döbereiner, os grupos considerados parte das tríades eram o lítio, o sódio e o potássio; o cálcio, o estrôncio e o bário; e o enxofre, o selênio e o telúrio. Esses elementos possuíam massas atômicas próximas e propriedades químicas semelhantes.
Embora as tríades de Döbereiner tenham contribuído para o desenvolvimento da Tabela Periódica moderna, atualmente sabemos que a classificação dos elementos vai além desses grupos de três. A Tabela Periódica atual organiza os elementos de acordo com o número atômico, configurando um padrão que reflete as propriedades periódicas dos elementos de forma mais abrangente.
O que são as tríades Döbereiner?
As tríades Döbereiner são grupos de três produtos químicos que compartilham características semelhantes. Fazem parte dos 118 elementos químicos, sendo a diversidade de reações mostradas e seus compostos, o aspecto mais fascinante.
A idéia de classificar os elementos é tratar adequadamente suas propriedades químicas sem a necessidade de desenvolver isoladamente um conjunto de regras e teorias para cada um deles.
Sua classificação periódica forneceu uma estrutura sistemática imensamente útil para correlacioná-los de acordo com alguns padrões muito simples e lógicos.
Os elementos são organizados sistematicamente em linhas e colunas com números atômicos crescentes, e o espaço foi reservado para novas descobertas.
Em 1815, apenas 30 elementos eram conhecidos. Embora houvesse muita informação disponível sobre estes e seus compostos, não havia uma ordem aparente.
Várias tentativas foram feitas para encontrar ordem; no entanto, era difícil organizar tudo o que se sabia, muitos cientistas começaram a procurar algum padrão em suas propriedades que remediasse essa situação.
Descoberta das tríades de Döbereiner
O cientista Johann Wolfgang Döbereiner fez importantes descobertas sobre a regularidade numérica entre os pesos atômicos dos elementos; ele foi o primeiro a notar a existência de vários grupos de três elementos, que ele chamou de tríades, que mostravam semelhanças químicas.
Esses elementos revelaram uma importante relação numérica, uma vez que, uma vez ordenados de acordo com seu peso equivalente, ou peso atômico, o peso do elemento central acabou sendo a média aproximada dos dois elementos restantes da tríade.
Em 1817, Döbereiner descobriu que, se certos elementos fossem combinados com oxigênio em compostos binários, uma relação numérica poderia ser discernida entre os pesos equivalentes desses compostos.
A observação de Döbereiner inicialmente teve pouco impacto no mundo químico, mas depois se tornou muito influente. Atualmente, ele é considerado um dos pioneiros no desenvolvimento do sistema periódico.
Doze anos depois, em 1829, Döbereiner adicionou três novas tríades, que são mostradas abaixo:
Grupo de halogênio
Cloro, bromo e iodo têm propriedades químicas semelhantes e formam uma tríade. Esses elementos não são metais muito reativos. Se eles estão listados em ordem crescente de massa relativa, estão em ordem decrescente de reatividade. O bromo possui massa atômica intermediária entre cloro e iodo.
A massa atômica do elemento do meio Bromo (Br) é igual à média das massas atômicas de Cloro (Cl) e Iodo (I).
O valor médio obtido é próximo à massa atômica de Bromo (Br).
Semelhanças nas propriedades químicas:
- Eles são todos não-metais.
- Todos eles reagem com a água para formar ácidos (por exemplo, em: HCl, HBr, HF).
- Todos têm uma valência de um (por exemplo, em: HCl, HBr, HF).
- Todos eles reagem com metais alcalinos para formar sais neutros (por exemplo, NaCl, NaBr, NaI)
Alkaline Metals Group
O lítio, o sódio e o potássio têm propriedades químicas semelhantes e formam uma tríade. Esses elementos são metais macios e leves, mas muito reativos.
Se eles estão listados em ordem crescente de massa atômica relativa, também estão em ordem crescente de reatividade. O sódio tem a massa atômica intermediária entre o lítio e o potássio.
A massa atômica do elemento central Sódio (Na) é igual à média da massa atômica de Lítio (Li) e Potássio (K).
Semelhanças nas propriedades químicas:
- Eles são todos metais.
- Todos reagem com a água para formar soluções alcalinas e gás hidrogênio.
- Todos têm uma valência de um (por exemplo, em: LiCl, NaCl, KCl).
- Seus carbonatos são resistentes à decomposição térmica.
Grupo de calcógenos ou anfíbios
O enxofre, o selênio e o telúrio têm propriedades químicas semelhantes e formam uma tríade. O selênio tem a massa atômica intermediária entre o enxofre e o telúrio.
A massa atômica do elemento do meio Selênio (Se) é igual às massas atômicas médias de enxofre (S) e Teluro (Te).
Novamente, o valor médio obtido é próximo à massa atômica do selênio (Se).
Semelhanças nas propriedades químicas:
- As combinações de hidrogênio desses elementos resultam em gases tóxicos.
- Cada um desses elementos possui 6 elétrons de valência.
- As qualidades metálicas aumentam à medida que o número atômico aumenta.
Döbereiner também alertou que, para serem válidas, as tríades tinham que revelar relações químicas entre os elementos, bem como relações numéricas.
Por outro lado, ele se recusou a agrupar o flúor junto com o cloro, o bromo e o iodo, como ele poderia ter feito por razões químicas, porque não encontrou uma relação triádica entre os pesos atômicos do flúor e os outros halogênios.
Ele também relutou em considerar o aparecimento de tríades entre elementos diferentes, como nitrogênio, carbono e oxigênio, apesar de mostrar uma relação numérica triádica significativa.
O trabalho de Dobereiner enfocou as relações entre os elementos de uma tríade, mas não deu nenhuma pista sobre a relação entre as tríades.
Basta dizer que a pesquisa de Döbereiner estabeleceu a noção de tríades como um conceito poderoso, que vários outros químicos logo levariam em consideração.
De fato, as tríades de Döbereiner representaram o primeiro passo para agrupar os elementos em colunas verticais dentro da tabela periódica e, assim, estabelecer um sistema que explica as propriedades químicas e revela as relações físicas dos elementos.
Expansão da tríade
Outros químicos estenderam as tríades de Döbereiner para incluir mais do que os três elementos originais. Por exemplo, fluoreto foi adicionado ao topo da tríade que continha cloro, bromo e iodo.
Outras “tríades” foram produzidas, como uma contendo oxigênio, enxofre, selênio e telúrio. Mas não havia um sistema que os correlacionasse como um todo.
Uma das principais desvantagens foi que muitas massas atômicas relativas ainda estavam erradas para a época.
Referências
- Clugston, M. e Flemming, R. (2000) Advanced Chemistry. Nova York, Oxford University Press.
- Johann Wolfgang Döbereiner. Recuperado de: britannica.com.
- Sauders, N. (2010). Avanços em ciência e tecnologia: quem inventou a tabela periódica? Minnesotta, Arcturus Publishing Limited.
- Scerri, E. (2007) .A tabela periódica: sua história e seu significado. Nova York, Oxford University Press.
- Shyamal, A. (2008), Living Science Chemistry 10. Nova Deli, Ratna Sagar P. Ltd.
- Qual é o grupo 16 da tabela periódica? Como esses elementos são usados? Recuperado de: quora.com.