O óxido de prata (Ag2O) é um composto químico formado por átomos de prata e oxigênio, com uma estrutura cristalina. Este composto apresenta propriedades únicas, como a capacidade de conduzir eletricidade e reagir facilmente com ácidos. O óxido de prata é amplamente utilizado em diversas aplicações, como em baterias de óxido de prata, em sensores químicos e em revestimentos cerâmicos. Sua versatilidade e propriedades tornam este composto um material importante em diversas áreas da indústria e da pesquisa.
Conheça a utilidade do Ag2O, substância presente em diversos processos de química e indústria.
O óxido de prata (Ag2O) é uma substância amplamente utilizada em diversos processos químicos e industriais devido às suas propriedades únicas. Este composto é formado pela ligação de dois átomos de prata com um átomo de oxigênio, resultando em uma estrutura cristalina que confere ao Ag2O várias aplicações práticas.
Em termos de propriedades, o óxido de prata é conhecido por sua cor marrom-avermelhada e sua capacidade de se decompor facilmente em prata metálica e oxigênio quando aquecido. Além disso, o Ag2O é um bom condutor de eletricidade e possui propriedades fotocatalíticas, o que o torna útil em diversas áreas.
Dentre os principais usos do óxido de prata, destacam-se: sua aplicação na fabricação de pilhas e baterias, onde é utilizado como um dos componentes ativos; na indústria fotográfica, para produzir filmes e papel fotográfico sensível à luz; e na produção de compostos químicos como o cianeto de prata, utilizado em processos de galvanização.
Além disso, o Ag2O também é empregado em medicina, especialmente em curativos de prata que ajudam na cicatrização de feridas e queimaduras, devido às suas propriedades antimicrobianas.
Em resumo, o óxido de prata é uma substância versátil e essencial em diversos setores da indústria e da ciência, graças às suas propriedades únicas e aos seus variados usos. Seja na produção de energia, na fotografia, na medicina ou em processos químicos, o Ag2O desempenha um papel fundamental em muitas aplicações do dia a dia.
Características do óxido: quais são as propriedades desse composto químico tão importante?
O óxido de prata (Ag2O) é um composto químico de grande importância devido às suas diversas propriedades. Este óxido possui uma estrutura cristalina cúbica, sendo um sólido de cor marrom avermelhada. Suas propriedades incluem alta reatividade química, solubilidade em ácidos e insolubilidade em água. Além disso, o óxido de prata é um bom condutor de eletricidade e apresenta propriedades fotocatalíticas.
Uma das principais aplicações do óxido de prata é na fabricação de eletrodos em células eletroquímicas, devido à sua capacidade de conduzir eletricidade. Também é utilizado em medicina, em curativos antibacterianos, devido às suas propriedades antimicrobianas. Outra aplicação importante é na indústria fotográfica, onde o óxido de prata é utilizado em filmes fotográficos.
Em resumo, o óxido de prata possui propriedades únicas que o tornam um composto químico de grande importância em diferentes áreas, desde a indústria até a medicina.
Qual é o estado de oxidação do átomo de prata no composto Ag2O?
O óxido de prata (Ag2O) é um composto inorgânico formado por átomos de prata e oxigênio. No Ag2O, o átomo de prata possui um estado de oxidação de +1. Isso ocorre porque o oxigênio é mais eletronegativo que a prata, atraindo os elétrons da ligação de forma mais intensa e deixando a prata com carga positiva.
O óxido de prata é um sólido cristalino de cor marrom-avermelhada que é insolúvel em água. É usado em várias aplicações, como em catálise e na fabricação de espelhos.
Em resumo, o átomo de prata no composto Ag2O possui um estado de oxidação de +1, devido à sua interação com o oxigênio. O óxido de prata é um composto útil com diversas aplicações industriais.
Fórmula do óxido: como determinar a composição química desse composto essencial na química.
A fórmula de um óxido pode ser determinada através da combinação dos elementos presentes no composto. Para isso, é necessário conhecer a valência dos elementos envolvidos e balancear as cargas para que se obtenha uma fórmula química correta.
O óxido de prata (Ag2O) é um composto formado pela combinação do elemento prata (Ag) com o oxigênio (O). Neste caso, a prata possui valência +1 e o oxigênio possui valência -2. Para que as cargas se igualem, é necessário que haja duas unidades de prata para cada uma unidade de oxigênio, resultando na fórmula química Ag2O.
O óxido de prata é um composto de coloração marrom-avermelhada, que se decompõe facilmente quando exposto à luz. Suas propriedades químicas incluem a capacidade de reagir com ácidos para formar sais de prata.
Usos do óxido de prata incluem sua aplicação em medicina como agente bactericida e em fotografia como material sensível à luz. Sua estrutura cristalina é do tipo cubic system, apresentando átomos de prata dispostos em um arranjo regular.
Óxido de prata (Ag2O): estrutura, propriedades e usos
O óxido de prata é um composto inorgânico cuja fórmula química é Ag 2 O. A força de ligação dos átomos é inteiramente iónico na natureza; portanto, que compreende um ião sólido onde uma proporção de dois catiões Ag + interagir electrostaticamente com um anião O 2- .
O anião óxido ó 2 , resultante da interacção entre os átomos de prata de superfície com o oxigénio a partir da atmosfera; muito parecido com ferro e muitos outros metais. Uma peça ou joia de prata, em vez de ficar avermelhada e se transformando em ferrugem, fica preta, característica do óxido de prata.
Por exemplo, um copo de prata oxidado pode ser visto na imagem acima. Observe sua superfície enegrecida, embora ainda retenha algum brilho ornamental; é por isso que até objetos de prata enferrujados podem ser considerados atraentes o suficiente para usos decorativos.
As propriedades do óxido de prata são tais que não deterioram, à primeira vista, a superfície original do metal. É formado à temperatura ambiente pelo simples contato com o oxigênio no ar; e ainda mais interessante, pode se decompor em altas temperaturas (acima de 200 ° C).
Isso significa que, se o copo da imagem fosse agarrado e o calor de uma chama intensa fosse aplicado, ele recuperaria seus brilhos prateados. Portanto, sua formação é um processo termodinamicamente reversível.
O óxido de prata também possui outras propriedades e, além de sua simples fórmula Ag 2 O, abrange organizações estruturais complexas e uma rica variedade de sólidos. No entanto, Ag 2 O é talvez, juntamente com Ag 2 O 3 , o mais representativo dos óxidos de prata.
Estrutura de óxido de prata
Como está sua estrutura? Como mencionado no início: é um sólido iônico. Por esse motivo, não pode haver ligações covalentes Ag-O ou Ag = O em sua estrutura; já que, se houvesse, as propriedades desse óxido mudariam drasticamente. É, em seguida, iões Ag + e O 2- na proporção de 2: 1 e tendo uma atracção electrostática.
A estrutura do óxido de prata é determinado em conformidade, a forma como as forças iónicas dispostos no espaço a iões Ag + , e O 2- .
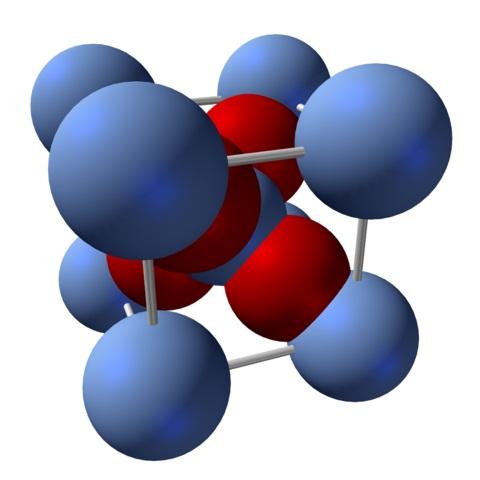
Na imagem acima, por exemplo, que tem uma unidade de célula para o sistema de cristal cúbico: catiões Ag + são esferas azuis prateadas, e O 2- áreas avermelhadas.
Se o número de esferas for contado, descobrir-se-á que, de relance, nove azul-prateado e quatro vermelho. No entanto, apenas fragmentos das esferas contidas no cubo são levados em consideração; de contá-las, sendo frações das esferas totais, a razão 2: 1 para Ag 2 O deve ser atendida .
Repetindo a unidade estrutural do tetraedro AgO 4 cercada por outros quatro Ag + , todo o sólido preto é construído (evitando as lacunas ou irregularidades que esses arranjos cristalinos podem ter).
Alterações com o número de valência
Focando agora não no tetraedro AgO 4, mas na linha AgOAg (observe os vértices do cubo superior), o sólido óxido de prata terá, de outra perspectiva, várias camadas de íons dispostas linearmente (embora inclinadas). Tudo isso como resultado da geometria “molecular” em torno do Ag + .
O exposto acima foi corroborado por vários estudos de sua estrutura iônica.
A prata trabalha predominantemente com valência +1, pois, ao perder um elétron, sua configuração eletrônica resultante é [Kr] 4d 10 , que é muito estável. Outras valências, como Ag 2+ e Ag 3+, são menos estáveis, pois perdem elétrons dos orbitais quase completamente cheios.
O íon Ag 3+ , no entanto, é relativamente menos instável em comparação com o Ag 2+ . De fato, ele pode coexistir na empresa do Ag + enriquecendo quimicamente a estrutura.
Sua configuração eletrônica é [Kr] 4d 8 , com a falta de elétrons, de maneira a proporcionar alguma estabilidade.
Ao contrário das geometrias lineares em torno dos íons Ag + , a dos íons Ag 3+ é um plano quadrado. Portanto, um óxido de prata com íons Ag 3+ consistiria em camadas compostas por quadrados de AgO 4 (não tetraedro) eletrostaticamente ligados por linhas AgOAg; é o caso de Ag 4 O 4 ou Ag 2 O ∙ Ag 2 O 3 com estrutura monoclínica.
Propriedades físicas e químicas
Se a superfície do copo prateado da imagem principal estiver arranhada, será obtido um sólido, que não é apenas preto, mas também possui tons marrons ou marrons (imagem acima). Algumas de suas propriedades físicas e químicas relatadas no momento são as seguintes:
Peso molecular
231.735 g / mol
Aparência
Sólido preto marrom, em pó (observe que, apesar de ser um sólido iônico, não possui aparência cristalina). É inodoro e misturado com água, conferindo um sabor metálico
Densidade
7,14 g / mL.
Ponto de fusão
277-300 ° C. Certamente, derrete em prata maciça; isto é, provavelmente se decompõe antes de formar o óxido líquido.
Kps
1,52 × 10 -8 em água a 20 ° C. Portanto, é um composto dificilmente solúvel em água.
Solubilidade
Se você observar atentamente a imagem de sua estrutura, verá que as esferas de Ag 2+ e O 2 não diferem quase em tamanho. Isso resulta em que apenas pequenas moléculas podem penetrar no interior da rede cristalina, tornando-a insolúvel em quase todos os solventes; exceto aqueles em que reage, como bases e ácidos.
Caráter covalente
Embora tenha sido dito repetidamente que o óxido de prata é um composto iônico, certas propriedades, como seu baixo ponto de fusão, contradizem essa afirmação.
Certamente, a consideração do caráter covalente não desmorona o que é explicado por sua estrutura, pois seria suficiente adicionar um modelo de esferas e barras na estrutura de Ag 2 O para indicar ligações covalentes.
Da mesma forma, o tetraedro de AgO 4 e os planos quadrados , bem como as linhas de AgOAg, seriam ligados por ligações covalentes (ou iônicas covalentes).
Com isso em mente, o Ag 2 O seria realmente um polímero. No entanto, recomenda-se considerá-lo como um sólido iônico covalente (cuja natureza do link ainda é um desafio hoje).
Decomposição
No início, foi mencionado que sua formação é termodinamicamente reversível, portanto absorve o calor para retornar ao seu estado metálico. Tudo isso pode ser expresso por duas equações químicas para tais reações:
4Ag (s) + O 2 (g) => 2Ag 2 O (s) + Q
2Ag 2 O (s) + Q => 4Ag (s) + O 2 (g)
Onde Q representa o calor na equação. Isso explica por que o fogo que queima a superfície da xícara de prata oxidada retorna seu brilho prateado.
Portanto, é difícil supor que exista Ag 2 O (l), pois ele se decompõe instantaneamente pelo calor; a menos que a pressão seja elevada demais para obter o referido líquido preto marrom.
Nomenclatura
Quando a possibilidade de íons Ag 2+ e Ag 3+ foi introduzida além do Ag + comum e predominante , o termo ‘óxido de prata’ começa a parecer insuficiente para se referir a Ag 2 O.
Isso ocorre porque o íon Ag + é mais abundante que os outros, então o Ag 2 O é considerado o único óxido; o que não está correto.
Se Ag 2+ é considerado praticamente inexistente, dada a sua instabilidade, somente os íons com valências +1 e +3 serão tomados; isto é, Ag (I) e Ag (III).
Valência I e III
Como o Ag (I) a valência inferior, ele é nomeado pelo acréscimo do sufixo -oso seu nome Argentum . Assim, Ag 2 O é: óxido de argentoso ou, de acordo com a nomenclatura sistemática, monóxido de diplata.
Se Ag (III) for completamente ignorado, sua nomenclatura tradicional deverá ser: óxido argumentativo em vez de óxido argental.
Por outro lado, o Ag (III), sendo a maior valência, é adicionado o sufixo -ico ao seu nome. Assim, Ag 2 O 3 é a seguinte: óxido de argêntico (Ag 2 iões 3+ três S 2- ). Além disso, seu nome de acordo com a nomenclatura sistemática seria: trióxido de diplata.
Se a estrutura de Ag 2 O 3 for observada , pode-se presumir que é o produto de uma oxidação pelo ozônio, O 3 , em vez de oxigênio. Portanto, carácter covalente deve ser maior quando sendo composto covalente com ligaes de Ag ou Ag-OOO-Ag-O 3 -ag.
Nomenclatura sistemática de óxidos complexos de prata
AgO, também escrito como Ag 4 O 4 ou Ag 2 O ∙ Ag 2 O 3 , é um óxido de prata (I, III), pois possui valências +1 e +3. Seu nome, de acordo com a nomenclatura sistemática, seria: tetraplate tetraoxide.
Esta nomenclatura é útil quando se trata de outros óxidos de prata estequiometricamente mais complexos. Por exemplo, suponha que os dois sólidos 2Ag 2 O ∙ Ag 2 O 3 e Ag 2 O ∙ 3Ag 2 O 3 .
Escrever o primeiro de maneira mais apropriada seria: Ag 6 O 5 (contando e adicionando os átomos de Ag e O). Seu nome seria então hexóxido de pentóxido. Observe que esse óxido tem uma composição de prata menos rica que a Ag 2 O (6: 5 <2: 1).
Enquanto escrevia o segundo sólido, seria: Ag 8 O 10 . Seu nome seria decaóxido de oitava (com uma proporção de 8:10 ou 4: 5). Esse óxido de prata hipotético seria “muito enferrujado”.
Usos
Estudos em busca de novos e sofisticados usos do óxido de prata estão sendo realizados atualmente. Alguns de seus usos estão listados abaixo:
-Dissolve-se em amônia, nitrato de amônio e água para formar o reagente de Tollens. Este reagente é uma ferramenta útil em análises qualitativas em laboratórios de química orgânica. Permite determinar a presença de aldeídos em uma amostra, sendo uma resposta positiva a formação de um “espelho de prata” no tubo de ensaio.
– Juntamente com o zinco metálico, forma as principais baterias de óxido de zinco-prata. Este é talvez um dos usos mais comuns e domésticos.
– Serve como purificador de gás, absorvendo, por exemplo, CO 2 . Quando aquecido, libera gases retidos e pode ser reutilizado várias vezes.
-Por causa das propriedades antimicrobianas da prata, seu óxido é útil em estudos de bioanálise e purificação do solo.
-É um agente oxidante leve capaz de oxidar aldeídos em ácidos carboxílicos. Também é usado na reação de Hofmann (de aminas terciárias) e participa de outras reações orgânicas, como reagente ou catalisador.
Referências
- Bergstresser M. (2018). Óxido de Prata: Fórmula, Decomposição e Formação. Estudo Recuperado de: study.com
- Autores e editores dos volumes III / 17E-17F-41C. (sf). Estrutura cristalina de óxidos de prata (Ag (x) O (y)), parâmetros da rede. (Dados numéricos e relações funcionais em ciência e tecnologia), vol 41C. Springer, Berlim, Heidelberg.
- Mahendra Kumar Trivedi, Rama Mohan Tallapragada, Alice Branton, Dahryn Trivedi, Gopal Nayak, Omprakash Latiyal, Snehasis Jana. (2015). O Potencial Impacto do Tratamento de Energia de Biocampo nas Propriedades Físicas e Térmicas do Óxido de Prata em Pó. Revista Internacional de Ciência e Engenharia Biomédica. Vol. 3, No. 5, pp. 62-68. doi: 10.11648 / j.ijbse.20150305.11
- Sullivan R. (2012). Decomposição de óxido de prata. University of Oregon Recuperado de: chemdemos.uoregon.edu
- Flint, Deyanda. (24 de abril de 2014). Usos de baterias de óxido de prata. Sciencing Recuperado de: sciencing.com
- Salman Montasir E. (2016). Estudo de algumas propriedades ópticas do óxido de prata (Ag2o) usando espectrofotômetro UVVisível. [PDF]. Recuperado em: iosrjournals.org
- Bard Allen J. (1985). Potenciais padrão em solução aquosa. Marcel Dekker Recuperado de: books.google.co.ve