A ponte de hidrogênio é uma ligação química que ocorre entre um átomo de hidrogênio e um átomo muito eletronegativo, como oxigênio, nitrogênio ou flúor. Essa ligação é mais fraca do que as ligações iônicas ou covalentes, mas é fundamental em diversas propriedades de substâncias como a água e moléculas biológicas. A ponte de hidrogênio é responsável por características como a alta tensão superficial da água, o ponto de ebulição elevado e a capacidade de várias moléculas se unirem em estruturas tridimensionais.
Importância da ponte de hidrogênio em sistemas biológicos: conceito e importância na biologia.
A ponte de hidrogênio é uma interação fraca que ocorre entre um átomo de hidrogênio ligado a um átomo eletronegativo (como o oxigênio, nitrogênio ou flúor) e outro átomo eletronegativo. Essa interação é essencial em sistemas biológicos, pois desempenha um papel crucial em diversas funções biológicas.
Na biologia, a ponte de hidrogênio é responsável por manter a estrutura tridimensional das proteínas e ácidos nucleicos, permitindo que essas moléculas desempenhem suas funções de maneira eficiente. Além disso, a ponte de hidrogênio é fundamental na formação e estabilidade das membranas celulares, garantindo a integridade das células.
Outra importante função da ponte de hidrogênio em sistemas biológicos é na interação entre moléculas de água. A água é uma molécula polar que forma pontes de hidrogênio entre si, criando uma rede de ligações que confere à água propriedades únicas, como a alta capacidade de solvatação e a regulação da temperatura corporal.
Portanto, compreender a importância da ponte de hidrogênio em sistemas biológicos é fundamental para avançar no conhecimento da vida e dos processos biológicos.
Qual a função da ligação de hidrogênio?
A ligação de hidrogênio é uma interação fraca que ocorre entre uma molécula de hidrogênio ligada a um átomo eletronegativo e outro átomo eletronegativo. Essa ligação é de extrema importância em várias áreas da química e da biologia.
Uma das principais funções da ligação de hidrogênio é a estabilização de estruturas moleculares, como proteínas e ácidos nucleicos. Essas ligações ajudam a manter a forma e a estrutura dessas moléculas, permitindo que desempenhem suas funções biológicas de forma adequada.
Além disso, a ligação de hidrogênio também é responsável por diversas propriedades físicas da água, como a sua alta capacidade de dissolver substâncias e a sua tensão superficial. Essas propriedades são essenciais para a vida no planeta.
A relevância das pontes de hidrogênio na vida cotidiana: por que são essenciais?
As pontes de hidrogênio são interações fundamentais que ocorrem entre moléculas de água e outras substâncias, desempenhando um papel crucial em diversos aspectos da vida cotidiana. Essas pontes são essenciais porque são responsáveis pela coesão da água, garantindo sua alta capacidade de solubilização e transporte de nutrientes em nosso organismo.
Além disso, as pontes de hidrogênio são responsáveis pela estruturação de proteínas e ácidos nucleicos, como o DNA, garantindo a estabilidade dessas biomoléculas. Sem essas interações, a vida como a conhecemos não seria possível, uma vez que a estrutura e função de diversas macromoléculas seriam comprometidas.
Na química do dia a dia, as pontes de hidrogênio também desempenham um papel importante. Por exemplo, na cozinha, a formação de pontes de hidrogênio é fundamental para a gelificação de alimentos, como gelatinas e pudins. Além disso, a água, que é essencial para a preparação de alimentos, possui suas propriedades únicas devido à presença dessas pontes.
Sem elas, muitos processos biológicos e químicos não poderiam ocorrer, tornando-as fundamentais para a existência da vida como a conhecemos.
A relevância das pontes de hidrogênio na estrutura do DNA.
As pontes de hidrogênio são interações fundamentais na estrutura molecular do DNA. Essas ligações formam-se entre as bases nitrogenadas, contribuindo para a estabilidade e a estrutura tridimensional da molécula.
As pontes de hidrogênio são ligações fracas, porém essenciais, que ocorrem entre o grupo amino de uma base nitrogenada e o grupo carbonila de outra base. Essas interações são responsáveis pela complementaridade das bases no DNA, onde a adenina se liga à timina e a citosina se liga à guanina, formando a conhecida dupla hélice.
Além disso, as pontes de hidrogênio contribuem para a replicação do DNA, pois permitem que as duas fitas se separem de forma relativamente fácil durante o processo. Durante a replicação, as pontes de hidrogênio são quebradas temporariamente, permitindo que enzimas copiem e sintetizem novas fitas complementares.
Em suma, as pontes de hidrogênio desempenham um papel crucial na estrutura e na função do DNA, garantindo a estabilidade e a fidelidade da informação genética. Sem essas ligações, a replicação e a transcrição do DNA seriam comprometidas, tornando impossível a vida como a conhecemos.
Ponte de hidrogênio: principais características
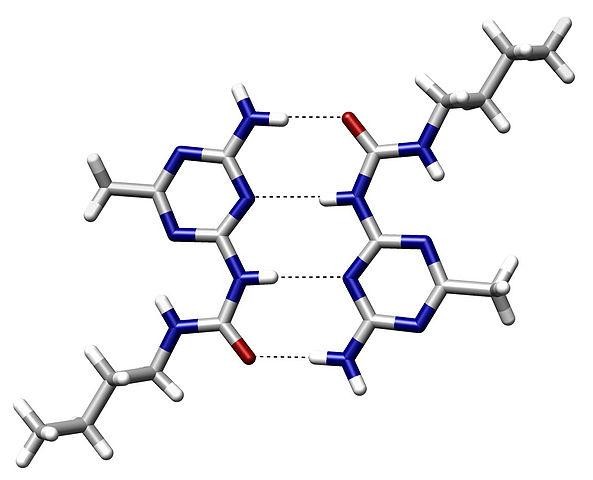
A ligação da ponte de hidrogênio é uma atração eletrostática entre dois grupos polares que ocorre quando um átomo de hidrogênio (H) ligado a um átomo altamente eletronegativo exerce uma atração no campo eletrostático de outro átomo próximo carregado eletronegativamente.
Na física e na química, existem forças que geram interação entre duas ou mais moléculas, incluindo forças de atração ou repulsão, que podem agir entre essas e outras partículas próximas (como átomos e íons). Essas forças são chamadas forças intermoleculares.
As forças intermolares são de natureza mais fraca do que aquelas que unem partes de uma molécula de dentro para fora (forças intramoleculares).
Entre as atraentes forças intermoleculares, existem quatro tipos: forças íon-dipolo, forças dipolo-dipolo, forças van der Waals e ligações de hidrogênio.
Características do link da ponte de hidrogênio
A ligação da ponte de hidrogênio ocorre entre um átomo “doador” (o eletronegativo que o hidrogênio possui) e um “receptor” (o eletronegativo sem o hidrogênio).
Geralmente gera uma energia entre 1 a 40 Kcal / mol, tornando essa atração consideravelmente mais forte do que a ocorrida na interação van der Waals, mas mais fraca que as ligações covalentes e iônicas.
Geralmente ocorre entre moléculas com átomos como nitrogênio (N), oxigênio (O) ou flúor (F), embora também seja observado com átomos de carbono (C) quando eles estão ligados a átomos altamente eletronegativos, como no caso do clorofórmio ( CHCl 3 ).
Por que a união ocorre?
Essa união ocorre porque, sendo ligado a um átomo altamente eletronegativo, o hidrogênio (um átomo pequeno com uma carga tipicamente neutra) adquire uma carga parcialmente positiva, fazendo com que comece a atrair outros átomos eletronegativos para si.
A partir daqui, surge uma união que, embora não possa ser classificada como totalmente covalente, liga o hidrogênio e seu átomo eletronegativo a esse outro átomo.
As primeiras evidências da existência desses elos foram observadas em um estudo que mediu os pontos de ebulição. Observou-se que nem todos aumentaram de acordo com o peso molecular, conforme o esperado, mas que havia certos compostos que exigiam uma temperatura de ebulição mais alta do que o previsto.
A partir daqui, a existência de ligações de hidrogênio nas moléculas eletronegativas começou a ser observada.
Comprimento do link
A característica mais importante a ser medida em uma ligação de hidrogênio é seu comprimento (mais longo, menos forte), medido em angstrom (Å).
Por sua vez, esse comprimento depende da resistência da união, temperatura e pressão. A seguir, descreve como esses fatores influenciam a força de uma ligação de ponte de hidrogênio.
Força de ligação
A resistência da ligação depende da pressão, temperatura, ângulo de conexão e ambiente (que é caracterizado por uma constante dielétrica local).
Por exemplo, para moléculas de geometria linear, a união é mais fraca porque o hidrogênio está mais distante de um átomo do que de outro, mas em ângulos mais fechados essa força cresce.
Temperatura
Foi estudado que as ligações de hidrogênio são propensas a se formar em temperaturas mais baixas, uma vez que a diminuição da densidade e o aumento do movimento molecular em temperaturas mais altas causam dificuldades na formação de ligações de hidrogênio.
As ligações podem ser rompidas temporariamente e / ou permanentemente com o aumento da temperatura, mas é importante notar que as ligações também fazem com que os compostos tenham maior resistência à ebulição, como é o caso da água.
Pressão
Quanto maior a pressão, maior a força da ligação de hidrogênio. Isso acontece porque, a pressões mais altas, os átomos da molécula (como no gelo) ficam mais compactados e isso ajuda a diminuir a distância entre os componentes da ligação.
De fato, esse valor é quase linear ao estudar gelo em um gráfico que mostra o comprimento do link encontrado com a pressão.
Ponte de hidrogênio na água

A molécula de água (H 2 O) é considerada um caso ideal de se ligar por ligação hidrogénio: cada molécula pode formar ligações de hidrogénio quatro potenciais moléculas de água próximas.
Existe em cada molécula a quantidade perfeita de hidrogênios com carga positiva e pares de elétrons não ligados, tornando todos capazes de se envolver na ligação de hidrogênio.
Isso é porque a água tem um ponto de ebulição mais elevado do que outras moléculas, por exemplo, amoníaco (NH 3 ) e fluoreto de hidrogénio (HF).

No primeiro caso, o átomo de nitrogênio possui apenas um par livre de elétrons, e isso significa que em um grupo de moléculas de amônia não há pares livres suficientes para atender às necessidades de todos os hidrogênios.
Diz-se que para cada molécula de amônia é formada uma única ligação de hidrogênio e que os outros átomos de H são “desperdiçados”.
No caso do fluoreto, há um déficit de hidrogênio e os pares de elétrons são “desperdiçados”. Novamente, na água há uma quantidade adequada de pares de hidrogênio e elétrons, portanto esse sistema se liga perfeitamente.
Ligação de ponte de hidrogênio no DNA e outras moléculas
No hidrogênio e nas proteínas, a ligação de hidrogênio também pode ser observada: no caso do DNA, a forma de dupla hélice é devida a ligações de hidrogênio entre seus pares de bases (os blocos que compõem a hélice), que permitem essas moléculas se replicam e existe vida como a conhecemos.
No caso das proteínas, os hidrogênios formam ligações entre hidrogênio de oxigênio e amida; Dependendo da posição em que ocorre, diferentes estruturas proteicas resultantes serão formadas.
As ligações de hidrogênio também estão presentes em polímeros naturais e sintéticos e em moléculas orgânicas que contêm nitrogênio, e outras moléculas com esse tipo de ligação ainda estão sendo estudadas no mundo da química.
Referências
- Ligação de hidrogênio (sf). Wikipedia Obtido em en.wikipedia.org
- Desiraju, GR (2005). Instituto Indiano de Ciência, Bangalore. Obtido em ipc.iisc.ernet.in
- Mishchuk, NA e Goncharuk, VV (2017). Sobre a natureza das propriedades físicas da água. Khimiya e Tekhnologiya Vody.
- Química, WI (sf). O que é química? Obtido de whatischemistry.unina.it
- Chemguide (sf). ChemGuide Obtido em chemguide.co.uk