- Le proprietà della materia si dividono in generali e specifiche; le specifiche includono fisiche, chimiche, organolettiche e funzionali.
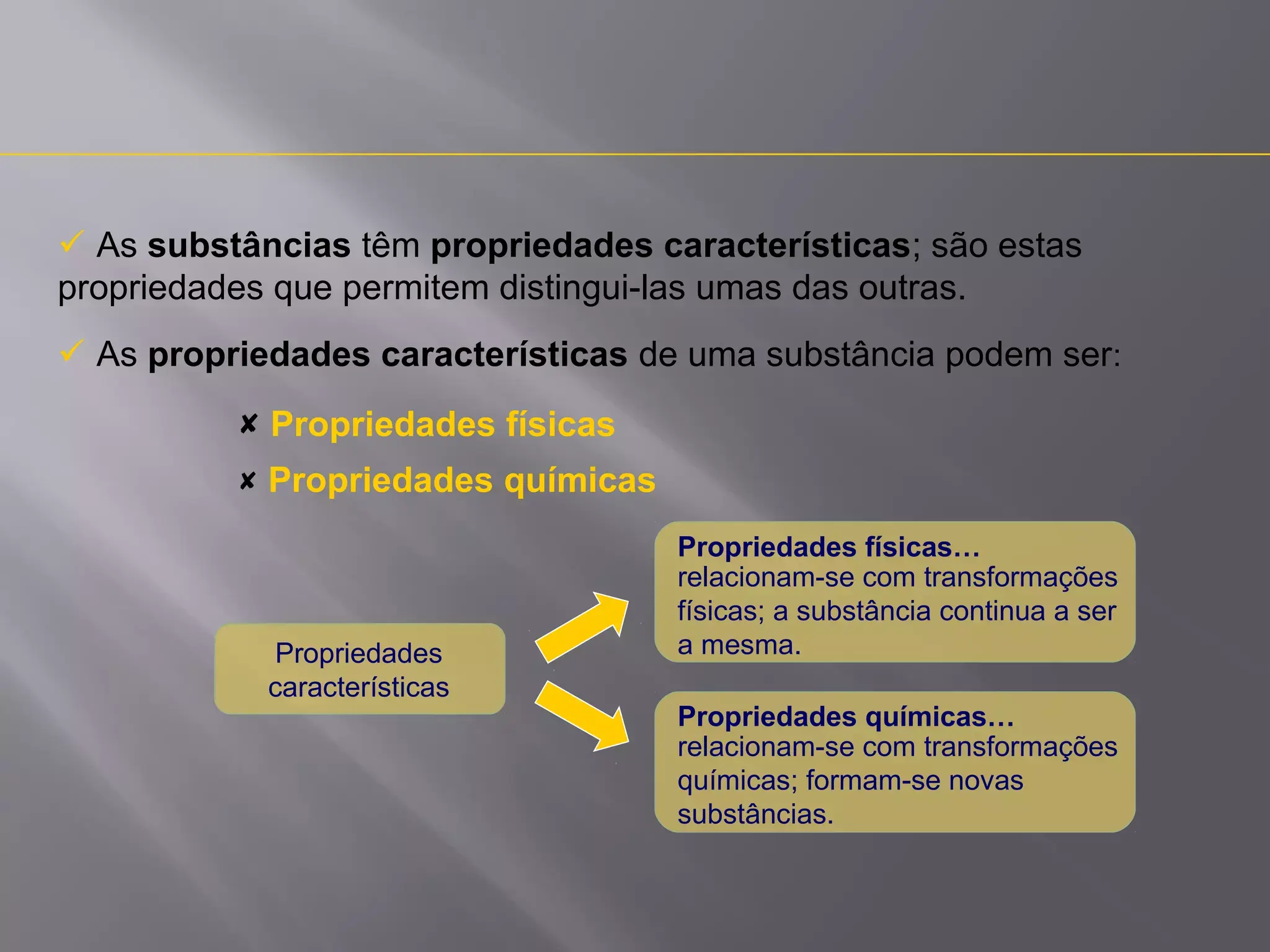
- Le proprietà fisiche non cambiano l’identità della sostanza; le chimiche emergono durante una reazione.
- Densità, punti di fusione/ebollizione e conducibilità identificano sostanze; massa e volume sono solo descrittori generali.
La materia è ovunque: negli oggetti che utilizziamo, nel cibo che mangiamo e perfino nell’aria che respiriamo; capire come riconoscerla e descriverla significa comprendere il mondo fisico che ci circonda, dalle sue trasformazioni ai suoi usi più pratici. In chimica e in fisica parliamo di proprietà per indicare quelle caratteristiche che ci permettono di identificare, classificare e prevedere il comportamento dei materiali.
Queste caratteristiche si raggruppano in più famiglie: proprietà generali (comuni a qualunque porzione di materia), proprietà specifiche (che distinguono una sostanza dall’altra) e, all’interno di queste ultime, proprietà fisiche, chimiche, organolettiche e funzionali. La loro origine affonda nella struttura della materia stessa: atomi, molecole e particelle subatomiche interagiscono dando luogo a fenomeni misurabili, dalle temperature di transizione di fase alla reattività.
Proprietà della materia: visione d’insieme
Quando diciamo “proprietà della materia” ci riferiamo a un insieme di tratti che definiscono un corpo materiale e lo rendono distinguibile dagli altri. Per orientarsi è utile separarle in due grandi categorie: proprietà generali (massa, volume, estensione, ecc.) e proprietà specifiche, che a loro volta si dividono in fisiche, chimiche, organolettiche e funzionali. Le proprietà generali non identificano una sostanza perché appartengono a qualsiasi materia; le specifiche invece sì, poiché dipendono dalla composizione chimica e dalla struttura.
È altrettanto importante ricordare che la materia può presentarsi in stato solido, liquido o gassoso, e passare da uno stato all’altro in funzione di temperatura e pressione. Le proprietà, soprattutto le fisiche come i punti di fusione ed ebollizione, registrano queste transizioni senza cambiare l’identità chimica della sostanza coinvolta.
Alcune caratteristiche (ad esempio la percezione di colore o lucentezza) hanno una componente soggettiva o dipendente dalle condizioni di osservazione; in questi casi si parla spesso di proprietà organolettiche, perché legate ai nostri sensi e al contesto di misura. Ciò non toglie che, per molte altre proprietà, esistano valori ben definiti e riproducibili in laboratorio.
Un’ultima distinzione guida l’analisi: le proprietà fisiche si osservano senza trasformare chimicamente la sostanza, mentre le proprietà chimiche si manifestano durante una reazione (combustione, corrosione, ossidazione, fermentazione, ecc.). Questa separazione è fondamentale tanto nello studio teorico quanto nelle applicazioni industriali e quotidiane.
Proprietà generali della materia
Le proprietà generali sono comuni a ogni corpo materiale e, proprio per questo, non permettono da sole l’identificazione univoca di una sostanza. Servono però come base per descrivere qualunque porzione di materia in modo coerente e misurabile.
- Massa: quantità di materia contenuta in un corpo; nel SI si misura in chilogrammi (kg) o grammi (g). La massa è una grandezza scalare e non cambia con la posizione del corpo, a differenza del peso che dipende dal campo gravitazionale.
- Volume: spazio occupato dalla materia; nel SI si esprime in metri cubi (m³), ma sono comuni anche litro (L) e centimetro cubo (cm³). Volume ed estensione sono concetti correlati quando si descrive la porzione di spazio occupata da un corpo.
- Estensione: capacità di occupare un luogo nello spazio; in pratica, è la proprietà per cui la materia non è puntiforme e si distribuisce in tre dimensioni.
- Inerzia: tendenza di un corpo a conservare il proprio stato di quiete o di moto rettilineo uniforme finché una forza esterna non agisce su di esso; aumenta con la massa, ed è facile da percepire in frenate brusche.
- Impenetrabilità: due corpi non possono occupare lo stesso spazio nello stesso istante. Immergendo un oggetto in acqua, il livello del liquido sale perché avviene uno spostamento di volume.
- Divisibilità: possibilità di suddividere la materia in parti più piccole; oggi sappiamo che la materia è composta da molecole, atomi e particelle subatomiche, con spazi vuoti tra gli elementi costitutivi.
- Compressibilità: riduzione del volume sotto l’azione di una pressione esterna; i gas sono i più comprimibili, come dimostra l’aria contenuta in un cilindro o in un pneumatico.
- Elasticità: capacità di un corpo di recuperare forma e volume originari dopo la rimozione della forza deformante; una molla è l’esempio più immediato.
- Indistruttibilità: la materia non si crea né si distrugge, ma si trasforma (legge di Lavoisier). Nella combustione del metano, ad esempio, gli atomi si riarrangiano in CO₂ e H₂O, conservando la massa totale.
- Discontinuità: la materia è costituita da particelle discrete e non è un continuum; tra molecole e atomi esistono intervalli a scala microscopica non osservabili a occhio nudo.
Queste proprietà, pur essendo condivise da qualsiasi materiale, aiutano a misurare e descrivere i sistemi, diventando il linguaggio comune con cui fisici e chimici comunicano dati e risultati.
Proprietà fisiche: definizioni, misure ed esempi
Le proprietà fisiche si osservano o si misurano senza alterare la natura chimica della sostanza. Sono intrinseche alle sostanze pure e, combinate tra loro, contribuiscono a identificarle con precisione in laboratorio e in applicazioni pratiche.
- Punto di fusione: temperatura alla quale una sostanza passa da solido a liquido. È un valore caratteristico e non dipende dalla massa del campione (per sostanze pure).
- Punto di ebollizione: temperatura alla quale una sostanza passa da liquido a gas; anche qui parliamo di temperatura caratteristica a una data pressione.
- Densità: massa per unità di volume, spesso espressa come ρ = m/V; più formalmente si scrive
ρ = m/V. Varia con temperatura e pressione, soprattutto nei gas. - Solubilità: quantità massima di soluto che può sciogliersi in un solvente a una certa temperatura; dipende dalla natura chimica delle specie coinvolte e dalle condizioni.
- Conducibilità elettrica: misura di quanto facilmente scorre la corrente attraverso un materiale; i metalli sono buoni conduttori, vetro e gomma sono isolanti, i semiconduttori occupano una via di mezzo.
- Conduttività termica: capacità di trasmettere calore; metalli come il rame conducono molto, mentre i materiali isolanti ostacolano il flusso termico.
- Malleabilità: attitudine a essere ridotti in lamine sottili senza rompersi; oro e alluminio sono esempi classici.
- Duttilità: capacità di allungarsi in fili senza fratturarsi; molti metalli sono duttili e si lasciano trafilare.
- Magnetismo: tendenza ad attrarre o respingere magneti o materiali ferromagnetici; il ferro è un riferimento noto.
- Durezza: resistenza alla deformazione permanente o al graffio; il diamante è estremamente duro, materiali teneri si rigano facilmente.
- Viscosità: resistenza di un fluido allo scorrimento; miele e oli sono più viscosi dell’acqua, rallentando il flusso.
- Aspetto (colore, trasparenza, texture): tratti osservabili che descrivono l’aspetto visivo; attenzione però alla componente percettiva che può variare tra osservatori e condizioni.
- Resistenza meccanica (snervamento, resistenza ultima, modulo di Young): misura di quanto un materiale sopporta sforzi senza rompersi; fondamentale in ingegneria per la scelta dei materiali strutturali.
Per apprezzare come queste proprietà permettano l’identificazione, consideriamo il ferro: punto di fusione ≈ 1535 °C, ebollizione ≈ 2862 °C, densità ≈ 7,874 g/cm³, conduttore elettrico, malleabile, duttile, magnetico e con durezza intermedia. La combinazione di valori crea un profilo fisico univoco utile in analisi e progettazione.
Proprietà chimiche: comportamento e trasformazioni
Le proprietà chimiche emergono quando la sostanza partecipa a una reazione, cambiando identità. Non si limitano a “come appare” il materiale, ma a come si comporta in presenza di altre sostanze o specifiche condizioni.
- pH: misura dell’acidità di una soluzione; valori minori di 7 indicano acidità, maggiori di 7 basicità, 7 è neutro.
- Infiammabilità/combustibilità: tendenza ad avviare e sostenere la combustione emettendo calore e spesso luce; etanolo e benzina sono esempi di sostanze infiammabili.
- Stato/i di ossidazione: grado di ossidazione preferito dall’elemento nei composti; influenza reattività e tipi di legame.
- Potere ossidante e corrosività: capacità di provocare ossidazione (rimozione di elettroni) su altre specie e tendenza a corrodersi o a corrodere altri materiali (tipico dei metalli in ambienti umidi e ossigenati).
- Stabilità chimica: resistenza a reagire o decomporsi; sostanze stabili non reagiscono facilmente senza stimoli esterni.
- Alcalinità: capacità di neutralizzare acidi; è un indicatore operativo importante nel trattamento acque.
- Potere calorifico/calor di combustione: energia rilasciata nella combustione completa con ossigeno; guida la scelta dei combustibili.
- Reattività: propensione a reagire con altre sostanze; il sodio, ad esempio, reagisce vivacemente con l’acqua.
- Potenziale di ionizzazione: energia necessaria a rimuovere un elettrone da un atomo; correlato alla reattività soprattutto negli elementi.
- Esplosibilità: capacità di liberare rapidamente energia con formazione di gas e onde di pressione; dipende da struttura e condizioni.
- Effervescenza: liberazione di gas in soluzione per reazione chimica, come accade con acidi e carbonati.
- Fermentazione: trasformazione biochimica di materia organica con produzione di energia e composti tipici; fondamentale in alimenti e bevande.
Un paio di confronti utili: il ferro non è infiammabile né esplosivo, ma tende a ossidarsi (arrugginire) in presenza di ossigeno e umidità; l’etanolo è infiammabile ed esplosivo in certe miscele aria-vapore, ma non subisce corrosione come un metallo. Queste differenze mostrano come le proprietà chimiche siano specifiche della sostanza e del contesto.
Proprietà organolettiche: ciò che i sensi percepiscono
Le proprietà organolettiche sono quelle che catturiamo con vista, olfatto, tatto, gusto e udito; sono preziose nell’analisi sensoriale di alimenti, materiali e prodotti, ma possono essere soggette a variabilità individuale, come nei profili sensoriali del fungo shiitake.
- Colore: dipende dall’interazione tra luce e materia (assorbimento/riflessione); impurezze o trattamenti possono alterarlo (es. oro con tonalità diverse).
- Odore: percezione dovuta a composti volatili; l’aroma di vanillina caratterizza la vaniglia, odori sgradevoli possono indicare deterioramento.
- Sapore: dolce, salato, amaro, acido e umami sono sensazioni base; interazioni tra componenti modulano l’esperienza gustativa.
- Texture: percezione tattile di superfici (liscio, ruvido, morbido, rigido); vetro liscio e rigido versus tessuti morbidi e ruvidi.
- Suono: vibrazioni udibili tra ~20 Hz e 20 kHz; il timbro diverso di vetro e metallo colpiti suggerisce differenze strutturali.
- Brillantezza/lucentezza: capacità di riflettere la luce; i metalli brillano spesso più dei materiali come il legno, che appare opaco.
Pur non essendo sempre misure “assolute”, queste proprietà aiutano a formare un primo profilo sensoriale della sostanza, utile come screening prima di indagini più strumentali.
Proprietà funzionali: acidi, basi, sali e ossidi
Nella didattica della chimica, molte sostanze si raggruppano in “funzioni” sulla base di comportamenti ricorrenti; questo consente di prevedere reazioni ed effetti senza conoscere nel dettaglio ogni composto.
- Acidi: in soluzione acquosa tendono a ionizzarsi liberando ioni H⁺; virano la cartina al tornasole al rosso e spesso hanno sapore aspro (es. acido acetico nel vinegar).
- Basi: in acqua liberano ioni OH⁻; possono dare sensazione scivolosa al tatto e neutralizzano gli acidi (es. idrossido di sodio nei detergenti).
- Sali: composti ionici formati da cationi (diversi da H⁺) e anioni (diversi da OH⁻); il cloruro di sodio è un esempio molto comune.
- Ossidi: un elemento combinato con ossigeno; tra gli ossidi, la CO₂ svolge un ruolo cruciale in processi naturali come la fotosintesi.
Queste etichette funzionali sono strumenti pratici: sapendo che una sostanza è acida o basica, anticipiamo indicatori di pH, reazioni e impieghi (anticalcare, fertilizzanti, neutralizzazioni, ecc.).
Perché le proprietà contano: applicazioni e impatto
Nella vita quotidiana, conoscere le proprietà della materia aiuta a scegliere materiali e prodotti in modo più consapevole: la densità spiega perché un oggetto galleggia o affonda, la resistenza termica decide se un utensile è adatto al forno, la durezza suggerisce se un piano si righerà facilmente.
Nell’industria, le proprietà guidano sviluppo dei prodotti e ottimizzazione dei processi: malleabilità e durezza per strutture metalliche, conducibilità elettrica per elettronica, viscosità per vernici e lubrificanti. Le proprietà chimiche orientano la sintesi di farmaci, combustibili e materiali avanzati, mentre quelle fisiche definiscono prestazioni e sicurezza.
Anche ricerca e tecnologia dipendono da queste conoscenze: studiare come i materiali reagiscono a pressione e temperatura è cruciale per stoccaggio di energia, catalisi e sostenibilità. Proprietà ben comprese portano a soluzioni più efficienti e a basso impatto ambientale.
Attività ed esperienze semplici per osservare le proprietà
Anche con mezzi semplici è possibile “toccare con mano” molte proprietà. Ecco alcune attività didattiche sicure utili a scuola e a casa:
- Usa una bilancia per pesare oggetti diversi: confronta le masse e discuti perché differiscono.
- Immergi un oggetto in un recipiente riempito a metà d’acqua: osserva l’innalzamento del livello per impenetrabilità e volume spostato.
- Schiaccia un gessetto con un cucchiaio di legno: verifichi la divisibilità e la frammentazione in parti più piccole.
- Brucia con cautela un piccolo frammento di carta (in ambiente controllato): discuti se la carta sia stata “distrutta” o trasformata in nuove sostanze (cenere, CO₂, H₂O).
- Giochi sensoriali: a occhi bendati, due persone cercano di riconoscere oggetti tramite tatto e odore, esplorando le proprietà organolettiche.
Queste prove elementari aiutano a collegare l’astrazione dei concetti a esperienze quotidiane e concrete, favorendo una comprensione più profonda.
Proprietà generali vs specifiche: differenze operative
La discriminante è chiara: le proprietà generali sono comuni a tutta la materia e non identificano una sostanza; le proprietà specifiche, invece, dipendono dalla composizione chimica e possono riconoscere un materiale o un gruppo di materiali. Per esempio, massa e volume dicono “quanto” c’è, ma non “che cos’è”; densità, punti di fusione/ebollizione e conducibilità delineano invece un profilo specifico.
Considera questa lista per una sostanza ignota: liquida a 25 °C, massa 50 g, volume 63,3 mL, incolore, con odore caratteristico, densità 0,79 g/mL, punto di fusione −112,0 °C, ebollizione 78,3 °C. Le prime tre voci (stato, massa, volume) sono generali; colore e odore sono organolettiche; densità e temperature di transizione, combinate, individuano l’etanolo con buona certezza.
Un altro classico: due campioni di naftalina, 20,0 g e 40,0 g, vengono riscaldati separatamente. La temperatura di fusione è la stessa per entrambi (proprietà caratteristica della sostanza pura), ma il campione più piccolo raggiunge prima quel valore, perché richiede meno energia per aumentare la sua temperatura fino al punto di fusione.
Infine, se devi identificare liquidi incolori sconosciuti, misurare punto di ebollizione e densità è una strategia vincente: massa e volume sono generali, ma il binomio (Teb, ρ) è diagnostico per confronti con tabelle affidabili.
Liste di riferimento: proprietà fisiche e chimiche in sintesi
Per uno sguardo rapido, riportiamo alcune definizioni chiave spesso usate come checklist di laboratorio o in schede tecniche.
- Fisiche (osservabili senza reazione): aspetto (colore/trasparenza/texture), densità e densità apparente (per polveri e aggregati), punti di fusione/ebollizione, conducibilità elettrica e termica, durezza, duttilità, malleabilità, viscosità, resistenza meccanica.
- Chimiche (emersi in reazione): calore di combustione, stabilità chimica, stati di ossidazione preferiti, capacità di corrosione, pH, alcalinità, reattività e infiammabilità, potenziale di ionizzazione, esplosibilità, effervescenza, fermentazione.
Queste liste non sono esaustive, ma rappresentano un vocabolario minimo operativo per classificare e confrontare sostanze in modo coerente tra discipline.
Guardando all’insieme, emerge come la mappa delle proprietà — generali e specifiche, fisiche e chimiche, sensoriali e funzionali — consenta di passare dalla semplice osservazione alla spiegazione e poi alla progettazione: capire la materia significa saperla scegliere, misurare e trasformare, dall’aula di scienze al laboratorio industriale, fino alle scelte di ogni giorno.