As reações de deslocamento são um tipo de reação química em que ocorre a troca de elementos entre os reagentes, formando novos compostos. Existem três tipos principais de reações de deslocamento: simples, duplas e exemplos.
Nas reações de deslocamento simples, um elemento simples substitui outro em um composto, seguindo a regra de que um elemento mais reativo desloca um menos reativo. Já nas reações de deslocamento duplas, dois elementos trocam de lugar entre si em dois compostos diferentes.
Para ilustrar, um exemplo de reação de deslocamento simples seria a reação entre o zinco e o ácido clorídrico, em que o zinco desloca o hidrogênio do ácido formando cloreto de zinco e liberando hidrogênio gasoso. Já um exemplo de reação de deslocamento dupla seria a reação entre o sulfato de cobre e o ferro, em que o ferro desloca o cobre do sulfato formando sulfato de ferro e cobre metálico.
Em resumo, as reações de deslocamento são importantes na química por possibilitarem a formação de novos compostos a partir da troca de elementos entre os reagentes.
Entenda o conceito de deslocamento simples e sua aplicação em situações práticas do cotidiano.
As reações de deslocamento são um conceito importante na química, que descreve as reações em que um ou mais átomos de uma molécula são substituídos por outro elemento ou grupo de elementos. Existem diferentes tipos de reações de deslocamento, como as simples e duplas.
O deslocamento simples ocorre quando um átomo de um elemento é substituído por outro elemento em uma molécula. Por exemplo, na reação de deslocamento do ferro com o cobre, o cobre substitui o ferro na molécula, formando um novo composto. Essa reação é representada pela equação química: Fe + CuSO4 -> Cu + FeSO4.
As reações de deslocamento simples têm diversas aplicações práticas no cotidiano. Um exemplo comum é a galvanização, em que uma camada de zinco é aplicada em objetos de ferro para protegê-los da corrosão. Nesse processo, ocorre uma reação de deslocamento simples entre o zinco e o ferro, formando uma camada de zinco sobre o objeto.
Outro exemplo de deslocamento simples é a reação entre o ácido clorídrico e o zinco, que produz gás hidrogênio. Essa reação é utilizada em laboratórios e em indústrias para a produção de hidrogênio.
Em resumo, as reações de deslocamento simples são reações químicas em que um átomo de um elemento é substituído por outro elemento em uma molécula. Essas reações têm diversas aplicações práticas no cotidiano, como na galvanização e na produção de hidrogênio.
Exemplos de 4 tipos de reações químicas: conheça os diferentes processos de transformação de substâncias.
As reações químicas são processos nos quais as substâncias sofrem transformações, resultando em novos compostos. Existem diversos tipos de reações químicas, cada uma com características específicas. Neste artigo, vamos abordar os diferentes processos de transformação de substâncias, com foco nas reações de deslocamento.
As reações de deslocamento ocorrem quando um elemento simples substitui outro em um composto, formando um novo composto. Existem dois tipos principais de reações de deslocamento: simples e duplas.
Na reação de deslocamento simples, um elemento simples substitui outro em um composto. Por exemplo, o zinco pode substituir o hidrogênio em ácido clorídrico, formando cloreto de zinco e liberando hidrogênio gasoso.
Já na reação de deslocamento dupla, dois elementos simples trocam de lugar em dois compostos diferentes. Um exemplo é a reação entre cloreto de sódio e nitrato de prata, que resulta em cloreto de prata e nitrato de sódio.
Outros exemplos de reações de deslocamento incluem a reação entre ácido sulfúrico e zinco, formando sulfato de zinco e liberando gás hidrogênio, e a reação entre cobre e ácido nítrico, resultando em nitrato de cobre e dióxido de nitrogênio.
Em resumo, as reações de deslocamento são importantes processos químicos nos quais elementos simples substituem outros em compostos, resultando em novos produtos. Essas reações são fundamentais para a compreensão da química e têm diversas aplicações práticas em diferentes áreas.
Exemplos de reações de simples troca: o que são e como ocorrem.
As reações de simples troca, também conhecidas como reações de deslocamento simples, são reações químicas em que um elemento simples troca de lugar com um elemento composto em uma substância. Essas reações ocorrem quando um elemento mais reativo substitui outro elemento menos reativo em um composto, formando um novo composto e liberando o elemento menos reativo.
Um exemplo clássico de reação de simples troca é a reação entre o metal zinco (Zn) e o ácido clorídrico (HCl) para formar cloreto de zinco (ZnCl2) e hidrogênio (H2). Neste caso, o zinco é mais reativo que o hidrogênio, então ele substitui o hidrogênio no ácido clorídrico, resultando na formação de cloreto de zinco e hidrogênio gasoso.
Outro exemplo comum é a reação entre o metal ferro (Fe) e o ácido sulfúrico (H2SO4) para formar sulfato de ferro (Fe2(SO4)3) e hidrogênio gasoso. Nessa reação, o ferro substitui o hidrogênio no ácido sulfúrico, resultando na formação de sulfato de ferro e hidrogênio liberado.
Em resumo, as reações de simples troca ocorrem quando um elemento mais reativo substitui outro menos reativo em um composto, formando um novo composto e liberando o elemento menos reativo. Essas reações são fundamentais na química e têm diversas aplicações em processos industriais e cotidianos.
Entenda as reações de dupla troca e suas características principais de forma simplificada.
As reações de dupla troca são reações químicas em que dois compostos trocam de lugar entre si, formando dois novos compostos. Essas reações são caracterizadas pela formação de dois produtos diferentes a partir de dois reagentes iniciais.
Um exemplo simples de reação de dupla troca é a reação entre o cloreto de sódio (NaCl) e o nitrato de prata (AgNO3), que resulta na formação de cloreto de prata (AgCl) e nitrato de sódio (NaNO3).
Características principais das reações de dupla troca incluem a formação de dois produtos, a troca de íons entre os compostos e a ocorrência de precipitação, quando um dos produtos formados é insolúvel e precipita da solução.
Em resumo, as reações de dupla troca são reações químicas em que dois compostos trocam de lugar entre si, formando dois novos compostos. Essas reações são importantes na química e têm diversas aplicações em diferentes áreas.
Reações de deslocamento: simples, duplas e exemplos
As reacções de deslocamento são todos aqueles em que uma espécie química viaja para outro dentro de um composto. Esse deslocamento pode ser simples ou duplo, diferindo em que no primeiro é um elemento que se move, enquanto no segundo há uma troca de “pares” entre dois compostos.
Esses tipos de reações são possíveis apenas sob certas condições: uma das espécies deve ter um número de oxidação igual a zero ou todas precisam necessariamente ser ionizadas. O que significa um número de oxidação zero? Isso significa que a espécie está em seu estado natural.

Um exemplo muito ilustrativo da abordagem acima é a reação entre um fio de cobre e uma solução de nitrato de prata. Como o cobre é um metal em seu estado natural, seu número de oxidação é zero; por outro lado, a prata é +1 (Ag + ), que se dissolve ao lado dos íons nitrato (NO 3 – ).
Os metais desistem de elétrons, mas alguns são mais ativos que outros; Isso significa que nem todos os metais se oxidam com tanta facilidade. Como o cobre é mais ativo que a prata, ele doa seus elétrons, reduzindo-o ao seu estado natural, refletido como uma superfície de prata que cobre o fio de cobre (imagem acima).
Reações de deslocamento
Simples
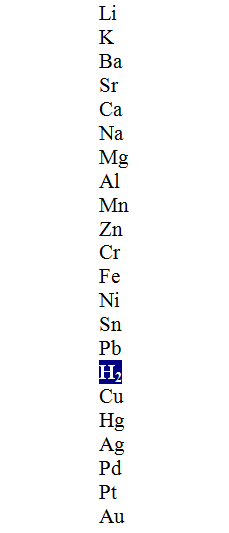
Deslocamento de hidrogênio e metais
A imagem acima mostra uma coluna em ordem decrescente de atividade, destacando a molécula de hidrogênio. Esses metais que estão acima deste pode mover-se em não – ácidos oxidante (HCl, HF, H 2 SO 4 , etc), e aqueles que são abaixo irá não reagem de todo.
A reação de deslocamento simples pode ser descrita pela seguinte equação geral:
A + BC => AB + C
A desloca-se para C, que pode ser a molécula de H 2 ou outro metal. Se H 2 é formado por redução dos iões de H + (2H + + 2e – => H 2 ), em seguida, a espécie A-obrigatória para a conservação de massa e energia devem proporcionar os electrões para oxidar.
Por outro lado, se A e C são espécies metálicas, mas C está na forma iônica (M + ) e A em seu estado natural, a reação de deslocamento ocorrerá apenas se A for mais ativo que C, forçando o último aceitar os elétrons para reduzir ao seu estado metálico (M).
Mudança de halogênio
Da mesma maneira, os halogênios (F, Cl, Br, I, At) podem se mover entre si, mas seguindo outra série de atividades. Para estes, a atividade diminui à medida que desce através do grupo 7A (ou 17): I <Br <Cl <F. Isso significa que o flúor é capaz de substituir qualquer um dos outros halogênios, mas não acontece o mesmo com o iodo.
Por exemplo, a seguinte reação ocorre naturalmente:
F 2 (g) + 2NaI (ac) => 2NaF (ac) + I 2 (s)
No entanto, este não produz nenhum produto pelos motivos expostos:
I 2 (s) + NaF (ac) => X
Na equação anterior, X significa que não há reação.
Com esse conhecimento, pode-se prever qual mistura de sais de halogênio com elementos puros origina produtos. Como regra mnemônica, o iodo (sólido volátil púrpura) não substitui nenhum dos outros halogênios, mas os outros o substituem quando está na forma iônica (Na + I – ).
Duplo
A reação de duplo deslocamento, também conhecida como reação de metátese, é representada da seguinte forma:
AB + CD => AD + CB
Desta vez, não apenas A desloca C, mas também B desloca D. Esse tipo de deslocamento ocorre somente quando soluções de sais solúveis são misturadas e um precipitado é formado; isto é, AD ou CB deve ser insolúvel e ter fortes interações eletrostáticas.
Por exemplo, ao misturar soluções de KBr e AgNO 3 , os quatro íons se movem pelo meio para formar os pares correspondentes da equação:
KBr (ac) + AgNO 3 (ac) => AgBr (s) + KNO 3 (ac)
Os íons Ag + e Br – formam o precipitado do brometo de prata, enquanto K + e NO 3 – não podem ser ordenados para dar origem a um cristal de nitrato de potássio.
Reação de neutralização ácido-base
Quando um ácido é neutralizado com uma base, ocorre uma reação de duplo deslocamento:
HCl (aq) + NaOH (aq) => NaCl (aq) + H 2 O (l)
Nenhum precipitado é formado aqui, uma vez que o cloreto de sódio é um sal muito solúvel em água, mas ocorre uma alteração no pH, que é ajustada para um valor próximo a 7.
No entanto, na reação a seguir, uma alteração no pH e a formação de um precipitado ocorrem simultaneamente:
H 3 PO 4 (ac) + 3Ca (OH) 2 => Ca 3 (PO 4 ) 2 (s) + 3H 2 O (l)
O fosfato de cálcio é insolúvel, precipitando como um sólido branco, enquanto o ácido fosfórico é neutralizado com hidróxido de cálcio.
Exemplos
Simples
Cu (s) + 2AgNO 3 (ac) => Cu (NO 3 ) 2 (ac) + 2Ag (s)
Esta é a reação da imagem do fio de cobre. Se a série de atividades químicas dos metais for observada, será constatado que o cobre está acima da prata, para que possa substituí-lo.
Zn (s) + CuSO 4 (aq) => ZnSO 4 (aq) + Cu (s)
Com esta outra reacção o inverso é verdadeiro agora azul solução de CuSO 4 torna-se transparente como o cobre precipita sob a forma de metal, enquanto que o metal zinco desintegra no sal solúvel de sulfato de zinco.
2Al (s) + 3NiBr 2 (ac) => 2AlBr 3 (ac) + 3Ni (s)
Novamente, essa reação ocorre porque o alumínio está acima do níquel na série de atividades químicas.
Sn (s) + H 2 SO 4 (aq) => SnSO 4 (aq) + H 2 (g)
Aqui o estanho substitui o hidrogênio, embora esteja muito próximo disso na série.
2K (s) + 2H 2 O (l) => 2KOH (aq) + H 2 (g)
Finalmente, os metais que estão na parte mais alta da série são tão reativos que deslocam até o hidrogênio das moléculas de água, gerando uma reação muito exotérmica (e explosiva).
Duplo
Zn (NO 3 ) 2 (ac) + 2NaOH (ac) => Zn (OH) 2 (s) + 2NaNO 3 (ac)
Embora a base é não neutralizar qualquer ácido, os iões OH – são mais afinidade para o Zn 2+ iões NO 3 – ; por esse motivo, ocorre deslocamento duplo.
Cu (NO 3 ) 2 (ac) + Na 2 S (ac) => CuS (s) + 2NaNO 3 (ac)
Essa reação é muito semelhante à anterior, com a diferença de que ambos os compostos são sais dissolvidos em água.
Referências
- Whitten, Davis, Peck e Stanley. Química (8a ed.). Aprendizagem CENGAGE, p 145-150.
- Toby Hudson (3 de abril de 2012). Precipitação de prata em cobre. [Figura]. Retirado de: commons.wikimedia.org
- Helmenstine, Anne Marie, Ph.D. (3 de maio de 2018). O que é uma reação de deslocamento em química? Retirado de: thoughtco.com
- amrita.olabs.edu.in,. (2011). Reação de deslocamento único. Retirado de: amrita.olabs.edu.in
- Byju’s (15 de setembro de 2017). Reações de deslocamento. Retirado de: byjus.com
- Tipos de reações químicas: reações de deslocamento simples e duplo. Retirado de: jsmith.cis.byuh.edu