O salicilato de metila é um composto orgânico que apresenta a fórmula química C8H8O3 e é conhecido por suas propriedades analgésicas e anti-inflamatórias. Sua estrutura química é semelhante à do ácido salicílico, porém, conta com um grupo metila adicionado à sua molécula. O salicilato de metila é utilizado na fabricação de pomadas e cremes para alívio de dores musculares e articulares, assim como em produtos de aromaterapia e cosméticos. Sua síntese pode ser realizada a partir da reação entre o ácido salicílico e o metanol, com a presença de ácido sulfúrico como catalisador. É importante ressaltar que o salicilato de metila deve ser utilizado com cautela, pois pode provocar irritações na pele em concentrações elevadas.
Entenda o processo de síntese do Salicilato de Metila em detalhes e passo a passo.
O Salicilato de Metila é um composto orgânico com uma estrutura química representada por C8H8O3. Ele possui propriedades analgésicas e anti-inflamatórias, sendo amplamente utilizado na indústria farmacêutica e cosmética.
Para sintetizar o Salicilato de Metila, é necessário seguir um processo químico que envolve algumas etapas específicas. A síntese mais comum é a reação do ácido salicílico com metanol na presença de um ácido forte, como o ácido sulfúrico.
O primeiro passo da síntese é a adição do ácido salicílico em um balão de fundo redondo, seguido da adição do metanol e do ácido sulfúrico. A mistura é então aquecida sob refluxo por algumas horas.
Durante o processo de aquecimento, ocorre a esterificação do ácido salicílico com o metanol, resultando na formação do Salicilato de Metila. Após a reação completa, a mistura é resfriada e neutralizada com água, formando um precipitado que é o produto desejado.
O Salicilato de Metila sintetizado pode ser purificado por recristalização em solventes apropriados, garantindo a obtenção de um produto final de alta pureza. Este composto é amplamente utilizado na indústria farmacêutica para a produção de medicamentos analgésicos e anti-inflamatórios.
Em resumo, a síntese do Salicilato de Metila envolve a reação do ácido salicílico com metanol na presença de um ácido forte, seguida de aquecimento, resfriamento, neutralização e purificação. Este processo resulta na obtenção de um composto com importantes propriedades terapêuticas e diversas aplicações industriais.
Para que serve o Salicilato de Metila?
O Salicilato de Metila é um composto orgânico que possui a fórmula química C8H8O3 e é derivado do ácido salicílico. É um líquido incolor ou levemente amarelado com um odor característico de menta. O Salicilato de Metila é amplamente utilizado na indústria farmacêutica e cosmética devido às suas propriedades analgésicas, anti-inflamatórias e rubefacientes.
Na sua forma pura, o Salicilato de Metila é um líquido viscoso e volátil que pode ser facilmente absorvido pela pele. Ele atua como um agente analgésico, aliviando dores musculares e articulares. Além disso, suas propriedades anti-inflamatórias ajudam a reduzir a inflamação e o inchaço em áreas afetadas.
Além disso, o Salicilato de Metila é utilizado em produtos para alívio de dores musculares, como pomadas, géis e cremes. Também é comum encontrar esse composto em produtos para alívio de dores de cabeça, enxaquecas e resfriados.
A síntese do Salicilato de Metila geralmente envolve a reação do ácido salicílico com o metanol na presença de um ácido forte como o ácido sulfúrico. Esse processo resulta na formação do Salicilato de Metila juntamente com água como subproduto.
Em resumo, o Salicilato de Metila é um composto amplamente utilizado devido às suas propriedades analgésicas, anti-inflamatórias e rubefacientes. É encontrado em diversos produtos para alívio de dores musculares, dores de cabeça e resfriados, proporcionando alívio rápido e eficaz para esses sintomas.
Principais indicações terapêuticas dos salicilatos: descubra quais são essas três importantes recomendações.
Os salicilatos são compostos químicos que possuem diversas propriedades terapêuticas, sendo amplamente utilizados na medicina. Entre as principais indicações terapêuticas dos salicilatos, destacam-se três importantes recomendações.
Em primeiro lugar, os salicilatos são amplamente utilizados como analgésicos. Eles possuem a capacidade de aliviar a dor e reduzir a inflamação, sendo indicados para o tratamento de dores de cabeça, dores musculares e articulares, entre outras condições dolorosas.
Além disso, os salicilatos também são recomendados como antipiréticos. Eles ajudam a reduzir a febre, atuando no centro termorregulador do cérebro e promovendo a diminuição da temperatura corporal em casos de febre alta.
Por fim, os salicilatos são utilizados como anti-inflamatórios. Eles ajudam a reduzir a inflamação em diversas condições, como artrite reumatoide, osteoartrite e outras doenças inflamatórias, contribuindo para o alívio dos sintomas e melhora da qualidade de vida dos pacientes.
Em resumo, os salicilatos são medicamentos versáteis que possuem diversas indicações terapêuticas, sendo amplamente utilizados como analgésicos, antipiréticos e anti-inflamatórios. Seu uso deve ser sempre orientado por um profissional de saúde, respeitando as doses e recomendações específicas para cada caso.
Natureza química dos salicilatos: o que é e como atuam no organismo?
Os salicilatos são compostos orgânicos que possuem em sua estrutura o grupo funcional ácido salicílico. Este grupo confere aos salicilatos propriedades anti-inflamatórias, analgésicas e antipiréticas. Um exemplo de salicilato é o salicilato de metila, que é derivado do ácido salicílico e possui um grupo metila ligado à sua estrutura.
No organismo, os salicilatos atuam inibindo a produção de prostaglandinas, que são substâncias responsáveis pela inflamação, dor e febre. Dessa forma, os salicilatos são utilizados no tratamento de diversas condições, como dores musculares, febre, artrite e inflamações em geral.
O salicilato de metila, por exemplo, é amplamente utilizado em formulações tópicas, como pomadas e cremes, devido às suas propriedades analgésicas e anti-inflamatórias. Além disso, o salicilato de metila também possui um aroma característico de menta, o que o torna popular em produtos para alívio de dores musculares e articulares.
A síntese do salicilato de metila pode ser realizada a partir da reação do ácido salicílico com metanol na presença de um ácido forte como o ácido sulfúrico. Esta reação gera o salicilato de metila e água como produtos.
Em resumo, os salicilatos, como o salicilato de metila, são compostos com propriedades anti-inflamatórias, analgésicas e antipiréticas, atuando no organismo inibindo a produção de prostaglandinas. Sua síntese pode ser realizada a partir do ácido salicílico e metanol, sendo amplamente utilizado em produtos para o alívio de dores e inflamações.
Salicilato de metila: estrutura, propriedades, usos e síntese
O salicilato de metilo é uma substância química, uma natureza orgânica, considerado o composto mais tóxico conhecido entre os salicilatos, apesar da sua aparência incolor e odor agradável com um ligeiro toque doce. Esta espécie é mais conhecida pelo nome óleo de gaulteria.
Está em estado líquido sob condições padrão de temperatura e pressão (25 ° C e 1 atm), constituindo um éster orgânico que se origina naturalmente de uma grande variedade de plantas. A partir da observação e estudo de sua produção na natureza, foi possível proceder à síntese do salicilato de metila.

Essa síntese foi realizada por meio de uma reação química entre o éster do ácido salicílico e sua combinação com o metanol. Dessa forma, esse composto faz parte de sálvia, vinho branco e frutas como ameixa e maçã, entre outras encontradas naturalmente.
Sinteticamente, o salicilato de metila é usado na produção de agentes aromatizantes, bem como em certos alimentos e bebidas.
Estrutura quimica
A estrutura química do salicilato de metila consiste em dois grupos funcionais principais (um éster e um fenol ligado a ele), conforme mostrado na imagem acima.
Observa-se que é constituído por um anel benzeno (que representa uma influência direta na reatividade e estabilidade do composto), a partir do ácido salicílico do qual é derivado.
Para nomeá-los separadamente, pode-se dizer que um grupo hidroxil e um éster metílico estão ligados na posição orto (1,2) ao anel acima mencionado.
Assim, como o grupo OH é ligado ao anel de benzeno, um fenol é formado, mas o grupo que tem a mais alta “hierarquia” nesta molécula é o éster, dando a esse composto uma estrutura específica e, portanto, características bastante específicas.
Assim, seu nome químico é apresentado como 2-hidroxibenzoato de metila, concedido pelo IUPAC, embora seja menos utilizado quando se refere a este composto.
Propriedades
– É uma espécie química que pertence ao grupo dos salicilatos, que são produtos de origem natural do metabolismo de alguns organismos vegetais.
– Existe conhecimento das propriedades terapêuticas dos salicilatos em tratamentos médicos.
– Este composto está presente em certas bebidas, como vinho branco, chá, sálvia e certas frutas, como mamão ou cereja.
– É encontrado naturalmente nas folhas de um grande número de plantas, especialmente em certas famílias.
– Pertence ao grupo de ésteres orgânicos que podem ser sintetizados em laboratório.
– É obtido no estado líquido, cuja densidade é de aproximadamente 1.174 g / ml em condições padrão de pressão e temperatura (1 atm e 25 ° C).
– Forma uma fase líquida incolor, amarelada ou avermelhada, considerada solúvel em água (que é um solvente inorgânico) e em outros solventes orgânicos.
– Seu ponto de ebulição é de aproximadamente 222 ° C, manifestando sua decomposição térmica em torno de 340 a 350 ° C.
– Apresenta múltiplas aplicações, desde agentes aromatizantes na indústria de doces até analgésicos e outros produtos na indústria farmacêutica.
– Sua fórmula molecular é representada como C 8 H 8 O 3 e tem uma massa molar de 152,15 g / mol.
Usos
Devido às suas características estruturais, por ser um éster metílico do ácido salicílico, o salicilato de metila tem muitos usos em diferentes áreas.
Um dos principais usos (e os mais conhecidos) dessa substância é o de aromatizante em diferentes produtos: da indústria cosmética como fragrância à indústria alimentícia como aromatizante em balas (goma de mascar, balas, sorvetes, entre outros).
Também é usado na indústria cosmética como agente de aquecimento e para massagens musculares em aplicações esportivas. No último caso, ele atua como um paciente rubefaciente; isto é, causa o avermelhamento superficial da pele e das membranas de natureza mucosa ao entrar em contato com elas.
Da mesma forma, é usado em creme para uso tópico, por suas propriedades analgésicas e anti-inflamatórias em tratamentos para condições reumáticas.
Outra de suas aplicações inclui o uso de líquidos em sessões de aromaterapia, devido às características do óleo essencial.
Além de seu uso como agente de proteção contra a radiação ultravioleta em filtros solares, suas propriedades contra a luz são investigadas para aplicações tecnológicas, como a produção de lasers ou a criação de espécies sensíveis para armazenar informações nas moléculas.
Síntese
Em primeiro lugar, deve-se mencionar que o salicilato de metila pode ser obtido naturalmente a partir da destilação dos ramos de certas plantas, como as da gaulteria ( Gaultheria procumbens ) ou da bétula doce ( Betula slow ).
Esta substância foi extraída e isolada pela primeira vez em 1843, graças ao cientista de origem francesa chamado Auguste Cahours; Atualmente, a partir das gaulterias, é obtida por síntese em laboratórios e até comercialmente.
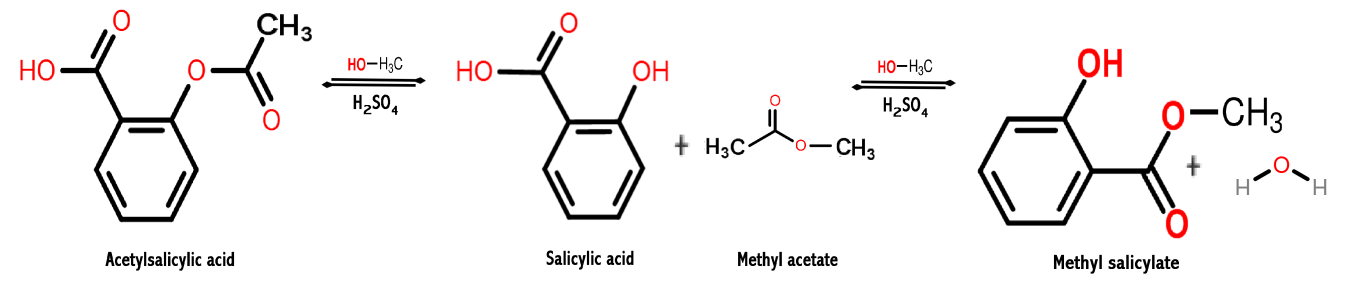
A reação que ocorre para obter esse composto químico é um processo chamado esterificação, no qual um éster é obtido pela reação entre um álcool e um ácido carboxílico . Nesse caso, ocorre entre o metanol e o ácido salicílico, como mostrado abaixo:
CH 3 OH + C 7 H 6 S 3 → C 8 H 8 O 3 + H 2 O
Deve-se notar que a parte da molécula de ácido salicílico que é esterificada com o grupo hidroxil (OH) do álcool é o grupo carboxil (COOH).
Então, o que acontece entre essas duas espécies químicas é uma reação de condensação, porque a molécula de água presente entre os reagentes é removida enquanto as outras espécies reagentes são condensadas para obter salicilato de metila.
A imagem a seguir mostra a síntese de salicilato de metila a partir de ácido salicílico, onde são mostradas duas reações sucessivas.
Referências
- Wikipedia (sf). Salicilato de metila Recuperado de en.wikipedia.org
- Britannica, E. (sf). Salicilato de metila Obtido em britannica.com
- Conselho da Europa Comitê de Peritos em Produtos Cosméticos. (2008). Ingredientes ativos usados em cosméticos: pesquisa de segurança. Recuperado de books.google.co.ve
- Dasgupta, A. e Wahed, A. (2013). Química Clínica, Imunologia e Controle de Qualidade Laboratorial. Obtido em books.google.co.ve
- PubChem (sf) Salicilato de metilo. Recuperado de pubchem.ncbi.nlm.nih.gov