O sulfato de potássio (K2SO4) é um composto químico formado por íons de potássio e sulfato. É amplamente utilizado na agricultura como fertilizante, devido à sua alta solubilidade em água e sua capacidade de fornecer potássio e enxofre para as plantas. Além disso, o sulfato de potássio também é utilizado na indústria de alimentos, na produção de vidro, na fabricação de papel e em diversos processos industriais.
Apesar de ser um composto relativamente seguro, o sulfato de potássio pode representar riscos para a saúde e o meio ambiente se não for manuseado corretamente. Em altas concentrações, pode causar irritações na pele, olhos e vias respiratórias. Por isso, é importante seguir as orientações de segurança ao lidar com esse composto.
Em resumo, o sulfato de potássio é um composto químico com diversas propriedades e usos, sendo fundamental para a agricultura e diversas indústrias. No entanto, é importante estar ciente dos potenciais riscos associados ao seu manuseio e utilização.
Para que serve o sulfato de potássio (K2SO4) na agricultura e jardinagem?
O sulfato de potássio (K2SO4) é um fertilizante amplamente utilizado na agricultura e jardinagem devido às suas propriedades benéficas para as plantas. Ele fornece potássio essencial para o desenvolvimento saudável das plantas, ajudando na formação de frutos e flores, além de aumentar a resistência a doenças e estresses ambientais.
Além disso, o sulfato de potássio também contribui para a melhoria da qualidade dos frutos, aumentando o teor de açúcares e nutrientes essenciais. Ele é especialmente recomendado para culturas que necessitam de uma quantidade significativa de potássio, como tomate, batata, pimentão e morango.
Na jardinagem, o sulfato de potássio é utilizado para promover o crescimento saudável das plantas ornamentais, flores e árvores frutíferas. Ele ajuda a manter o equilíbrio de nutrientes no solo, garantindo que as plantas recebam a quantidade adequada de potássio para se desenvolverem de forma vigorosa e bonita.
Portanto, o sulfato de potássio desempenha um papel fundamental na nutrição das plantas, contribuindo para o aumento da produtividade agrícola e para a beleza dos jardins. É importante utilizá-lo de forma adequada, seguindo as recomendações de dosagem e aplicação, para evitar possíveis riscos de excesso de nutrientes no solo.
Benefícios e usos do sulfato de potássio na agricultura e jardinagem.
O sulfato de potássio (K2SO4) é um fertilizante amplamente utilizado na agricultura e jardinagem devido aos seus inúmeros benefícios. Este composto químico fornece potássio, um dos nutrientes essenciais para o crescimento saudável das plantas. Além disso, o sulfato de potássio também ajuda a melhorar a resistência das plantas a doenças e estresses ambientais, como secas e geadas.
Uma das principais vantagens do uso de sulfato de potássio é a sua capacidade de aumentar a qualidade e o sabor dos frutos e vegetais. As plantas que recebem uma quantidade adequada de potássio tendem a produzir colheitas mais abundantes e com maior teor de açúcares, resultando em produtos finais mais saborosos e nutritivos.
Além disso, o sulfato de potássio é facilmente solúvel em água, o que facilita a sua aplicação no solo ou nas folhas das plantas. Este fertilizante pode ser utilizado em diversos tipos de culturas, desde hortaliças e frutas até gramados e plantas ornamentais.
No entanto, é importante ter cuidado ao manusear o sulfato de potássio, pois ele pode ser irritante para a pele e os olhos. Sempre utilize equipamento de proteção adequado ao lidar com este produto e siga as instruções de segurança recomendadas pelo fabricante.
Em resumo, o sulfato de potássio é um fertilizante versátil e eficaz que pode trazer inúmeros benefícios para a agricultura e jardinagem. Se utilizado corretamente, este composto químico pode ajudar a melhorar o crescimento, a resistência e a qualidade das plantas, resultando em colheitas mais saudáveis e saborosas.
Tutorial prático para a correta aplicação do sulfato de potássio na agricultura.
O sulfato de potássio (K2SO4) é um fertilizante rico em potássio, um nutriente essencial para o desenvolvimento das plantas. Sua correta aplicação na agricultura pode garantir uma maior produtividade e qualidade das culturas. Neste tutorial, vamos explicar passo a passo como utilizar o sulfato de potássio de forma eficiente.
Passo 1: Antes de aplicar o sulfato de potássio, é importante realizar uma análise do solo para verificar a quantidade de potássio disponível e a dose necessária para corrigir possíveis deficiências.
Passo 2: Escolha o momento adequado para a aplicação do sulfato de potássio, de preferência durante o período de maior demanda das plantas por potássio, como no início da fase de crescimento.
Passo 3: Calcule a quantidade de sulfato de potássio a ser aplicada com base na dose recomendada para a cultura e na análise do solo. Utilize equipamentos adequados para a distribuição do fertilizante de forma uniforme.
Passo 4: Aplique o sulfato de potássio de maneira uniforme sobre a área de cultivo, evitando concentrações excessivas que possam causar queimaduras nas plantas.
Passo 5: Após a aplicação, faça uma irrigação para promover a dissolução do sulfato de potássio e sua absorção pelas plantas. A quantidade de água necessária dependerá das condições climáticas e do tipo de solo.
Seguindo esses passos, você poderá garantir uma correta aplicação do sulfato de potássio na agricultura, contribuindo para o desenvolvimento saudável das plantas e o aumento da produtividade das culturas.
Diferenças entre cloreto de potássio e sulfato de potássio: o que você precisa saber.
O sulfato de potássio (K2SO4) e o cloreto de potássio (KCl) são dois compostos químicos de potássio com diferentes propriedades e usos. Enquanto o cloreto de potássio é mais comumente usado como fertilizante e suplemento mineral, o sulfato de potássio é conhecido por suas propriedades específicas e benefícios para as plantas.
Uma das principais diferenças entre os dois compostos é a forma como o potássio é apresentado. Enquanto o cloreto de potássio fornece apenas potássio e cloro, o sulfato de potássio fornece potássio e enxofre, o que pode ser benéfico para algumas culturas.
Além disso, o sulfato de potássio é conhecido por sua baixa toxicidade em comparação com o cloreto de potássio, o que o torna uma opção mais segura para uso em culturas sensíveis ou em solos salinos.
Em relação aos usos, o sulfato de potássio é amplamente utilizado como fertilizante em culturas que necessitam de potássio e enxofre, como batata, tomate e pimentão. Já o cloreto de potássio é mais utilizado em culturas que toleram o excesso de cloro, como milho e cana-de-açúcar.
Em resumo, é importante conhecer as diferenças entre o cloreto de potássio e o sulfato de potássio para escolher o melhor composto para suas plantações e garantir uma nutrição adequada para as plantas.
Sulfato de potássio (K2SO4): propriedades, riscos e usos
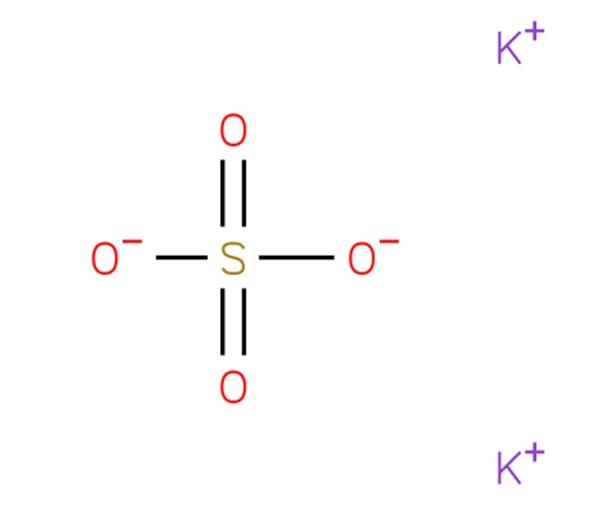
O sulfato de potássio , também conhecido como Arcanite, é um composto químico com a fórmula K 2 SO 4 . Sua estrutura aparece na Figura 1 (EMBL-EBI, 2014).
Este composto é conhecido desde o início do século XIV e foi estudado por Glauber , Boyle e Tachenius. No século XVII, era chamado arcanuni ou sal duplicado, pois era uma combinação de um sal ácido com um sal alcalino.
Também era conhecido como tártaro vitriólico e sal Glaseri ou sal Glaseri polychrestum, depois que o químico farmacêutico Christopher Glaser o preparou e o usou medicinalmente.
O potássio é um elemento relativamente abundante na crosta terrestre e a produção de fertilizantes com potássio ocorre em cada continente habitado. No entanto, o K 2 SO 4 raramente é encontrado de forma pura na natureza. Em vez disso, ele se mistura naturalmente com sais que contêm magnésio, sódio e cloreto.
Esses minerais requerem processamento adicional para separar seus componentes. Historicamente, foi preparado K 2 SO 4 por reacção de KCl com ácido sulfúrico . No entanto, mais tarde, os pesquisadores descobriram que podiam manipular uma série de minerais da terra para produzir K 2 SO 4 , o método de produção mais comum atualmente.
Minerais naturais contendo K (como cainita e escenite) são cuidadosamente extraídos e lavados com água e soluções salinas para remover subprodutos e produzir K 2 SO 4 . A indústria de mineração usa um processo semelhante para colher K 2 SO 4 do Great Salt Lake, em Utah, e depósitos minerais subterrâneos.
No Novo México, K 2 SO 4 é separado a partir dos minerais langbeinite por reacção com solução de KCl que remove os subprodutos (tais como Mg) e deixe K 2 SO 4 . Técnicas de processamento semelhantes são usadas em muitas partes do mundo, dependendo de matérias-primas acessíveis (The Mosaic Company, 2016).
O composto também é obtido pela reação do cloreto de potássio com ácido sulfúrico ou dióxido de enxofre, água e oxigênio (processo de hargreaves) (US National Library of Medicine, 2002).
Propriedades físicas e químicas do sulfato de potássio
O sulfato de potássio é um conjunto de cristais ortorrômbicos brancos, sem aroma característico e sabor salino ligeiramente amargo (National Center for Biotechnology Information., 2017). Sua aparência é mostrada na figura 2.

Seu peso molecular é de 174.259 g / mol e sua densidade é de 2.662 g / ml. Tem um ponto de fusão de 1069 ° C e um ponto de ebulição de 1689 ° C. O composto é muito solúvel em água e 120 gramas deste composto podem ser dissolvidos por litro de água. Também é levemente solúvel em glicerol e insolúvel em álcool e cetonas.
ácido de potássio (também conhecido como bissulfato de potássio), sulfato de KHSO 4 , é produzido facilmente por reacção de K 2 SO 4 com ácido sulfúrico. Forma pirâmides rômbicas, que derretem a 197 ° C. Dissolve-se em três partes de água a 0 ° C.
A solução se comporta como se seus dois congêneres, K 2 SO 4 e H 2 SO 4 , estivessem presentes lado a lado sem combinar. Um excesso de etanol precipita sulfato normal (com pouco bissulfato) com um excesso de ácido restante.
O comportamento do sal seco derretido é semelhante quando aquecido a várias centenas de graus. Atua sobre silicatos, titanatos, etc., da mesma forma que o ácido sulfúrico que aquece além do seu ponto de ebulição natural.
Portanto, é freqüentemente usado em química analítica como agente desintegrador.Em altas temperaturas, é reduzido ao sulfeto de potássio pela ação do monóxido de carbono.
Reatividade e perigos
O sulfato de potássio é classificado como estável, podendo causar irritação gastrointestinal grave se ingerido em grandes doses. A substância é tóxica para os pulmões e membranas mucosas. A exposição repetida ou prolongada à substância pode causar danos a esses órgãos.
Se o composto entrar em contato com os olhos, as lentes de contato devem ser verificadas e removidas. Os olhos devem ser lavados imediatamente com água em abundância por pelo menos 15 minutos com água fria.
Contato com a pele
Em caso de contato com a pele, a área afetada deve ser lavada imediatamente com bastante água por pelo menos 15 minutos, enquanto remove roupas e sapatos contaminados. Cubra a pele irritada com um emoliente.
Lave roupas e sapatos antes de reutilizá-los. Se o contato for intenso, lave com sabão desinfetante e cubra a pele contaminada com um creme antibacteriano.
Inalação
Em caso de inalação, a vítima deve ser levada para um local fresco. Se você não respirar, administre respiração artificial. Se a respiração estiver difícil, forneça oxigênio.
Ingestão
Se o composto for ingerido, o vômito não deve ser induzido, a menos que seja orientado por pessoal médico. Afrouxe roupas apertadas, como colarinho da camisa, cinto ou gravata.
Em todos os casos, deve-se obter atenção médica imediata (Folha de dados de segurança do material Sulfato de potássio, 2013).
Usos
O sulfato de potássio é usado principalmente na agricultura como fertilizante. Também é essencial para a produção de alume.
1- Agricultura

O potássio é necessário para completar muitas funções essenciais nas plantas, como a ativação de reações enzimáticas, a síntese de proteínas, a formação de amido e açúcares e a regulação do fluxo de água nas células e folhas.
Freqüentemente, as concentrações de K no solo são muito baixas para apoiar o crescimento saudável das plantas.
O sulfato de potássio é uma excelente fonte de nutrição de potássio para as plantas. A porção de potássio do K 2 SO 4 não difere de outros fertilizantes comuns à potassa.
No entanto, também fornece uma fonte valiosa de enxofre, necessária para a síntese de proteínas e a função enzimática. Como o potássio, o enxofre também pode ter um déficit para o crescimento adequado das plantas.
O sulfato de potássio é apenas um terço tão solúvel quanto o cloreto de potássio (KCl); portanto, não é tão comumente dissolvido para adição por água de irrigação, a menos que haja uma necessidade adicional de enxofre (Fertilizer Brokerage, 2016 )
No entanto, um dos benefícios do sulfato de potássio é que ele não é um produto fertilizante de pH extremamente alto.
O cloreto de potássio, por outro lado, é um pouco mais alto em pH e tem a tendência, quando usado ao longo do tempo, de aumentar o pH e pode ser enganoso para as pessoas que apenas olham para esse componente e depois não colocam cálcio ou Calcário para controlá-lo.
O sulfato de potássio, devido ao sulfato, não aumentará o pH do solo. É mais um pH neutro, por isso é um produto muito mais alto apenas devido ao aspecto do pH.
Muitos solos, especialmente pequenos pomares, não precisam disso. Mas muitas das operações agrícolas em larga escala encontram necessidade de sulfato de potássio (International Plant Nutrition Institute, SF).
A taxa de sal parcial de K 2 SO 4 é menor do que em alguns outros fertilizantes K comum, de modo que menos de salinidade total é adicionado por unidade de K. A medição de sal (CE) de uma solução de K 2 SO 4 é menos de um terço de uma concentração semelhante de uma solução de KCl (10 milimoles por litro).
Quando são necessárias altas taxas de K 2 SO 4 , os agrônomos geralmente recomendam a aplicação do produto em várias doses. Isso ajuda a evitar o acúmulo de excesso de K pela planta e também minimiza qualquer dano potencial ao sal.
2- Produção de alúmen
A solução de sulfato de alumínio e a solução de sulfato de potássio são misturadas para cristalizar e obter uma nova classe de sal denominada sulfato de alumínio e potássio K 2 SO 4 · Al 2 (SO 4 ) 3 · 24H 2 O. Esse sal complexo É comumente referido como alume.
Do ponto de vista da composição, é formada pelo aducto de dois sais simples, não é uma mistura simples dos dois sais, mas o composto da mesma estrutura cristalina. A diferença entre o sal complexo e o complexo é que, no estado sólido ou solução, o sal complexo possui íons simples, sem íons complexos.
Os alúmenes têm muitos usos, mas foram parcialmente suplantados pelo próprio sulfato de alumínio, que é facilmente obtido pelo tratamento de minério de bauxita com ácido sulfúrico. Os usos comerciais dos alúmenes provêm principalmente da hidrólise dos íons alumínio, o que resulta na precipitação do hidróxido de alumínio.
Este produto químico tem vários usos industriais. O papel é dimensionado, por exemplo, depositando hidróxido de alumínio nos interstícios das fibras de celulose. O hidróxido de alumínio adsorve as partículas em suspensão da água e, portanto, é um agente floculante útil em instalações de purificação de água.
Quando usado como mordente (ligante) no tingimento, o corante é fixado ao algodão e outros tecidos, tornando-o insolúvel. Alums também são usados em decapagem, fermento em pó, extintores e como adstringente na medicina (Britannica, 2007).
Referências
- Britannica, TE (12 de abril de 2007). Obtido em britannica: britannica.com.
- EMBL-EBI. (28 de julho de 2014). sulfato de potássio . Obtido em ebi.ac.uk: ebi.ac.uk.
- Fertilizante de Corretagem (2016). Sulfato de potássio . Obtido em fertilizerbrokerage: fertilizerbrokerage.com.
- Instituto Internacional de Nutrição Vegetal. (SF). Sulfato de potássio Obtido em ipni.net: ipni.net.
- Folha de dados de segurança do material Sulfato de potássio. (21 de Maio de 2013). Obtido no sciencelab: sciencelab.com.
- Centro Nacional de Informação Biotecnológica. . (25 de março de 2017). Banco de Dados Composto PubChem; CID = 24507 . Obtido no PubChem: pubchem.ncbi.nlm.nih.gov.
- A empresa do mosaico. (2016). Sulfato de potássio . Obtido em cropnutrition: cropnutrition.com.
- S. Biblioteca Nacional de Medicina. (8 de novembro de 2002). SULFATO DE POTÁSSIO . Obtido do toxnet: toxnet.nlm.nih.gov.