- Differenze chiave: fisico mantiene la composizione, chimico genera nuove sostanze con rottura/formazione di legami.
- Indizi pratici: colore, gas, solidi, odori e luce segnalano reazioni; passaggi di stato sono trasformazioni fisiche.
- Energia coinvolta: fusioni/vaporizzazioni/sublimazioni endotermiche; solidificazioni/condensazioni/deposizioni esotermiche.
- Classificazione: sostanze con proprietà costanti; miscele omogenee (soluzioni) e eterogenee per numero di fasi.
Le sostanze intorno a noi cambiano in continuazione: alcune modifiche riguardano solo l’aspetto, altre generano nuovi materiali. Capire quando una trasformazione è fisica e quando invece è chimica è la chiave per leggere fenomeni quotidiani come l’ebollizione dell’acqua, la ruggine sul ferro o la combustione della carta.
In breve, ma senza sbrigarsela troppo: una trasformazione fisica modifica forma, stato o dimensioni senza cambiare l’identità della sostanza, mentre una trasformazione chimica produce sostanze nuove attraverso reazioni in cui i legami si rompono e si riformano. Nelle righe che seguono trovi le differenze essenziali, gli indizi pratici per riconoscerle, esempi commentati e i concetti base su materia, proprietà, stati fisici, miscele e soluzioni.
Trasformazioni fisiche
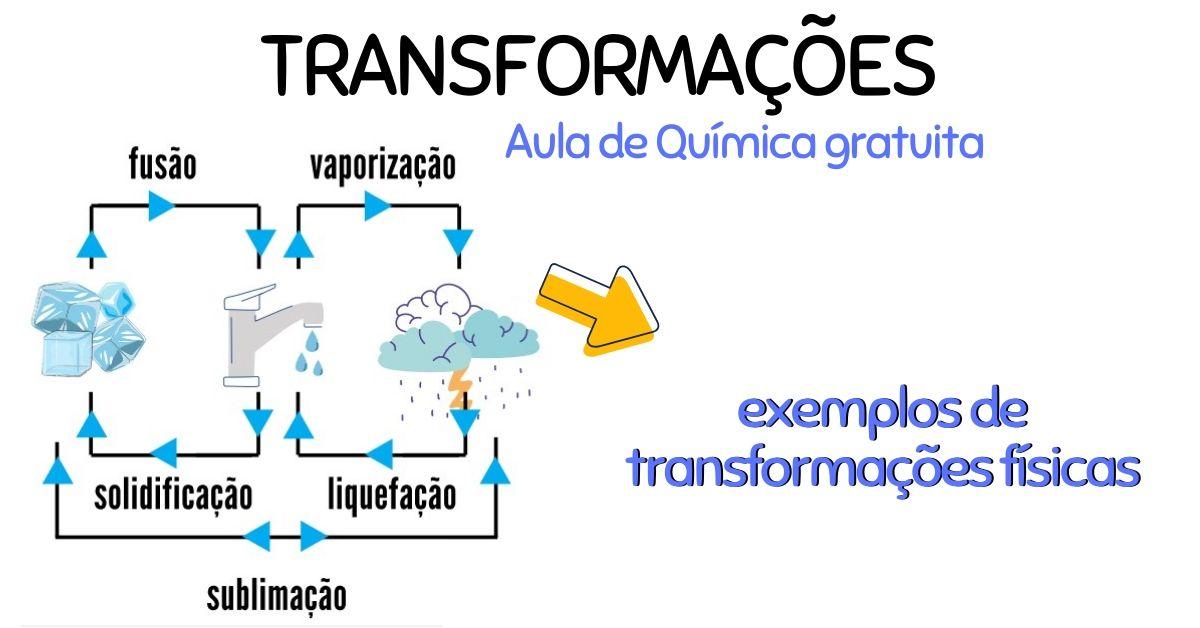
Nelle trasformazioni fisiche la composizione chimica resta invariata: cambiano solo grandezza, forma o stato di aggregazione. A livello microscopico, atomi, ioni o molecole possono riorganizzarsi o agitarsi di più o di meno, ma non si trasformano in altre specie.
Un modo molto efficace per osservare trasformazioni fisiche è guardare i passaggi di stato. Solido, liquido e gassoso si differenziano per la libertà di movimento delle particelle e per quanto stanno “strette” tra loro.
- Solido: particelle in posizioni quasi fisse; volume e forma ben definiti.
- Liquido: particelle più libere; volume proprio ma forma del recipiente.
- Gassoso: particelle rapidissime e in tutte le direzioni; forma e volume variabili, riempiono lo spazio disponibile.
L’acqua è il caso-scuola. Scaldandola vaporizza, raffreddandola solidifica, a temperatura ambiente torna liquida. In ognuno di questi passaggi le molecole d’acqua H2O sono sempre le stesse: cambia solo come sono disposte nello spazio.
Un dettaglio spesso trascurato: molti fenomeni fisici sono reversibili (dal ghiaccio si torna ad acqua), ma non tutti lo sono sul piano pratico. Se strappi un foglio, la carta rimane carta (quindi è fisico), ma non puoi ricomporre il foglio identico in modo semplice.
Trasformazioni chimiche
Quando i reagenti si convertono in prodotti diversi, sei davanti a una reazione chimica. Nelle trasformazioni chimiche si rompono e si formano legami; gli atomi coinvolti restano gli stessi, ma vengono riarrangiati in nuove strutture.
Come riconoscerle a colpo d’occhio? Indizi frequenti sono: cambiamento di colore, sviluppo di gas (bollicine), formazione di un solido (precipitato), comparsa di luce o fiamma, odori nuovi. Attenzione: alcune reazioni sono meno “spettacolari” e si riconoscono solo misurando variazioni di proprietà fisico-chimiche. Per altri esempi concreti, vedi 30 esempi di cambiamenti chimici.
Un esempio forte: il sodio metallico reagisce violentemente con l’acqua generando idrossido di sodio (NaOH) e gas idrogeno (H2). Qui i prodotti non hanno più le proprietà di partenza e la trasformazione è inequivocabilmente chimica.
Miscela o reazione chimica?
Mescolare non significa per forza reagire. Ferro e zolfo, miscelati “a freddo”, danno una miscela con colore diverso, ma il ferro resta separabile con un magnete grazie al suo magnetismo. Qui nulla è nato di nuovo: è un fenomeno fisico.
Se però ferro e zolfo (in proporzioni 7 g e 4 g) vengono scaldati, si ottiene una sostanza nera, il solfuro di ferro(II) (FeS): il ferro non è più recuperabile col magnete perché si è trasformato chimicamente. Morale: miscela = fenomeno fisico; reazione = fenomeno chimico.
Fenomeni fisici e chimici nel quotidiano
Zucchero in acqua: le molecole di saccarosio si disperdono nel solvente, ma non perdono identità. Il sistema è omogeneo, la dolcezza si distribuisce uniformemente, la trasformazione rimane fisica.
Sale in acqua: il cloruro di sodio (NaCl), composto ionico solubile, si dissocia in Na+ e Cl−, e gli ioni vengono solvatati dai poli dell’acqua (il polo negativo orientato verso Na+, quello positivo verso Cl−). In molti contesti didattici questa dissociazione viene trattata come fenomeno chimico perché implica la rottura del reticolo ionico e la formazione di interazioni ione-solvente.
Trasformazione della materia ed energia in gioco
Quando cambia lo stato fisico, la materia assorbe o libera energia sotto forma di calore. La quantità scambiata si chiama calore latente o di trasformazione. A seconda del verso dello scambio, le trasformazioni si dividono in endotermiche ed esotermiche.
Trasformazioni endotermiche (assorbono calore)
- Fusione: da solido a liquido.
- Vaporizzazione: da liquido a gas (evaporazione, ebollizione, o evaporazione forzata).
- Sublimazione: da solido a gas senza passare dal liquido.
In questi casi l’energia serve a indebolire o rompere le interazioni tra particelle, permettendo loro di allontanarsi.
Trasformazioni esotermiche (liberano calore)
- Solidificazione: da liquido a solido.
- Condensazione o liquefazione: da gas a liquido.
- Deposizione (o “ressublimazione”): da gas a solido.
Qui le particelle si riavvicinano e il sistema dissipa l’energia in eccesso verso l’ambiente. Alcuni autori distinguono la sublimazione endotermica dalla deposizione esotermica proprio per evitare ambiguità terminologiche.
Esempi concreti: l’acqua che bolle (vaporizzazione), i metalli fusi per essere colati e formare oggetti (fusione), i panni che asciugano al sole (evaporazione), il ghiaccio secco che “scompare” in aria (sublimazione), le piogge generate dalla condensazione del vapore nel ciclo dell’acqua.
Combustioni, energia e stabilità
Le combustioni sono reazioni esotermiche classiche: liberano molta più energia di quanta ne serva per innescarle. Per esempio, accendere un foglio di carta richiede un apporto iniziale di energia (fiamma), ma poi la reazione procede liberando calore e luce. Il “fuoco” è proprio l’emissione simultanea di calore e radiazione luminosa che accompagna certe trasformazioni chimiche.
Dopo una combustione completa, le ceneri e i gas prodotti risultano spesso più stabili della sostanza di partenza: per questo le combustioni sono usate dall’uomo per ottenere energia utile (benzina, etanolo, carbone) e compiere lavoro meccanico nei motori.
Che cos’è la materia
Materia è tutto ciò che ha massa e occupa spazio (volume). Si presenta di norma come solido, liquido o gas, e le differenze tra questi stati dipendono dal grado di aggregazione e dalla mobilità delle particelle costituenti.
A livello costitutivo, atomi e molecole si organizzano tramite forze intra- e intermolecolari. Quando un materiale è formato da un solo tipo di specie con proprietà definite e costanti, parliamo di sostanza; se invece contiene due o più sostanze in proporzioni variabili, abbiamo una miscela.
Materie organiche e inorganiche
Una distinzione utile: organico indica composti con atomi di carbonio legati covalentemente ad altri carboni e ad altri elementi (H, O, N, ecc.). Non tutto ciò che contiene carbonio è organico: per esempio i carbonati (CO32−) sono inorganici.
Curiosità storica significativa: nel 1828 Friedrich Wöhler sintetizzò l’urea (CH4N2O) in laboratorio a partire da un composto inorganico (cianato d’ammonio), confutando l’idea che i composti organici potessero nascere solo da esseri viventi. Da allora moltissime molecole organiche sono state sintetizzate artificialmente.
Proprietà della materia
Ogni materiale si riconosce da un insieme di proprietà. Le proprietà generali sono comuni a tutte le materie, mentre le proprietà specifiche variano da sostanza a sostanza.
Proprietà generali
- Massa: quantità di materia in una data porzione (SI: chilogrammo).
- Volume: spazio occupato (SI: m³; 1 m³ = 1000 L).
- Impenetrabilità: due porzioni non occupano lo stesso spazio contemporaneamente.
- Divisibilità: si può suddividere senza cambiarne la natura finché non interviene una trasformazione chimica.
- Discontinuità: esistono spazi vuoti tra particelle.
- Comprimibilità: il volume può diminuire sotto forze esterne (evidente nei gas).
- Elasticità: rimozione di una forza elastica riporta (entro certi limiti) alla forma originale.
- Indistruttibilità: la materia si trasforma, ma non si crea né si distrugge (Lavoisier).
- Inerzia: tendenza a mantenere stato di quiete o moto rettilineo uniforme finché non agisce una forza (prima legge di Newton).
Tra le proprietà specifiche spiccano: punto di fusione ed ebollizione, densità, solubilità, durezza, malleabilità, duttilità, tenacità e le organolettiche (colore, odore, sapore, sensazioni tattili, suoni associati a fenomeni).
Un richiamo utile: densità come rapporto tra massa e volume (d = m/V) è una proprietà intensiva (indipendente dalla quantità), a differenza di massa e volume che sono estensivi. In condizioni standard, l’acqua ha densità 1 g/cm³ a 4 °C e 1 atm.
Altre proprietà intensivi: temperatura, colore, solubilità, punti di fusione/ebollizione e potenziale di ossido-riduzione; estensive: massa, volume e variazione di entalpia (ΔH). Non esistono due sostanze con tutte le proprietà perfettamente identiche.
Stati fisici: classici e oltre
Nel quotidiano lavoriamo soprattutto con i tre stati classici (solido, liquido, gas). La differenza sta nel moto e nella vicinanza delle particelle. In contesti avanzati si considerano anche plasma e condensato di Bose–Einstein, ampliando l’elenco a cinque stati fisici.
Ricorda: passare da uno stato all’altro non cambia l’identità chimica della sostanza (fenomeno fisico), ma implica sempre scambi energetici con l’ambiente.
Materia ed energia
Materia ed energia sono due facce della stessa medaglia: E = m c² sintetizza la proporzionalità tra le due grandezze. Le forze di legame sono energia “immagazzinata” nella struttura, e variazioni di fase o di composizione comportano scambi di energia. In termini ampi, l’energia fa esistere, muovere, cambiare fase e trasformare la materia.
Sostanze, miscele e fasi: come classificare i materiali
Se un materiale presenta proprietà definite e costanti (nelle stesse condizioni di temperatura e pressione), lo chiamiamo sostanza. Esempi: acqua distillata, etanolo, anidride carbonica, ferro, mercurio, ossigeno.
Quando invece le proprietà variano anche a T e P costanti, il materiale è una miscela. Esempi: granito (mica, quarzo, feldspato in proporzioni variabili), petrolio (molti idrocarburi: metano, etano, etene, propano, butano, ecc.), legno (cellulosa, lignina, acqua, acido acetico e altro), acciaio (~98,5% Fe e ~1,5% C in massa), aria (circa 78% N2, 20% O2, 1% Ar; CO2, vapore acqueo e altre tracce ~1% in volume).
Un criterio pratico potente è quello delle fasi. Una fase è una porzione con aspetto uniforme anche al microscopio molto spinto e proprietà specifiche costanti in tutta l’estensione.
Sistemi omogenei (monofase): una sola fase. Esempi: una sostanza pura in un singolo stato (acqua liquida, ferro solido, ammoniaca gassosa) o una miscela completamente uniforme (alcol etilico in acqua = alcol idrato; miscela O2–N2; oro 18 carati: 75% Au, 12,5% Ag, 12,5% Cu).
Sistemi eterogenei (bifase, trifase, …): due o più fasi distinguibili. La materia può presentarsi come dispersone grossolane o colloidali. Dal punto di vista pratico, nelle miscele si distinguono un disperdente (componente in maggiore quantità) e uno o più dispersi (in minore quantità).
Soluzioni: miscele omogenee in pratica
Le soluzioni sono miscele omogenee formate da un solvente (componente principale) e uno o più soluti (minoritari). Non mostrano separazione neppure con strumenti spinti e non si scindono con semplici processi meccanici come ultracentrifugazione o ultrafiltrazione. Possono essere solide, liquide o gassose.
Quando invece si osservano più fasi o disomogeneità (anche a livello molto fine), il sistema è eterogeneo e richiede approcci differenti per descrizione e separazione.
Esercizi risolti: mettiamoci alla prova
Q1 (APMBB/2023). Analizza queste situazioni di cambiamento di stato: 1) vestiti che si asciugano al sole; 2) oro che fonde in una fonderia; 3) cubetto di ghiaccio secco che “svanisce” senza residuo liquido; 4) bicchiere d’acqua lasciato 24 ore nel freezer; 5) goccioline sulla parete esterna di un bicchiere pieno di ghiaccio. La sequenza corretta è: 1) vaporizzazione, 2) fusione, 3) sublimazione, 4) solidificazione, 5) liquefazione/condensazione. Risposta: B.
Perché? Asciugatura = evaporazione; fusione dell’oro = passaggio solido→liquido; ghiaccio secco = sublimazione; freezer = solidificazione dell’acqua; condensa sul bicchiere = vapori che tornano liquidi a contatto con superfici fredde.
Q2 (UFV/2022). Rilevato vapore d’acqua nell’atmosfera di Ganimede (luna di Giove) dovuto al fatto che il ghiaccio passa direttamente da solido a gas. Qual è la trasformazione e in quali condizioni energetiche avviene? Sublimazione con assorbimento di calore. Risposta: D.
Spiegazione rapida: per sublimare serve energia per vincere le interazioni nel solido; il processo è endotermico e procede quando le condizioni ambientali lo consentono (per esempio bassa pressione e irraggiamento).
Una nota terminologica utile: “fenomeno” è qualunque trasformazione subita dalla materia. Se la composizione rimane la stessa è un fenomeno fisico; se cambia ed emergono nuove sostanze, è chimico. Indizi osservabili come colore, gas, solidi, odori, luce aiutano a distinguere i due casi, anche se talvolta servono misure strumentali.
Per chi ama i dettagli energetici: nei processi esotermici il bilancio di energia inviato all’ambiente è positivo (si libera calore), mentre nei processi endotermici è negativo (si assorbe calore). La combustione della carta ne è un esempio didattico perfetto: richiede innesco ma poi rilascia molta energia, e i prodotti finali risultano più stabili.
Infine, sulla solubilità: è la capacità di un soluto di dispersarsi uniformemente in un solvente. L’entità dipende da natura chimica, temperatura e pressione, ed è cruciale per distinguere soluzioni, colloidi e sospensioni.
Senza girarci troppo intorno: sapere riconoscere trasformazioni fisiche e chimiche, classificare sostanze e miscele, capire come l’energia entra ed esce dai sistemi e usare le proprietà per identificare i materiali, significa leggere il mondo materiale con occhi scientifici. Dallo zucchero nel caffè alla pioggia, dal pezzo di ferro che arrugginisce al ghiaccio secco che sublima, gli stessi principi si ripetono con elegante coerenza.
