Os elementos químicos são classificados em metais e não metais com base em suas propriedades físicas e químicas. Os metais são conhecidos por sua condutividade elétrica e térmica, brilho metálico, maleabilidade e ductilidade, enquanto os não metais geralmente são opacos, quebradiços e maus condutores de eletricidade e calor. Neste artigo, iremos explorar 17 características distintas que diferenciam os metais dos não metais, ajudando a entender melhor suas propriedades e comportamentos na natureza.
Conheça as características distintas entre os metais e não-metais neste breve guia informativo.
Os metais e não-metais são dois grupos distintos de elementos na tabela periódica, cada um com suas próprias características únicas. Abaixo estão 17 características que diferenciam os metais dos não-metais:
Características dos Metais:
- Condutividade: Os metais são bons condutores de eletricidade e calor.
- Maleabilidade: Os metais podem ser facilmente moldados em folhas finas sem quebrar.
- Ductilidade: Os metais podem ser esticados em fios finos sem quebrar.
- Brilho: Os metais têm um brilho metálico característico.
- Densidade: Os metais são geralmente densos em comparação com os não-metais.
- Ponto de fusão e ebulição: Os metais têm altos pontos de fusão e ebulição.
- Condutividade térmica: Os metais são bons condutores de calor.
- Maleabilidade: Os metais podem ser facilmente moldados em diferentes formas.
- Reatividade: Os metais tendem a perder elétrons e formar íons positivos em reações químicas.
- Catodo: Os metais são geralmente usados como cátodos em eletrólise.
Características dos Não-Metais:
- Condutividade: Os não-metais são maus condutores de eletricidade e calor.
- Quebradiço: Os não-metais são quebradiços e não podem ser facilmente moldados em folhas finas.
- Opacidade: Os não-metais são opacos e não têm brilho metálico.
- Densidade: Os não-metais são geralmente menos densos do que os metais.
- Ponto de fusão e ebulição: Os não-metais têm baixos pontos de fusão e ebulição em comparação com os metais.
- Condutividade térmica: Os não-metais são maus condutores de calor.
- Reatividade: Os não-metais tendem a ganhar elétrons e formar íons negativos em reações químicas.
- Anodo: Os não-metais são geralmente usados como ânodos em eletrólise.
Em resumo, os metais e não-metais têm características distintas que os diferenciam uns dos outros. Enquanto os metais são geralmente bons condutores de eletricidade e calor, maleáveis e brilhantes, os não-metais são maus condutores, quebradiços e opacos. Essas diferenças são fundamentais para entender as propriedades únicas de cada tipo de elemento na natureza.
Principais características dos metais: descubra as 7 mais importantes para compreender sua natureza.
Os metais são elementos químicos que possuem características únicas e distintas dos não metais. Para compreender melhor a natureza dos metais, é importante conhecer suas principais características. Aqui estão as 7 mais importantes:
1. Condutividade elétrica: Os metais são bons condutores de eletricidade devido à sua estrutura atômica que permite a movimentação de elétrons livres.
2. Maleabilidade: Os metais podem ser facilmente moldados em diferentes formas sem quebrar, devido à capacidade de seus átomos deslizarem uns sobre os outros.
3. Ductilidade: Os metais podem ser transformados em fios finos sem se romperem, o que é essencial para a fabricação de cabos elétricos, por exemplo.
4. Brilho metálico: Os metais refletem a luz de forma característica, criando um brilho característico que é conhecido como brilho metálico.
5. Dureza: A maioria dos metais é dura e resistente, o que os torna úteis em aplicações que exigem materiais robustos.
6. Ponto de fusão elevado: Os metais possuem altos pontos de fusão, o que significa que eles são sólidos em temperaturas ambiente e podem suportar altas temperaturas sem se deteriorar.
7. Condutividade térmica: Os metais também são bons condutores de calor, o que os torna úteis em aplicações que requerem a dissipação de calor.
Essas características fazem dos metais elementos essenciais em diversas áreas da indústria e da tecnologia, tornando-os fundamentais para o desenvolvimento da sociedade moderna.
Características distintas entre metais e ametais: entenda suas propriedades e diferenças.
Metais e ametais são dois grupos distintos de elementos químicos que possuem características bem diferentes. Vamos explorar 17 características que os diferenciam:
1. Estrutura: Os metais possuem uma estrutura cristalina, enquanto os ametais possuem uma estrutura molecular ou covalente.
2. Condutividade elétrica: Os metais são bons condutores de eletricidade devido à sua estrutura de elétrons livres, enquanto os ametais são maus condutores.
3. Maleabilidade: Os metais são maleáveis e podem ser moldados em diferentes formas, enquanto os ametais são quebradiços e não podem ser facilmente moldados.
4. Densidade: Os metais geralmente têm uma densidade maior do que os ametais.
5. Ponto de fusão: Os metais têm pontos de fusão mais altos do que os ametais.
6. Brilho: Os metais possuem um brilho metálico característico, enquanto os ametais são opacos.
7. Força: Os metais são geralmente mais fortes do que os ametais.
8. Reatividade: Os metais tendem a perder elétrons e formar íons positivos, enquanto os ametais tendem a ganhar elétrons e formar íons negativos.
9. Cor: Os metais têm cores características, enquanto os ametais podem ter uma variedade de cores.
10. Magnetismo: Alguns metais são magnéticos, enquanto os ametais não são.
11. Condutividade térmica: Os metais são bons condutores de calor, enquanto os ametais são maus condutores.
12. Ponto de ebulição: Os metais têm pontos de ebulição mais altos do que os ametais.
13. Solidez: Os metais são sólidos à temperatura ambiente, enquanto alguns ametais são líquidos ou gases.
14. Reatividade com água: Alguns metais reagem com a água, enquanto os ametais não reagem de forma tão intensa.
15. Toxicidade: Alguns metais são tóxicos em grandes quantidades, enquanto os ametais podem ser menos tóxicos.
16. Abundância na crosta terrestre: Os metais são mais abundantes do que os ametais na crosta terrestre.
17. Utilização: Os metais são amplamente utilizados na indústria devido às suas propriedades, enquanto os ametais têm aplicações mais específicas.
Características principais dos não-metais: quais são e como influenciam a química dos elementos.
Os não-metais são um grupo de elementos químicos que possuem características distintas dos metais. Eles são essenciais para a química dos elementos devido às suas propriedades únicas. Aqui estão algumas características principais dos não-metais e como elas influenciam a química dos elementos:
1. Baixa condutividade elétrica: Os não-metais geralmente não conduzem eletricidade tão bem quanto os metais devido à falta de elétrons livres em sua estrutura atômica.
2. Baixa condutividade térmica: Da mesma forma, os não-metais têm baixa capacidade de conduzir calor devido à sua estrutura molecular mais complexa.
3. Elevada eletronegatividade: Os não-metais tendem a atrair elétrons com mais força do que os metais, o que os torna mais propensos a formar ligações covalentes.
4. Estado físico variável: Os não-metais podem existir em diferentes estados físicos, como sólido, líquido ou gasoso, dependendo das condições de temperatura e pressão.
5. Baixa densidade: Em geral, os não-metais têm densidades mais baixas do que os metais, o que afeta suas propriedades físicas e químicas.
6. Frágil: Alguns não-metais são frágeis e quebradiços, tornando-os menos maleáveis e dúcteis do que os metais.
7. Formação de ácidos: Muitos não-metais reagem com água para formar soluções ácidas, o que é importante em processos químicos e biológicos.
8. Comportamento não metálico: Os não-metais geralmente exibem propriedades opostas aos metais, como opacidade, baixa condutividade e reatividade química diferente.
9. Variedade de cores: Alguns não-metais, como o enxofre e o fósforo, podem exibir cores variadas em diferentes formas alotrópicas.
10. Baixo ponto de fusão e ebulição: Comparados aos metais, os não-metais geralmente possuem pontos de fusão e ebulição mais baixos, o que os torna mais voláteis.
11. Grande variedade de propriedades: Os não-metais são diversos em termos de propriedades físicas e químicas, tornando-os essenciais para uma ampla gama de aplicações.
12. Não magnéticos: A maioria dos não-metais não é magnética, ao contrário dos metais, que podem ser atraídos por um ímã.
13. Baixa condutividade de calor: Os não-metais têm baixa capacidade de transferir calor, o que os torna menos eficientes em aplicações que requerem alta condutividade térmica.
14. Alto ponto de ebulição: Alguns não-metais têm pontos de ebulição muito altos, o que os torna valiosos em aplicações de alta temperatura.
15. Comportamento químico diversificado: Os não-metais exibem uma variedade de comportamentos químicos, como reatividade com outros elementos e formação de compostos estáveis.
16. Importância biológica: Alguns não-metais são essenciais para a vida, como o oxigênio, o carbono e o nitrogênio, que desempenham papéis fundamentais em processos biológicos.
17. Versatilidade na indústria: Devido às suas propriedades únicas, os não-metais são amplamente utilizados na indústria para uma variedade de aplicações, desde materiais de construção até produtos químicos.
17 Características de metais e não metais
As características de metais e não-metais são geralmente totalmente opostas, portanto são bem diferenciadas e catalogadas.Toda a matéria é composta de unidades elementares que existem em um número ilimitado.

Dentro desses elementos, podemos fazer uma classificação em metais, não metais e metalóides. A maioria dos elementos que encontramos na natureza são metais provenientes de minerais.
Na tabela periódica, 87 dos elementos são metais, deixando apenas 25 não-metais. Os semimetais têm características dos outros elementos, mas é impossível fazer uma distinção exata.
As propriedades dos metais são baseadas principalmente em seu caráter eletropositivo e no pequeno número de elétrons de valência.
Os não-metais, para alcançar a estrutura nobre dos gases, precisam apenas de alguns elétrons, pois são unidos por ligações de covalência.
Também é importante levar em consideração o estado de oxidação do metal, pois quanto maior o estado de oxidação, mais ele se comportará como um não-metal.
Os elementos metálicos mais comuns são, em ordem alfabética, alumínio, bário, berílio, bismuto, cádmio, cálcio, cério, cromo, cobalto, cobre, ouro, irídio, ferro, chumbo, lítio, magnésio, manganês, mercúrio, molibdênio, níquel , ósmio, paládio, platina, potássio, rádio, ródio, prata, sódio, tântalo, tálio, tório, estanho, titânio, tungstênio, urânio, vanádio e zinco.
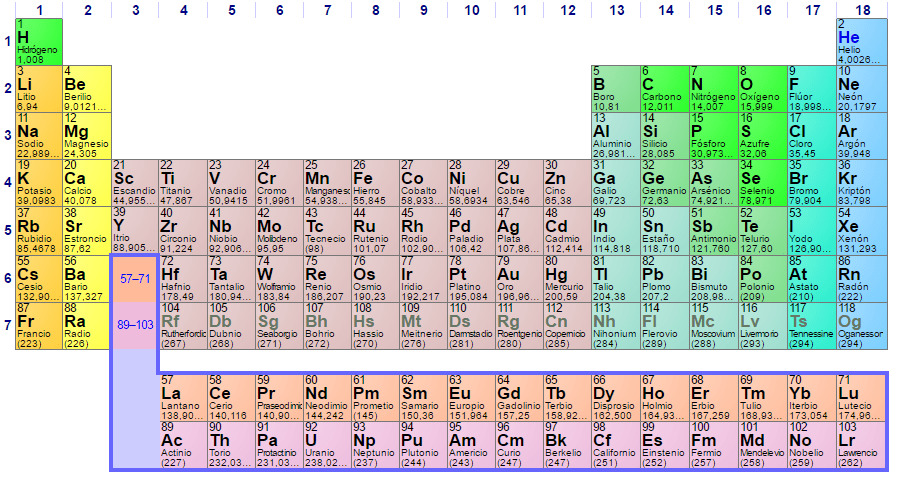
Dentro dos metais, podemos distingui-los em grandes grupos, alcalino e alcalino-terroso; como metais de transição, que são o maior número de elementos metálicos encontrados na tabela periódica; e lantanídeos, actinídeos e transactinídeos
Os não-metais diferem dos metais porque possuem uma química muito diversa. Dentro dos não-metais, encontramos os halogênios, flúor, cloro, bromo, iodo e astatina; gases nobres, hélio, néon, argônio, criptônio, xenônio e rádon; e o restante dos não-metais que pertencem a vários grupos e são hidrogênio, carbono, enxofre, selênio, nitrogênio, oxigênio e fósforo.
Principais características dos metais
Os metais são aqueles elementos puros que possuem poucos elétrons de valência em sua última camada, além de uma cor acinzentada e um brilho metálico.
Eles têm uma estrutura cristalina em estado sólido, exceto o mercúrio que na natureza está em estado líquido
Condutores de eletricidade
Essa é uma das principais características que distingue os elementos metálicos. São materiais que têm pouca resistência à passagem de eletricidade.
Prata, alumínio e cobre são os metais que melhor conduzem a eletricidade. Por terem baixa resistência, permitem que a carga elétrica passe facilmente através deles
Maleabilidade
Essa propriedade característica dos metais permite que sejam deformados para criar chapas muito finas do elemento.
O elemento mais maleável de todos é o ouro, que pode se tornar folhas de até um milésimo de milímetro. Essa propriedade permite que os elementos se deformam em folhas sem quebrar.
Ductilidade
A ductilidade é outra característica típica dos metais. Isso permite que os metais se deformam em roscas finas que não quebram.
Para que esses elementos se quebrem quando são transformados em fios, eles devem ter sido submetidos a grandes deformações.
Tenacidade
A capacidade de sofrer deformações antes da quebra é conhecida como resistência. Os metais são caracterizados por altos níveis de tenacidade.
A maleabilidade, a ductilidade e a tenacidade são características inter-relacionadas, tornando impossível que elas sejam independentes uma da outra. A tenacidade se deve ao grau de coesão das moléculas que, quando atingidas, acumulam deslocamentos até que se rompam.
Resistência mecânica
Como as características anteriores, a resistência mecânica dos elementos metálicos é aquela característica que lhes permite resistir às forças e forças sem quebrar, mas pode adquirir deformações permanentes ou deteriorar-se de alguma forma.
Para calcular a resistência de um metal, é necessário calcular as tensões necessárias, a análise da resistência e a rigidez do metal.
Condutividade térmica
Os metais, além de serem bons condutores de eletricidade, também oferecem pouca resistência à passagem de calor, tornando-os um meio de passagem para essa energia de trânsito.
Cores
Os elementos metálicos são geralmente todos acinzentados ou metálicos, exceto ouro, bismuto e cobre.
Sólidos
Os elementos metálicos encontrados na natureza estão sempre em estado sólido, exceto mercúrio.
Embora estejam em estado sólido, eles podem entrar em estado líquido através da fundição ou de grandes pressões exercidas para romper os laços e convertê-los em líquidos.
Poucos elétrons de valência
Entre as propriedades químicas que encontramos nos elementos metálicos, destaca os poucos elétrons de valência que possui.
Isso resulta em que, com poucos elétrons em suas últimas camadas, os metais perdem para formar novas ligações químicas .
Quanto menos elétrons eles tiverem em sua última camada, mais metálicos serão os elementos. Se eles tiverem mais elétrons em sua última camada, você se tornará metalóide ou metais de transição.
Principais características dos não-metais
Os não-metais diferem dos metais porque possuem uma química muito diversa. O hidrogênio é o único elemento da tabela periódica que não possui características comuns a nenhum outro e é por isso que é separado.
Aparência e localização
Ao contrário dos metais, os não-metais não têm cor ou brilho característicos. A maioria dos não-metais é necessária para a existência da vida, como carbono, hidrogênio, oxigênio, nitrogênio, fósforo e enxofre, que são encontrados em todos os seres vivos de maneira importante.
Dureza
Sendo um conjunto de elementos diferentes, a dureza varia muito de um não metal para outro. Por exemplo, eles podem ser duros como diamante, que é uma variação de carbono, ou moles como enxofre que podem ser desfeitos manualmente.
Portanto, ao apresentar uma dureza tão baixa, virtualmente nenhum metal é maleável, dúctil ou possui resistência mecânica, pois se rompe facilmente
Estado
Podemos encontrá-los em qualquer tipo de estado da natureza, são gases (como oxigênio), líquidos (bromo) e sólidos (como carbono).
Seus pontos de fusão e ebulição variam de acordo com o elemento. Por exemplo, a maioria dos não-metais tem um ponto de fusão muito baixo, exceto o carbono, que derrete a 3500 ° C.
Condutividade
Ao contrário dos metais, os não-metais são maus condutores de calor e eletricidade. M
Muitos deles quando usados como um condutor elétrico quebram ou recombinam quimicamente. Como se tentassem se dissolver na água, eles produziriam uma solução ácida.
Isoladores
Como mencionamos anteriormente, eles são maus condutores de eletricidade e calor. É por isso que são isoladores térmicos perfeitos, uma vez que aquecidos, mantêm o calor dentro deles devido à sua falta de condutividade.
Muitos elétrons de valência
Elementos não metálicos têm muitos elétrons em sua última camada. É por isso que eles estão localizados à direita da tabela periódica. Eles geralmente têm 4, 5, 6 e / ou 7 elétrons. Os gases nobres são aqueles que possuem 7 elétrons de valência em sua última camada.
Do ponto de vista da eletrônica, os elementos comuns dentro dos não-metais têm a mesma configuração na última camada, mas isso não significa que eles tenham o mesmo número de camadas.
Eletronegativo
Eletronegatividade é a capacidade de adquirir elétrons quando uma ligação química é formada . A eletronegatividade de um átomo está relacionada à sua massa atômica e à distância que os elétrons de valência têm de seu número atômico.
Os gases nobres, com o maior número de elétrons em sua última camada e a maior eletronegatividade, unem-se em ligações covalentes.
Como quando formam uma ligação química, adotam os elétrons do outro elemento, é por isso que permanecem carregados negativamente.
Agentes oxidantes
Outra das propriedades químicas dos não-metais é que, quando combinados com o oxigênio, eles formam óxidos não metálicos ou anidro.
Referências
- ALGODÃO, Albert F.; Wilson, Geoffrey; GAUS, Paul L. Química inorgânica básica . Wiley, 1995.
- SPEIGHT, James G., et al. O manual de química de Lange . Nova York: McGraw-Hill, 2005.
- BOLT, Gerard H., et al. Química do solo A. Elementos básicos . Elsevier Scientific Publishing Company, 1978.
- COTTON, Frank Albert, et al. Química inorgânica avançada . Nova York: Wiley, 1988.
- DA SILVA, JJR Frausto; WILLIAMS, Robert Joseph Paton. A química biológica dos elementos: a química inorgânica da vida . Oxford University Press, 2001.
- PETRUCCI, Ralph H., et al. química geral . Fundo Interamericano de Educação, 1977.
- RAYNER-CANHAM, GeoffEscalona García, et al. Química inorgânica descritiva . Pearson Education, 2000.