O etano é um hidrocarboneto saturado, pertencente à classe dos alcanos, e é composto por dois átomos de carbono e seis átomos de hidrogênio. Sua fórmula química é C2H6. Trata-se de um gás incolor, inodoro e inflamável, que é amplamente utilizado na indústria química e petroquímica. Neste artigo, discutiremos a estrutura molecular do etano, suas propriedades físicas e químicas, seus principais usos industriais, bem como os riscos associados ao seu manuseio e armazenamento.
Estruturas moleculares do etano: conheça a composição e a organização das moléculas.
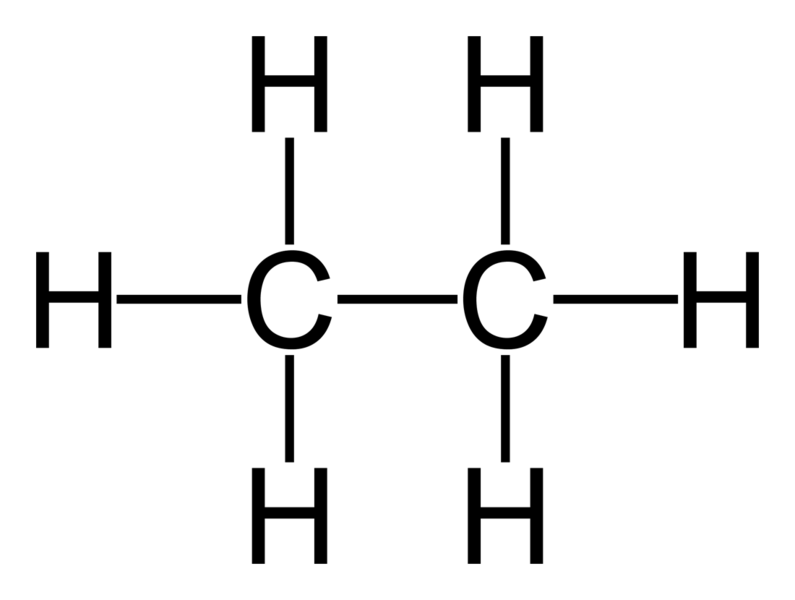
O etano é um hidrocarboneto saturado pertencente à família dos alcanos, composto por dois átomos de carbono e seis átomos de hidrogênio. Sua fórmula molecular é C2H6, e sua estrutura molecular é representada por uma cadeia de carbono simples, ligados entre si por ligações simples, e cada carbono ligado a três átomos de hidrogênio.
Essa organização molecular do etano confere a ele propriedades físicas como ponto de ebulição de -88,6°C e ponto de fusão de -182,8°C. Além disso, o etano é um composto inflamável e, quando queimado, libera energia na forma de calor.
Devido às suas propriedades, o etano é amplamente utilizado na indústria petroquímica como matéria-prima na produção de plásticos, solventes, combustíveis e outros produtos químicos. Ele também é utilizado como combustível em veículos, especialmente em regiões onde o gás natural é abundante.
No entanto, é importante ressaltar que o etano apresenta riscos à saúde e ao meio ambiente. Sua inalação pode causar tonturas, dores de cabeça e até mesmo asfixia em concentrações elevadas. Além disso, o etano é um gás de efeito estufa, contribuindo para o aquecimento global quando liberado na atmosfera.
Para que serve o etano?
O etano é um hidrocarboneto saturado de cadeia linear, formado por dois átomos de carbono e seis átomos de hidrogênio. Sua fórmula química é C2H6. É um gás incolor, inodoro e altamente inflamável.
O etano é amplamente utilizado como combustível e matéria-prima na indústria química. Ele é uma das principais matérias-primas para a produção de etileno, que por sua vez é utilizado na fabricação de plásticos, solventes, produtos químicos e até mesmo como agente de maturação de frutas.
Além disso, o etano é utilizado como gás de cozinha em algumas regiões do mundo, sendo uma alternativa mais limpa e eficiente em comparação com outros combustíveis fósseis. Também é utilizado como propelente em aerossóis e refrigerante em sistemas de refrigeração.
No entanto, é importante ressaltar que o etano é altamente inflamável e pode representar riscos à saúde e ao meio ambiente se não for manuseado corretamente. A inalação de altas concentrações de etano pode causar tonturas, sonolência e até mesmo asfixia. Além disso, sua combustão pode gerar gases tóxicos e contribuir para o aquecimento global.
Portanto, o etano é uma substância de grande importância na indústria e no cotidiano, mas seu uso deve ser feito com responsabilidade e seguindo todas as normas de segurança para evitar acidentes e danos ao meio ambiente.
Onde é possível encontrar o composto químico conhecido como etano na natureza?
O etano é um composto químico que pode ser encontrado na natureza principalmente como parte do gás natural e do petróleo. Ele é um hidrocarboneto simples, composto por dois átomos de carbono e seis átomos de hidrogênio, representado pela fórmula C2H6.
No gás natural, o etano está presente em concentrações que variam de acordo com a fonte, podendo chegar a até 20%. Ele é separado dos outros componentes do gás natural através de processos de destilação e compressão.
Além de ser encontrado no gás natural, o etano também pode ser produzido artificialmente a partir de matérias-primas como o petróleo e o gás natural. Ele é amplamente utilizado na indústria petroquímica para a produção de plásticos, solventes e combustíveis.
No entanto, é importante ressaltar que o etano, assim como outros hidrocarbonetos, possui riscos associados ao seu manuseio e uso. Ele é inflamável e pode causar irritações na pele e nos olhos em caso de contato direto. Portanto, é essencial seguir as medidas de segurança adequadas ao lidar com esse composto químico.
Qual é a estrutura molecular do etano?
O etano é um hidrocarboneto que pertence à classe dos alcanos, sendo composto por dois átomos de carbono e seis átomos de hidrogênio. Sua fórmula molecular é C2H6. A estrutura molecular do etano é formada por uma ligação simples entre os dois átomos de carbono, cada um ligado a três átomos de hidrogênio. Essa estrutura é representada pela fórmula estrutural CH3-CH3.
O etano é um gás incolor, inflamável e altamente volátil. É produzido principalmente a partir do processo de craqueamento do petróleo, sendo utilizado como combustível em aquecimento residencial, na indústria química e petroquímica, e como matéria-prima para a produção de plásticos e solventes.
Apesar de sua ampla aplicação, o etano também apresenta riscos para a saúde e o meio ambiente. Sua combustão pode gerar gases tóxicos, como o dióxido de carbono e monóxido de carbono, além de contribuir para o efeito estufa. Portanto, é importante manusear e armazenar o etano com cuidado para evitar acidentes.
Etano: estrutura, propriedades, usos e riscos
O etano é um hidrocarboneto simples de fórmula C 2 H 6 com uma natureza de gás incolor e inodoro que tem uma utilização muito valiosa e diversificada na síntese de etileno.Além disso, é um dos gases terrestres que também foi detectado em outros planetas e corpos estelares ao redor do Sistema Solar. Foi descoberto pelo cientista Michael Faraday em 1834.
Entre o grande número de compostos orgânicos formados por átomos de carbono e hidrogênio (conhecidos como hidrocarbonetos), existem aqueles que estão em estado gasoso à temperatura e pressão ambiente, amplamente utilizados em diversas indústrias.

Estes geralmente provêm da mistura gasosa chamada “gás natural”, um produto de alto valor para a humanidade, e compõem os alcanos do tipo metano, etano, propano e butano, entre outros; sendo classificado de acordo com a quantidade de átomos de carbono em sua cadeia.
Estrutura quimica
O etano é uma molécula com a fórmula C 2 H 6 , normalmente vista como uma união de dois grupos metil (-CH 3 ) para formar o hidrocarboneto de uma ligação simples carbono-carbono. É também o composto orgânico mais simples depois do metano, representando da seguinte forma:
H 3 C-CH 3
Os átomos de carbono nesta molécula têm hibridação do tipo sp 3 , de modo que as ligações moleculares têm rotação livre.
Há também um fenômeno intrínseco do etano, que se baseia na rotação de sua estrutura molecular e na energia mínima necessária para produzir uma rotação de ligação de 360 graus, que os cientistas denominaram “barreira ao etano”.
Por esse motivo, o etano pode ser apresentado em diferentes configurações de acordo com sua rotação, mesmo que sua conformação mais estável exista onde os hidrogênios se opõem (como visto na figura).
Síntese de Etano
O etano pode ser facilmente sintetizado a partir da eletrólise de Kolbe, uma reação orgânica na qual ocorrem duas etapas: uma descarboxilação eletroquímica (remoção do grupo carboxila e liberação de dióxido de carbono) de dois ácidos carboxílicos e a combinação de produtos intermediários para formar uma ligação covalente.
Da mesma forma, a eletrólise do ácido acético resulta na formação de etano e dióxido de carbono, e essa reação é usada para sintetizar o primeiro.
A oxidação do anidrido acético pela ação dos peróxidos, um conceito semelhante ao da eletrólise de Kolbe, também resulta na formação de etano.
Da mesma forma, ele pode ser eficientemente separado do gás natural e do metano por um processo de liquefação, usando sistemas criogênicos para capturar esse gás e separá-lo das misturas com outros gases.
O processo de turboexpansão é preferido para esse papel: a mistura de gases é passada através de uma turbina, gerando uma expansão dela, até que sua temperatura desça abaixo de -100 ° C.
Já neste momento, os componentes da mistura podem ser diferenciados, de modo que o etano líquido seja separado do metano gasoso e das outras espécies envolvidas no uso de uma destilação.
Propriedades
O etano ocorre na natureza como um gás inodoro e incolor a pressões e temperaturas padrão (1 atm e 25 ° C). Tem um ponto de ebulição de -88,5 ºC e um ponto de fusão de -182,8 ºC. Além disso, não é afetado pela exposição a ácidos ou bases fortes.
Solubilidade em Etano
As moléculas de etano são de configuração simétrica e possuem forças de atração fracas que as mantêm unidas, chamadas forças de dispersão.
Quando se tenta dissolver o etano na água, as forças de atração formadas entre o gás e o líquido são muito fracas, de modo que o etano dificilmente se une às moléculas de água.
Por esse motivo, a solubilidade do etano é consideravelmente baixa, aumentando levemente quando a pressão do sistema aumenta.
Cristalização de Etano
O etano pode ser solidificado, formando cristais instáveis de etano com uma estrutura cristalina cúbica.
Com uma diminuição da temperatura além de -183,2 ° C, essa estrutura se torna monoclínica, aumentando a estabilidade de sua molécula.
Combustão de etano
Esse hidrocarboneto, embora não seja amplamente utilizado como combustível, pode ser usado em processos de combustão para gerar dióxido de carbono, água e calor, que é representado da seguinte forma:
2C 2 H 6 + 7O 2 → 4CO 2 + 6H 2 O + 3120 kJ
Existe também a possibilidade de queimar essa molécula sem excesso de oxigênio, conhecido como “combustão incompleta”, e que resulta na formação de carbono amorfo e monóxido de carbono em uma reação indesejada, dependendo da quantidade de oxigênio aplicada :
2C 2 H 6 + 3O 2 → 4C + 6H 2 O + Calor
2C 2 H 6 + 4O 2 → 2C + 2CO + 6H 2 O + Calor
2C 2 H 6 + 5O 2 → 4CO + 6H 2 O + Calor
Nesta área, a combustão ocorre através de uma série de reações de radicais livres, que são numeradas nas centenas de reações diferentes. Por exemplo, nas reações de combustão incompletas, compostos como formaldeído, acetaldeído, metano, metanol e etanol podem ser formados.
Isso vai depender das condições em que a reação ocorre e das reações de radicais livres envolvidas. O etileno também pode ser formado a altas temperaturas (600-900 ° C), que é um produto altamente desejado pela indústria.
Etano na atmosfera e nos corpos celestes
O etano está presente na atmosfera do planeta Terra em traços, e suspeita-se que os seres humanos tenham conseguido dobrar essa concentração desde que começaram a praticar atividades industriais.
Os cientistas pensam que grande parte da presença atual de etano na atmosfera se deve à combustão de combustíveis fósseis, embora a emissão global de etano tenha diminuído quase pela metade desde que as tecnologias de produção de gás de xisto foram aprimoradas (uma fonte de gás natural).
Esta espécie também ocorre naturalmente pelo efeito dos raios solares no metano atmosférico, que recombina e forma uma molécula de etano.
O etano existe em estado líquido na superfície de Titã, uma das luas de Saturno. Isso ocorre em maior quantidade no rio Vid Flumina, que corre mais de 400 quilômetros até um de seus mares. Este composto também foi evidenciado em cometas e na superfície de Plutão.
Usos
Produção de etileno
O uso de etano é baseado principalmente na produção de etileno, o produto orgânico mais amplamente utilizado na produção mundial, por meio de um processo conhecido como craqueamento a vapor.
Esse processo envolve a passagem de uma alimentação de etano diluído em vapor para um forno, aquecendo-o rapidamente sem oxigênio.
A reação ocorre a uma temperatura extremamente alta (entre 850 e 900 ° C), mas o tempo de permanência (o tempo que o etano passa dentro do forno) deve ser curto para que a reação seja eficaz. Em temperaturas mais altas, mais etileno é gerado.
Formação química básica
O etano também foi estudado como um componente importante na formação de produtos químicos básicos. A cloração oxidativa é um dos processos propostos para obter cloreto de vinila (um componente do PVC), substituindo outros menos econômicos e mais complicados.
Refrigerante
Finalmente, o etano é usado como refrigerante em sistemas criogênicos comuns, mostrando também a capacidade de congelar pequenas amostras em laboratório para análise.
É um substituto muito bom para a água, que leva mais tempo para esfriar as amostras delicadas e também pode causar a formação de cristais de gelo prejudiciais.
Riscos de Etano
– O etano tem a capacidade de inflamar, principalmente quando se liga ao ar Em porcentagens de 3,0 a 12,5% em volume de etano no ar, uma mistura explosiva pode ser formada.
-Você pode limitar o oxigênio no ar em que está e, por esse motivo, apresenta um fator de risco de asfixia para pessoas e animais presentes e expostos.
– O etano na forma líquida congelada pode queimar seriamente a pele se for feito contato direto com ela, além de atuar como um meio criogênico para qualquer objeto que toque, congelando-a em instantes.
-Os vapores de etano líquido são mais pesados que o ar e estão concentrados no solo; isso pode apresentar um risco de ignição que pode gerar uma reação de combustão em cadeia.
-A ingestão de etano pode causar náusea, vômito e sangramento interno. A inalação, além de asfixia, causa dores de cabeça, confusão e alterações de humor. A morte por parada cardíaca é possível em exposições elevadas.
-Representa um gás de efeito estufa que, juntamente com o metano e o dióxido de carbono, contribui para o aquecimento global e as mudanças climáticas geradas pela poluição humana. Felizmente, é menos abundante e durável que o metano e absorve menos radiação que isso.
Referências
- Britannica, E. (sf). Etano Obtido em britannica.com
- Nes, GV (sf). Estruturas monocristalinas e distribuições de densidade eletrônica de etano, etileno e acetileno. Recuperado do rug.nl
- Sites, G. (sf). Etano: Fontes e Pias. Obtido em sites.google.com
- SoftSchools (sf). Fórmula de etano Recuperado de softschools.com
- Wikipedia (sf). Etano Obtido em en.wikipedia.org