O Ágar CLED (Cystine-Lactose-Electrolyte-Deficient) é um meio de cultura seletivo e diferencial amplamente utilizado em microbiologia para o isolamento e identificação de bactérias urinárias. Este meio foi desenvolvido por Edson, Levin e Mueller em 1951 e é composto por nutrientes que permitem o crescimento de várias espécies de bactérias presentes na urina, enquanto inibem o crescimento de outros microrganismos. A preparação do Ágar CLED é relativamente simples e envolve a adição de componentes como peptona, lactose, sais minerais e indicadores de pH. Este meio é utilizado principalmente em laboratórios clínicos para o diagnóstico de infecções do trato urinário, sendo uma ferramenta essencial na identificação de agentes patogênicos responsáveis por essas infecções.
Preparo do Ágar Cled: passo a passo para cultivar microorganismos em laboratório.
O Ágar CLED é um meio de cultura seletivo utilizado para o isolamento e contagem de microorganismos do trato urinário. Ele foi desenvolvido por meio de uma combinação de Ágar MacConkey e Ágar Cystine-Lactose-Electrolyte-Deficient (CLED), permitindo o crescimento de bactérias gram-negativas e inibindo o crescimento de bactérias gram-positivas.
Para preparar o Ágar CLED, siga os seguintes passos:
1. Pese os ingredientes: Pese os ingredientes necessários para a preparação do meio, incluindo peptona, extrato de carne, lactose, cloreto de sódio, fosfato dipotássico, ágar e outros componentes.
2. Dissolva os ingredientes: Dissolva os ingredientes em água destilada aquecida, mexendo regularmente para garantir a completa dissolução.
3. Ajuste o pH: Ajuste o pH do meio para cerca de 7,4 utilizando ácido clorídrico ou hidróxido de sódio.
4. Esterilize o meio: Esterilize o meio de cultura em autoclave a 121°C por 15 minutos.
5. Agarre o meio: Agarre o meio esterilizado em placas de Petri e deixe solidificar.
Após preparar o Ágar CLED, ele estará pronto para ser utilizado no cultivo de microorganismos, ajudando na identificação de agentes infecciosos presentes no trato urinário. Este meio é amplamente utilizado em laboratórios clínicos para diagnóstico de infecções urinárias.
Seguindo o passo a passo de preparo descrito acima, é possível obter um meio de qualidade para cultivo de microorganismos em laboratório.
Como utilizar o Ágar Cled de forma correta e eficaz em microbiologia.
O Ágar CLED, ou Ágar Cistina-Lactose-Eletrolitos-Deficiente, é um meio de cultura seletivo utilizado na microbiologia para o isolamento e contagem de bactérias presentes na urina. Este meio foi desenvolvido por Cruickshank e colaboradores em 1973 e é amplamente utilizado em laboratórios clínicos para detectar infecções urinárias.
Para preparar o Ágar CLED, é importante seguir corretamente as instruções do fabricante, que geralmente envolvem a adição de pó do meio em água destilada e a autoclavagem para esterilização. Após a preparação, o meio é vertido em placas de Petri e deixado solidificar.
Para utilizar o Ágar CLED de forma correta e eficaz em microbiologia, é necessário coletar uma amostra de urina de forma asséptica e sem contaminação externa. Em seguida, o material é semeador no meio de cultura utilizando uma alça de platina esterilizada.
As placas são incubadas a uma temperatura adequada, geralmente entre 35-37°C, por um período de 18-24 horas. Durante esse período, as bactérias presentes na amostra irão crescer no meio de cultura, formando colônias que podem ser contadas e identificadas.
É importante ressaltar que o Ágar CLED é seletivo para bactérias gram-negativas, inibindo o crescimento de bactérias gram-positivas. Além disso, a presença de cristais de ácido úrico na urina pode interferir nos resultados, sendo necessário realizar uma análise cuidadosa.
Seguindo corretamente as etapas de preparação e utilização, é possível obter resultados precisos e confiáveis para o diagnóstico de infecções urinárias.
Para que serve o ágar na microbiologia e na culinária?
O ágar é uma substância gelatinosa extraída de algas marinhas vermelhas, amplamente utilizado na microbiologia e na culinária. Na microbiologia, o ágar é um meio de cultura sólido que fornece os nutrientes necessários para o crescimento de microorganismos, facilitando a observação e o estudo de diferentes tipos de bactérias, fungos e outros microrganismos. O ágar CLED, por exemplo, é um meio seletivo utilizado para o isolamento e identificação de coliformes na urina.
Na culinária, o ágar é utilizado como um espessante natural em diversos pratos, substituindo a gelatina de origem animal. Além disso, o ágar é um ingrediente comum em sobremesas, geleias, molhos e caldos, sendo uma opção vegana e saudável para quem busca uma alternativa ao uso de gelatina.
A preparação do ágar é simples: basta dissolver o pó em água quente e aquecer até que a mistura atinja o ponto de ebulição. Em seguida, o líquido deve ser resfriado até solidificar, formando uma gelatina firme e transparente, pronta para ser utilizada tanto na microbiologia quanto na culinária.
Sua utilização proporciona resultados precisos e de qualidade, contribuindo para o avanço da ciência e para a produção de pratos deliciosos e saudáveis.
Preparo do ágar para uso em laboratório: passo a passo detalhado.
O ágar é uma substância gelatinosa derivada de algas marinhas, amplamente utilizada em laboratórios para o cultivo de microorganismos. Um dos tipos de ágar mais comuns é o Ágar CLED, que é utilizado para o isolamento e contagem de coliformes fecais em amostras clínicas e ambientais.
Para preparar o ágar CLED, siga o passo a passo detalhado a seguir:
Passo 1: Pese a quantidade necessária de pó de ágar CLED de acordo com as instruções do fabricante. Geralmente, a proporção é de 38g por litro de água.
Passo 2: Adicione o pó de ágar CLED em um frasco de vidro limpo e seco.
Passo 3: Ferva água destilada em uma panela grande o suficiente para conter a quantidade total de ágar desejada.
Passo 4: Despeje a água fervente sobre o pó de ágar no frasco de vidro, mexendo constantemente para garantir que o pó se dissolva completamente.
Passo 5: Agite bem a solução de ágar CLED para garantir uma distribuição homogênea dos componentes.
Passo 6: Deixe a solução de ágar CLED esfriar até atingir uma temperatura adequada para o cultivo de microorganismos, geralmente em torno de 45-50°C.
Passo 7: Despeje a solução de ágar CLED em placas de Petri estéreis ou tubos de ensaio, dependendo da finalidade do cultivo.
Passo 8: Deixe o ágar solidificar à temperatura ambiente ou em uma estufa apropriada antes de usar para o cultivo de microorganismos.
Com o ágar CLED preparado corretamente, você está pronto para realizar seus experimentos laboratoriais com segurança e precisão. Lembre-se de seguir as práticas de esterilização e biossegurança recomendadas para evitar contaminações indesejadas. Agora você está pronto para utilizar o ágar CLED em suas pesquisas e análises microbiológicas.
Ágar CLED: fundação, usos e preparação
O ágar CLED (Cistina-Lactose-Electrólito-Deficiência) é um sólido diferencial meio de cultura, usados para o diagnóstico de infecções do tracto urinário. A composição do meio de cultura é projetada para o bom crescimento de patógenos urinários e é ideal para a quantificação de unidades formadoras de colônias (UFC).
O meio de cultura CLED é não seletivo, uma vez que microorganismos Gram-negativos e também Gram-positivos podem crescer nele. Mas isso não é um problema, pois a maioria das infecções urinárias é causada por um único tipo de microorganismo.
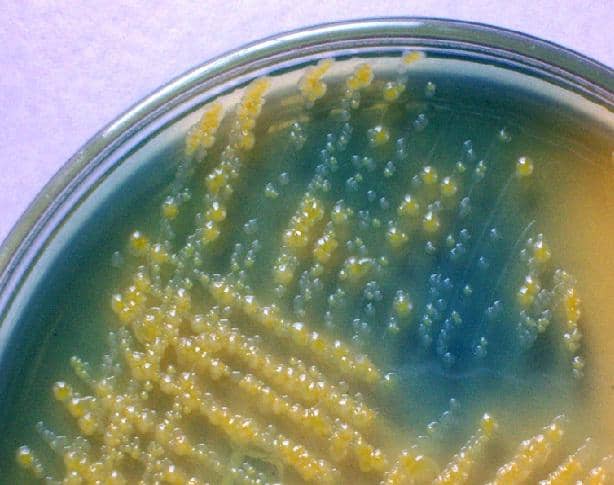
No caso de infecções polimicrobianas, podem ser obtidas 2 ou 3 bactérias diferentes, mas são muito raras e na maioria das vezes são amostras contaminadas.
Entre as bactérias Gram-negativas que podem crescer nesse ambiente estão os bacilos pertencentes à família Enterobacteriaceae e outros bacilos entéricos, sendo os uropatógenos mais frequentemente isolados em amostras de urina: Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis, Morganella morganii, Pseudomonas aeruginosa , entre outros.
Da mesma forma, entre as bactérias Gram-positivas que podem crescer nesse ambiente estão Staphylococcus aureus, Staphylococcus saprophyticus, Enterococcus faecalis, Streptococcus agalactiae, Corynebacterium sp, Lactobacillus sp e até leveduras que podem crescer, como o complexo de Candida albicans.
No entanto, devido à composição química do meio, não permite o crescimento de alguns patógenos geniturinários exigentes, como Neisseria gonorrhoeae, Gardnerella vaginalis, entre outros.
Fundação de ágar CLED
O meio de cultura CLED tem como fonte de energia extrato de carne, hidrolisado de caseína pancreática e hidrolisado de gelatina. Eles fornecem nutrientes para o desenvolvimento de bactérias pouco exigentes.
Também contém cistina, um aminoácido que permite o crescimento de coliformes, distinguível por seu pequeno tamanho.
Da mesma forma, contém lactose como carboidrato fermentável, por esse motivo esse meio é diferencial; ser capaz de distinguir as bactérias fermentadoras da lactose não fermentativa.
As bactérias fermentadoras fazem com que o pH do meio seja alterado pela produção de ácidos, desenvolvendo colônias amarelas, enquanto as bactérias não fermentadoras não geram alterações no meio, portanto assumem a cor do ágar verde original.
A reação de fermentação é revelada graças à presença do indicador de pH, que neste meio é azul de bromotimol.
Por outro lado, a baixa concentração de eletrólitos no meio inibe o crescimento invasivo típico do gênero Proteus , chamado efeito enxame. Isso gera uma vantagem sobre outros meios, pois permite a contagem dos UFCs, inclusive se o gênero Proteus estiver presente.
No entanto, a baixa concentração de eletrólitos inibe o crescimento de algumas espécies do gênero Shigella, sendo esta uma desvantagem em relação a outros meios.
Fundação CLED Agar (Bevis)
Existe uma variante ou modificação deste meio por Bevis, que incorporou a composição original de fucsina ácida (indicador Andrade). Atua em conjunto com o azul de bromotimol para diferenciar bactérias fermentadoras e não fermentadoras.
A diferença entre o meio convencional e o meio modificado é a cor que as colônias adotam. No caso de bactérias fermentadoras de lactose, as colônias adquirem uma cor laranja avermelhada com um halo rosa ou vermelho, enquanto os não fermentadores têm uma cor azul acinzentada.
Usos
O ágar CLED é usado exclusivamente para semear amostras de urina. O uso deste meio é especialmente frequente em laboratórios europeus, enquanto nos Estados Unidos é menos utilizado.
A coleta de amostras deve atender a certos parâmetros para obter resultados confiáveis, incluindo:
- Não tome antibióticos antes da amostragem.
- De preferência, tome a urina na primeira hora da manhã, pois é mais concentrada, quando não é possível coletar amostras por métodos invasivos.
- Lave bem os órgãos genitais antes de colher a amostra.
- Descarte o primeiro jato de urina e coloque o recipiente.
- Colete entre 25 e 30 ml de urina em um recipiente estéril bem rotulado.
- Leve imediatamente para o laboratório cercado por gelo.
- Ele deve ser processado antes de 2 horas de emissão ou refrigerado a 4 ° C por no máximo 24 horas.
Semeando amostras de urina
A amostra de urina deve ser diluída 1:50.
Para diluição, coloque 0,5 ml da urina do paciente e dilua com 24,5 ml de solução fisiológica estéril.
Meça 0,1 ml da urina diluída e semeie por superfície com uma espátula drigalski no meio CLED. Este é o método de semeadura indicado para contar colônias. É por isso que é utilizado em amostras de urina, uma vez que os resultados devem ser expressos em UFC / ml.
Para a quantificação das colônias obtidas, proceda da seguinte maneira: conte as colônias da placa e multiplique por 10 e depois por 50. Dessa forma, você obtém a quantidade de UFC / ml de urina.
Interpretação
Contagens acima de 100.000 UFC / ml – indica infecção do trato urinário
Contagens abaixo de 1000 UFC / ml – Nenhuma infecção
Conta entre 1000-10.000 UFC / ml – duvidoso, possível contaminação, amostragem repetida.
ID
As colônias cultivadas em ágar CLED devem ter um grama e, dependendo das características morfotetoriais do microrganismo, é realizada uma subcultura específica.
Por exemplo, se for um bacilo Gram negativo, será plantado em um ágar MacConkey, onde a fermentação ou não de lactose é corroborada. Além disso, um ágar nutriente é anexado para realizar o teste da oxidase.
Se o Gram revelar cocos Gram-positivos, pode ser subcultivado em ágar de manitol salgado e ágar de nutrientes. Neste último, o teste de catalase é realizado. Finalmente, se forem observadas leveduras, elas serão semeadas em um ágar Sabouraud.
Muitos laboratórios evitam o uso do meio CLED e preferem usar apenas ágar-sangue , MacConkey e ágar nutritivo para semear amostras de urina.
Preparação
Num frasco para injetáveis com um litro de água destilada, dissolva 36,2 gramas de ágar em pó CLED. Após 5 minutos de descanso, aqueça o ágar ressuspenso, misturando constantemente até ferver por 1 minuto.
Em seguida, esterilize a 121 ° C por 15 minutos na autoclave. Terminado o tempo, ele é removido da autoclave e deixado esfriar até atingir uma temperatura de 45 ° C. Posteriormente, 15-20 ml são servidos em cada placa de Petri estéril.
O procedimento de servir a placa deve ser realizado dentro de uma cobertura de fluxo laminar ou na frente do queimador de Bunsen para evitar contaminação.
As placas servidas podem solidificar, são solicitadas em um transportador invertido e armazenadas em uma geladeira (2-8 ° C) até o uso.
O pH final do meio preparado deve ser 7,3 ± 0,2.
Referências
- Recomendações para o diagnóstico microbiológico de infecção urinária. chil infectol . 2001; 18 (1): 57-63. Disponível em: scielo.org.
- Panchi J. Identificação do agente microbiano que causa infecções urinárias em pacientes internos submetidos a cateterismo da bexiga. 2016. Trabalho de graduação para se qualificar para o Diploma em Laboratório Clínico. Universidade Técnica de Ambato. Equador
- Laboratórios britânicos. Meio CLED. Disponível em: britanialab.com.
- Laboratórios Renylab Instruções de uso, ágar CLED. 2013 Disponível em: es.renylab.ind.br.
- Laboratórios Cultimed Manual Básico de Microbiologia. Disponível em: ictsl.net.
- Muñoz P, Cercenado E, Rodríguez-Créixems M, MD Díaz, Vicente T, Bouza E. A opção de ágar CLED na rotina de cultura de urina. Uma avaliação prospectiva e comparativa. Diagn Microbiol Infect Dis. 1992; 15 (4): 287-90.
- García P, Paredes F, Fernández del Barrio M. (1994). Microbiologia clínica prática. Universidade de Cádiz, 2ª edição. Serviço de Publicações da UCA.