O anisol é um composto orgânico que possui uma estrutura molecular composta por um anel benzênico ligado a um grupo metoxila (-OCH3). Suas propriedades físico-químicas incluem um ponto de fusão de -37,5°C, um ponto de ebulição de 154,8°C e uma solubilidade em água relativamente baixa. A nomenclatura oficial desse composto é metoxibenzeno.
Em relação aos riscos à saúde, o anisol pode ser considerado tóxico se inalado, ingerido ou em contato com a pele em altas concentrações, podendo causar irritação nos olhos, pele e vias respiratórias. Por isso, é importante manuseá-lo com cuidado e seguir as medidas de segurança adequadas.
Quanto aos usos, o anisol é amplamente utilizado na indústria química como solvente, aromatizante e intermediário na síntese de diversos compostos orgânicos, como medicamentos, fragrâncias, corantes e pesticidas. Sua versatilidade e baixo custo o tornam uma substância bastante empregada em diferentes processos industriais.
Principais aplicações do anisole na indústria e na medicina.
O anisole é um composto orgânico que possui a fórmula molecular C7H8O e é conhecido pelo seu odor característico de anis ou erva-doce. Sua estrutura consiste em um anel de benzeno ligado a um grupo metoxi (-OCH3). O anisole é frequentemente utilizado como solvente em diversas aplicações industriais, devido às suas propriedades químicas favoráveis.
Além de sua aplicação como solvente, o anisole também é utilizado na indústria química para a síntese de diversos compostos orgânicos, como fenóis e éteres de maior complexidade. Na medicina, o anisole é empregado na produção de medicamentos e cosméticos, devido ao seu odor agradável e propriedades químicas que facilitam a formulação de produtos farmacêuticos.
Em relação à sua nomenclatura, o anisole é comumente referido como metoxibenzeno ou metilfeniléter, de acordo com a nomenclatura IUPAC. Sua estrutura simples e versátil permite que seja utilizado em diversas aplicações, tornando-o um composto químico de grande importância na indústria e na medicina.
Apesar de suas múltiplas aplicações, é importante ressaltar que o anisole apresenta alguns riscos à saúde e ao meio ambiente. Em altas concentrações, o anisole pode ser tóxico e irritante para a pele e as vias respiratórias. Por isso, é fundamental seguir as medidas de segurança recomendadas ao lidar com esse composto químico.
Em resumo, o anisole é um composto orgânico amplamente utilizado na indústria e na medicina, devido às suas propriedades químicas favoráveis e seu odor característico. Sua estrutura simples e versátil permite que seja empregado em diversas aplicações, desde solventes industriais até medicamentos e cosméticos. No entanto, é essencial ter cuidado ao lidar com o anisole, devido aos riscos à saúde e ao meio ambiente que ele pode apresentar em determinadas situações.
Metilfenol: o nome comum do composto químico conhecido como metoxibenzeno.
Metilfenol é o nome comum do composto químico conhecido como metoxibenzeno. Ele é um líquido incolor com um odor característico, amplamente utilizado na indústria química como solvente e intermediário na síntese de outros compostos.
O anisol é um éter com a fórmula molecular C7H8O, também conhecido como metoxibenzeno. Possui uma estrutura simples, consistindo de um anel de benzeno ligado a um grupo metoxi (-OCH3). Suas propriedades físicas incluem um ponto de fusão de -37°C e um ponto de ebulição de 155°C.
Em relação à nomenclatura, o anisol é classificado como um éter, de acordo com a IUPAC. Seu nome oficial é metoxibenzeno, mas também pode ser chamado de fenilmetiléter.
Quanto aos usos, o anisol é amplamente utilizado na indústria de cosméticos e perfumaria, devido ao seu odor agradável. Também é empregado como solvente em diversas aplicações industriais.
Em relação aos riscos, o anisol pode causar irritação na pele e nos olhos em caso de contato. Além disso, a inalação de vapores concentrados pode levar a dores de cabeça e tonturas.
Em resumo, o anisol, ou metoxibenzeno, é um composto químico versátil com diversos usos industriais, mas que deve ser manuseado com cuidado devido aos seus potenciais riscos à saúde.
Estrutura molecular do Etoxibenzeno: fórmula química simplificada e visualmente explicada.
O Etoxibenzeno, também conhecido como fenetil-éter, é um composto orgânico que possui uma estrutura molecular representada pela fórmula química C8H10O. Visualmente, podemos descrever sua estrutura da seguinte forma: um anel de benzeno (C6H5) ligado a um grupo etoxi (-OCH2CH3) em uma de suas posições.
O Anisol, por sua vez, é um éter de metilfenetil, com a fórmula C7H8O e estrutura semelhante ao Etoxibenzeno, mas com apenas um grupo metoxi (-OCH3) ligado ao anel de benzeno. Este composto é amplamente utilizado na indústria de cosméticos e na produção de fragrâncias, devido ao seu aroma agradável e propriedades químicas favoráveis.
A nomenclatura IUPAC para o Anisol é metoxibenzeno, indicando a presença do grupo metoxi na molécula. Suas propriedades incluem um ponto de fusão de -37,5°C e um ponto de ebulição de 155°C, tornando-o um líquido volátil em condições ambientes.
Apesar de ser amplamente utilizado na indústria, o Anisol também apresenta alguns riscos à saúde, como irritação da pele e dos olhos em contato direto. Portanto, é importante manuseá-lo com cuidado e seguir as medidas de segurança recomendadas.
Em resumo, o Anisol é um éter comum na indústria de cosméticos, com propriedades químicas e físicas bem definidas. Sua estrutura molecular simples e sua versatilidade o tornam um composto de grande interesse para diversos setores industriais.
Propriedades e aplicações do Metoxietano: um solvente versátil em diversas indústrias.
O Metoxietano, também conhecido como Anisol, é um solvente versátil amplamente utilizado em diversas indústrias devido às suas propriedades únicas. Com uma fórmula química de C3H8O, o Metoxietano é um líquido incolor com um odor característico e inflamável.
Entre as principais propriedades do Metoxietano, podemos destacar sua capacidade de dissolver uma ampla gama de compostos orgânicos e inorgânicos, tornando-o um solvente eficaz em processos de produção e limpeza. Além disso, o Metoxietano possui um ponto de ebulição relativamente baixo, o que facilita sua remoção após o uso.
Na indústria química, o Metoxietano é frequentemente utilizado na síntese de produtos farmacêuticos, cosméticos e produtos químicos. Além disso, é empregado na fabricação de tintas, vernizes e adesivos, devido à sua capacidade de proporcionar uma secagem rápida e uniforme.
Por outro lado, o Anisol é um composto orgânico que possui uma estrutura molecular simples, constituída por um anel de benzeno ligado a um grupo metoxi (-OCH3). Em termos de nomenclatura, o Anisol é conhecido como metil fenil éter.
Em relação aos riscos associados ao Anisol, é importante destacar que o contato prolongado com a pele ou a inalação de vapores pode causar irritação e danos à saúde. Portanto, é essencial manipular o Anisol com cuidado e seguir as medidas de segurança recomendadas.
Quanto aos usos do Anisol, este composto é amplamente empregado na indústria de fragrâncias e aromas, devido ao seu odor agradável e duradouro. Além disso, o Anisol é utilizado na produção de produtos farmacêuticos, na fabricação de plásticos e na indústria alimentícia como aditivo.
Em resumo, o Metoxietano e o Anisol são solventes versáteis com propriedades únicas que os tornam essenciais em diversas indústrias. Portanto, é fundamental compreender suas características, aplicações e riscos associados para garantir um uso seguro e eficaz.
Anisol: estrutura, propriedades, nomenclatura, riscos e usos
O anisol ou metoxibenzeno é um composto orgânico constituído por um éter aromático tendo a fórmula química C 6 H 5 OCH 3 . Seu estado físico é o de um líquido incolor, que pode ter cor amarelada. É facilmente reconhecido pelo seu cheiro característico de anis.
É então um composto volátil e forças de coesão não muito altas; características usuais em éteres leves, armazenados em pequenos recipientes selados. Especificamente, o anisol é o mais simples dos éteres arilalquílicos; isto é, aqueles com um componente aromático (Ar) e outro componente alquil (R), Ar-OR.
O grupo C 6 H 5 – passa a denotar Ar e -CH 3 a R, tendo assim C 6 H 5 -O-CH 3 . O anel aromático e a presença de -OCH 3 como um grupo substituinte chamado metoxi, dá o anisol uma nucleofilicidade do que a de benzeno e nitrobenzeno. Portanto, serve como uma molécula intermediária para a síntese de compostos com atividade farmacológica.
Seu cheiro característico de anis foi usado para adicionar anisol a produtos cosméticos e de higiene que exigem uma fragrância agradável.
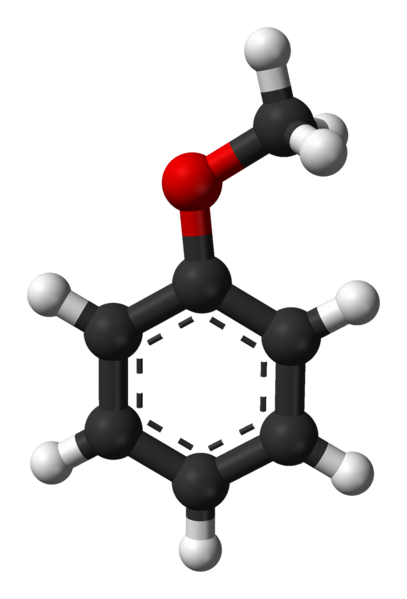
Estrutura Anisole
A estrutura molecular do anisol é mostrada na imagem acima por um modelo de esferas e barras. O anel aromático é apreciado, cujos carbonos são sp 2 e, portanto, é plano, como uma folha hexagonal; e ligado a ela, é o grupo metoxi, que é sp carbono 3 , e os seus hidrogénios estão acima ou abaixo do plano do anel.
A importância do grupo -OCH 3 na estrutura vai além da quebra com a geometria plana da molécula: confere polaridade e, conseqüentemente, a molécula de benzeno apolar adquire um momento dipolar permanente.
Momento dipolo
Esse momento dipolar é devido ao átomo de oxigênio, que atrai as densidades eletrônicas dos anéis aromático e metílico. Graças a isso, as moléculas de anisol podem interagir através de forças dipolo-dipolo; embora não possua a possibilidade de formar pontes de hidrogênio, porque é um éter (o ROR não tem H ligado ao oxigênio).
Seu alto ponto de ebulição (154ºC), certifica experimentalmente as fortes interações intermoleculares que governam seu líquido. Além disso, forças de dispersão de Londres, dependentes da massa molecular, e interações π-π entre os próprios anéis estão presentes.
Cristais
A estrutura do anisol, no entanto, não permite que ele interaja com força suficiente para adotar um sólido à temperatura ambiente (pf = -37 ° C). Isso também pode ser devido ao fato de que, quando as distâncias intermoleculares são reduzidas, as repulsões eletrostáticas entre os elétrons dos anéis aromáticos vizinhos começam a ganhar grande força.
Portanto, e de acordo com estudos cristalográficos, as moléculas de anisol em cristais a uma temperatura de -173 ° C não podem ser ordenadas de tal maneira que seus anéis estejam voltados um para o outro; isto é, os respectivos centros são não alinhados topo aromático um do outro, mas um grupo , -OCH 3 está acima ou abaixo de um anel vizinho.
Propriedades
Aparência física
Líquido incolor, mas que pode apresentar leves tons de palha.
Cheiro
Cheira um pouco semelhante a sementes de anis.
Sabor
Doce; no entanto, é moderadamente tóxico, portanto esse teste é perigoso.
Massa molecular
108.140 g / mol.
Densidade
0,995 g / mL.
Densidade de vapor
3,72 (em relação ao ar = 1).
Ponto de fusão
-37 ° C.
Ponto de ebulição
154 ° C.
Ponto de inflamação
125 ° C (copo aberto).
Temperatura de auto-ignição
475 ° C.
Viscosidade
0,778 cP a 30 ° C.
Tensão superficial
34,15 dines / cm a 30 ° C.
Refração Indica
1,5179 a 20 ° C.
Solubilidade
Pouco solúvel em água (cerca de 1 mg / mL). Em outros solventes, como acetona, éteres e álcoois, é no entanto muito solúvel.
Nucleofilicidade
O anel aromático do anisol é rico em elétrons. Isso ocorre porque o oxigênio, apesar de ser um átomo muito eletronegativo, contribui com os elétrons em sua nuvem π para realocá-los através do anel em numerosas estruturas de ressonância. Consequentemente, mais elétrons viajam através do sistema aromático e, portanto, aumentam sua nucleofilicidade.
Experimentalmente, o aumento da nucleofilicidade foi demonstrado pela comparação de sua reatividade, contra substituições eletrofílicas aromáticas, com a do benzeno. Assim, o efeito notável que possui o grupo , -OCH evidenciado 3 sobre as propriedades químicas do composto.
Da mesma forma, deve-se notar que as substituições eletrofílicas ocorrem nas posições adjacentes (-ort) e opostas (-para) do grupo metoxi; isto é, trata-se de orto-para diretor.
Reatividade
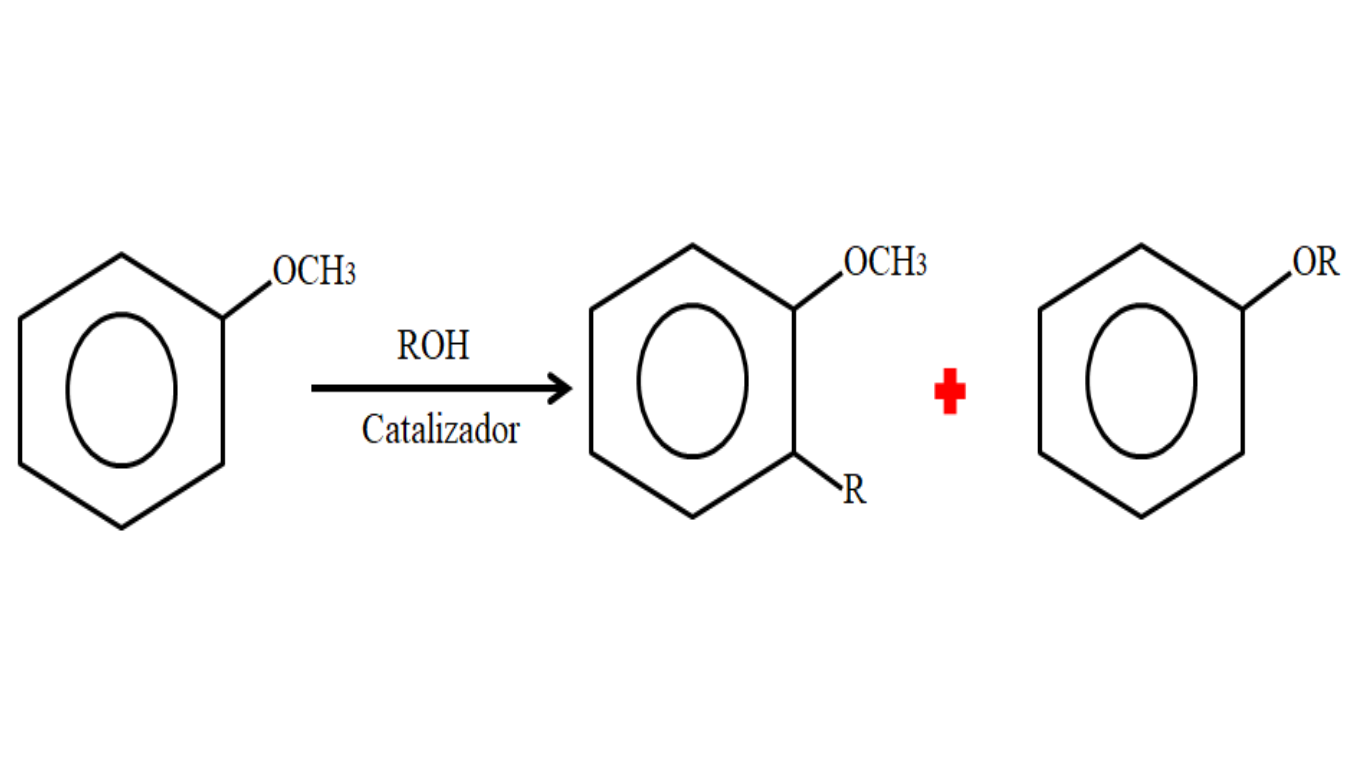
A nucleofilicidade do anel aromático do anisol já nos permite ver como é a sua reatividade. As substituições podem ocorrer no anel (favorecido por sua nucleofilicidade) ou no mesmo grupo metoxi; neste último a ligação O-H é quebrado 3 para substituir -CH 3 por um outro grupo alquilo: O-alquilação.
Portanto, em um anisol processo de alquilação pode aceitar um grupo R (outro fragmento de molécula) por substituição do H do anel (C-alquilao), ou por substitui o CH 3 do grupo metoxi. A imagem a seguir ilustra o que acabou de ser dito:
Na imagem, o grupo R está localizado na posição -ort, mas também pode estar na posição -para, oposto a -OCH 3 . Quando ocorre a alquilação de O, um novo éter é obtido com outro grupo -OR.
Nomenclatura
O nome ‘anisole’ é o mais conhecido e aceito, provavelmente derivado de seu cheiro semelhante a anis. No entanto, o nome “metoxibenzeno” é bastante específico, pois estabelece imediatamente qual é a estrutura e a identidade desse éter aromático; Este é o nome governado pela nomenclatura sistemática.
Outro nome menos usado, mas igualmente válido, é ‘fenilmetil éter’, que é governado pela nomenclatura tradicional. Isto é , talvez, a mais específica de todos nome como apontando directamente o que as duas partes estruturais de éter são: fenil-O-metilo, C 6 H 5 -O-CH 3 .
Riscos
Os estudos médicos ainda não foram capazes de demonstrar os possíveis efeitos fatais do anisol no organismo em doses baixas. No entanto, como quase todas as substâncias químicas, causa irritação quando exposto por muito tempo e em concentrações moderadas à pele, garganta, pulmões e olhos.
Além disso, devido à nucleofilicidade do seu anel, uma parte dele é metabolizada e, portanto, é biodegradável. De fato, após essas propriedades, as simulações mostraram que ele não se concentra nos ecossistemas aquosos desde que seus organismos o degradam; e, portanto, rios, lagos ou mares podem acumular anisol.
Nos solos, devido à sua volatilidade, evapora-se rapidamente e é levado pelas correntes de ar; sendo assim, também não afeta consideravelmente as massas vegetais ou plantações.
Por outro lado, ele reage atmosficamente com os radicais livres e, portanto, não representa um risco de contaminação pelo ar que respiramos.
Usos
Síntese orgânica
Outros derivados podem ser obtidos a partir do anisol por substituição eletrofílica aromática. Isso torna possível usá-lo como intermediário para a síntese de medicamentos, pesticidas e solventes, aos quais eles desejam adicionar suas características. As rotas sintéticas podem consistir principalmente em uma alquilação C ou O-alquilação.
Fragrâncias
Além de ser utilizado em sínteses orgânicas, pode ser usado diretamente como aditivo em cremes, pomadas e perfumes, incorporando fragrâncias de anis em tais produtos.
Referências
- Morrison, RT e Boyd, R., N. (1987). Quimica Organica. 5ª Edição. Editorial Addison-Wesley Interamerican.
- Carey FA (2008). Quimica Organica. (Sexta edição). Mc Graw Hill
- Graham Solomons TW, Craig B. Fryhle. (2011). Química Orgânica Aminas (10ª edição). Wiley Plus
- Centro Nacional de Informação Biotecnológica. (2019). Anisole Base de dados PubChem, CID = 7519. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Wikipedia (2019). Anisole Recuperado de: en.wikipedia.org
- Pereira, Cynthia CM, de la Cruz, Marcus HC e Lachter, Elizabeth R. (2010). Alquilação em fase líquida de anisol e fenol catalisada por fosfato de nióbio. Revista da Sociedade Brasileira de Química, 21 (2), 367-370. dx.doi.org/10.1590/S0103-50532010000200025
- Seidel RW e Goddard R. (2015). Anisol a 100 K: a primeira determinação da estrutura cristalina. Crystallogr C Struct Chem. Ago; 71 (Pt 8): 664-6. doi: 10.1107 / S2053229615012553
- Formulação química (2018). Metoxibenzeno Recuperado de: formulacionquimica.com