O arsênio é um elemento químico pertencente à família dos metaloides que tem uma longa história de uso em diversas aplicações. Conhecido desde a antiguidade, o arsênio tem propriedades únicas que o tornam útil em diferentes indústrias, como a de medicamentos, pesticidas, ligas metálicas, entre outros. Neste artigo, exploraremos a história, estrutura, propriedades e usos do arsênio, destacando a sua importância e impacto na sociedade ao longo dos séculos.
Usos do arsênio: onde e como é empregado esse elemento químico?
O arsênio é um elemento químico presente na tabela periódica com o símbolo As e número atômico 33. Conhecido desde a antiguidade, o arsênio tem uma história interessante e variada, sendo utilizado em diversas aplicações ao longo dos anos.
O arsênio é empregado em diferentes áreas, como na indústria de semicondutores, na fabricação de pigmentos, na produção de medicamentos e até mesmo na agricultura. No entanto, é importante ressaltar que o arsênio é altamente tóxico e seu uso deve ser controlado e regulamentado.
Na indústria de semicondutores, o arsênio é utilizado como dopante para modificar as propriedades elétricas de materiais semicondutores, como o silício. Já na fabricação de pigmentos, o arsênio é empregado na produção de corantes para tintas, plásticos e tecidos.
Em relação à medicina, o arsênio já foi utilizado no passado no tratamento de doenças como a sífilis e a leucemia. Atualmente, compostos de arsênio são estudados como possíveis agentes anticancerígenos, devido às suas propriedades antiproliferativas.
Na agricultura, o arsênio é utilizado como herbicida e pesticida, embora seu uso tenha sido restringido devido aos seus efeitos nocivos para a saúde humana e o meio ambiente.
Em suma, o arsênio é um elemento químico com uma história rica e variada, sendo empregado em diversas áreas, mas sempre com a ressalva de seus potenciais riscos à saúde e ao meio ambiente.
Arsênico: definição e usos na indústria, saúde e meio ambiente.
O Arsênico é um elemento químico que pertence ao grupo dos metaloides e possui símbolo As e número atômico 33. Sua descoberta remonta à antiguidade, sendo utilizado em diversos contextos ao longo da história. O Arsênico é conhecido por sua versatilidade e propriedades únicas, o que o torna um elemento de grande importância em diferentes áreas.
Em termos de estrutura, o Arsênico apresenta uma estrutura cristalina e é encontrado em diferentes formas, como branco, amarelo e preto. Suas propriedades físicas e químicas variam de acordo com a forma em que se encontra, o que influencia diretamente em seus usos e aplicações.
No que diz respeito aos usos do Arsênico, este elemento é amplamente utilizado na indústria, principalmente na produção de ligas metálicas, semicondutores e pesticidas. Na saúde, o Arsênico tem sido utilizado no tratamento de certas doenças, embora seu uso seja cada vez mais restrito devido aos seus efeitos tóxicos. No meio ambiente, o Arsênico pode ser encontrado naturalmente em solos e águas subterrâneas, sendo considerado um contaminante ambiental de grande preocupação.
É importante ressaltar que o Arsênico apresenta riscos à saúde humana e ao meio ambiente, sendo necessário o controle de sua utilização e descarte adequado para evitar danos. Portanto, é fundamental estar ciente dos potenciais impactos do Arsênico e buscar alternativas mais seguras e sustentáveis em seu uso.
Locais de ocorrência do arsênico na natureza e suas fontes de exposição.
Arsênico é um elemento químico encontrado na crosta terrestre e pode estar presente em diversos locais da natureza, tanto de forma natural quanto resultante da atividade humana. Suas principais fontes de exposição incluem a água, o solo e alimentos contaminados.
Na água, o arsênico pode estar presente devido à sua dissolução a partir de depósitos minerais subterrâneos. Em regiões onde a contaminação é mais grave, a exposição pode ocorrer através do consumo de água potável contaminada. Além disso, a irrigação de culturas com água contaminada pode levar à presença de arsênico nos alimentos.
No solo, o arsênico pode estar presente naturalmente, sendo liberado para o ambiente através de processos naturais como a erosão do solo. No entanto, a atividade humana, como a mineração e o uso de pesticidas contendo arsênico, também pode contribuir para a contaminação do solo e, consequentemente, dos alimentos cultivados nele.
Alimentos como arroz, frutos do mar e algas também podem conter arsênico, principalmente em regiões onde a contaminação do solo e da água é mais elevada. O consumo desses alimentos pode representar uma fonte significativa de exposição ao arsênico.
Em resumo, o arsênico pode ser encontrado em diversos locais da natureza, sendo suas principais fontes de exposição a água, o solo e alimentos contaminados. É importante estar atento a essas fontes e adotar medidas para reduzir a exposição a esse elemento químico.
Período do elemento químico arsênio na tabela periódica.
O arsênio é um elemento químico que pertence ao grupo dos não-metais e está localizado no período 4 da tabela periódica. Ele possui o símbolo As e número atômico 33.
Arsênico: história, estrutura, propriedades, usos
O arsênio tem uma longa história de uso na humanidade, sendo conhecido desde a antiguidade. Sua estrutura é semelhante à do fósforo, pertencendo ao mesmo grupo na tabela periódica. Suas propriedades incluem ser um sólido cinza prateado em sua forma natural, altamente tóxico e volátil.
Apesar de sua toxicidade, o arsênio tem diversos usos industriais, como na fabricação de pesticidas, medicamentos, ligas metálicas e semicondutores. Ele também é utilizado em processos de galvanização e na produção de vidro e cerâmica.
Em resumo, o arsênio é um elemento químico com um papel importante em várias indústrias, apesar de seus riscos à saúde. Seus usos são variados e sua história é rica em descobertas e aplicações.
Arsênico: história, estrutura, propriedades, usos
O arsénio é um semimetal semimetal ou pertencente ao grupo 15 ou VA da tabela periódica. É representado pelo símbolo químico As e possui um número atômico 33. Pode ser encontrado em três formas alotrópicas: amarelo, preto e cinza; sendo este o único com importância industrial.
O arsênico cinza é uma aparência metálica sólida, frágil, com uma cor de aço e cristalina (imagem abaixo). Ele perde seu brilho quando exposto ao ar, formando óxido de arsênio (As 2 O 3 ), que quando aquecido emite um cheiro a alho. Por outro lado, seus alótropos amarelos e pretos são moleculares e amorfos, respectivamente.

O arsênico é encontrado na crosta terrestre associada a vários minerais. Apenas uma pequena proporção está no estado nativo, porém associada ao antimônio e à prata.
Entre os minerais mais comuns em que o arsênico é encontrado estão os seguintes: realgar (As 4 S 4 ), o oropimento (As 2 S 3 ), a loellingita (FeAs 2 ) e a enargita (Cu 3 AsS 4 ). O arsênico também é obtido como um produto colateral da fundição de metais como chumbo, cobre, cobalto e ouro.
Os compostos de arsênico são tóxicos, especialmente a arsina (AsH 3 ). No entanto, o arsênico tem inúmeras aplicações industriais, incluindo liga com chumbo, usada na fabricação de baterias de automóveis, e liga com gálio com vários usos em eletrônicos.
História de sua descoberta
O nome ‘arsênico’ vem do latim arsenicum e do grego arsenikon, referindo-se ao orpimento amarelo, que era a principal forma de uso de arsênico pelos alquimistas.
O arsênico, muito antes de ser reconhecido como um elemento químico, era conhecido e utilizado na forma de seus compostos. Por exemplo, Aristóteles, no século IV aC, escreveu sobre o sandarache, uma substância que hoje se pensa ser sulfeto de arsênico.
Plínio, o Velho e Pedanius Discórides, no primeiro século dC, descreveu o orpimento, um mineral que consiste em As 2 S 3 . No século XI, três espécies de arsênico foram reconhecidas: branco (As 4 O 4 ), amarelo (As 2 S 3 ) e vermelho (As 4 S 4 ).
O arsênico como elemento puro foi observado pela primeira vez por Albertus Magnus (1250).Magnus aqueceu o sulfeto de arsênico com sabão, observando a aparência de uma substância com uma característica semelhante ao alótropo acinzentado da imagem. No entanto, o primeiro relatório autêntico de seu isolamento foi publicado em 1649 por Johann Schroeder, um farmacêutico alemão.
Schroeder preparou o arsênico aquecendo seu óxido com carvão. Posteriormente, Nicolas Lémery conseguiu produzi-lo aquecendo uma mistura de óxido de arsênico, sabão e potássio. No século XVIII, esse elemento foi finalmente reconhecido como um semimetal.
Estrutura de arsênico
O arsênico é isomórfico ao antimônio; isto é, estruturalmente são idênticos, diferindo apenas no tamanho de seus átomos. Cada átomo de arsênico forma três ligações covalentes As-As, de modo que elas originam unidades hexagonais hexagonais ” 6 enrugadas ou íngremes”, pois a hibridação dos átomos de As é sp 3 .
Em seguida, as unidades As 6 são conectadas, dando origem a camadas de arsênico, que interagem fracamente entre si. Devido às suas forças intermoleculares, dependentes principalmente de suas massas atômicas, os cristais romboédricos de arsênico cinza dão ao sólido uma textura frágil e quebradiça.
Possivelmente devido às repulsões do par de elétrons sem arsênico, as unidades As 6 formadas entre camadas paralelas não definem um octaedro perfeito, mas distorcem:
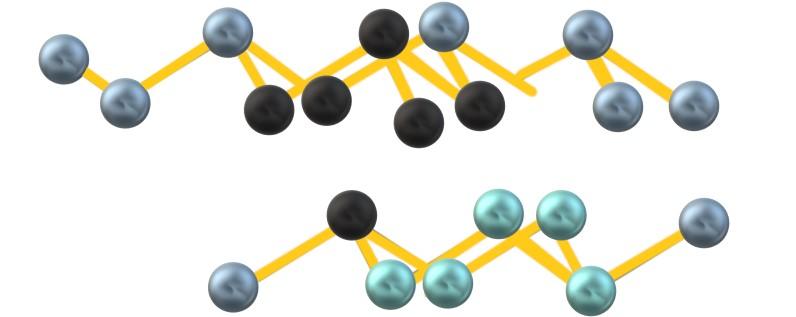
Observe que as esferas pretas desenham o plano distorcido no espaço entre duas camadas simples. Além disso, na camada abaixo, existem esferas azuladas que, juntamente com o mostrador preto, compõem a unidade As 6 mencionada no início da seção.
A estrutura parece arrumada, as fileiras sobem e descem e, portanto, é cristalina. No entanto, pode se tornar amorfo, com esferas espremidas de maneiras diferentes. Quando o arsênico acinzentado se torna amorfo, ele se torna um semicondutor.
Arsênico amarelo
O arsênico amarelo, o alótropo mais tóxico desse elemento, é um sólido puramente molecular. Consiste em moléculas de unidades As 4 devido a forças de dispersão fracas, que não as impedem de volatilizar.
Arsênico preto
O arsênico preto é amorfo; mas não como pode ser o alótropo acinzentado. Sua estrutura é ligeiramente semelhante à descrita acima, com a diferença de que seus planos de unidades As 6 têm áreas maiores e diferentes padrões de desordem.
Configuração eletrônica
[Ar] 3d 10 4s 2 4p 3
Tem todos os orbitais de nível 3 preenchidos. Forme ligações usando os orbitais 4s e 4p (como o 4d) através de diferentes hibridizações químicas.
Propriedades
Peso molecular
74,922 g / mol
Descrição física
O arsênico cinza é um sólido acinzentado, com aparência metálica e consistência frágil.
Cor
Três formas alotrópicas, amarelo (alfa), preto (beta) e cinza (gama).
Cheiro
WC
Sabor
Insípido
Ponto de fusão
1.090 K a 35,8 atm (ponto triplo de arsênico).
À pressão normal, não possui ponto de fusão, uma vez que sublima 887 K.
Densidade
cinzento -Arsenic: 5,73 g / cm 3 .
Amarelo -Arsenic: 1,97 g / cm 3 .
Solubilidade em água
Insolúvel
Raio atômico
139 pm
Volume atômico
13,1 cm 3 / mol
Raio covalente
120 pm
Calor específico
0,328 J / g · mol a 20 ° C
Calor por evaporação
32,4 kJ / mol
Eletronegatividade
2.18 na escala de Pauling
Energia de ionização
Primeira energia de ionização 946,2 kJ / mol
Estados de oxidação
-3, +3, +5
Estabilidade
O arsênico elementar é estável no ar seco, mas quando exposto ao ar úmido, é revestido com uma camada de bronze amarelo que pode se tornar uma camada preta de óxido de arsênico (As 2 O 3 ).
Decomposição
Quando o arsênico é aquecido até a decomposição, emite uma fumaça branca de As 2 O 3 . O procedimento é perigoso porque arsina, um gás muito venenoso, também pode ser emitido.
Auto-ignição
180 ° C
Dureza
3.5 na escala de dureza de Mohs.
Reatividade
Não é atacado por ácido sulfúrico frio ou ácido clorídrico concentrado. Reage com ácido nítrico ou ácido sulfúrico quente, formando ácido arsênico e ácido arsênico.
Quando o arsênico cinza é volatilizado pelo aquecimento e os vapores são resfriados rapidamente, um arsênico amarelo é formado. Isso retorna à forma cinza, quando submetido à luz ultravioleta.
Usos
Ligas
Uma pequena quantidade de arsênico adicionada ao chumbo endurece suas ligas o suficiente para uso no revestimento de cabos e no desenvolvimento de baterias de automóveis.
A adição de arsênico ao latão, uma liga de cobre e zinco, aumenta sua resistência à corrosão. Por outro lado, corrige ou diminui a perda de zinco no latão, o que causa um aumento na sua vida útil.
Eletrônicos
O arsênio purificado é usado na tecnologia de semicondutores, onde é usado em conjunto com gálio e germânio, bem como na forma de arseneto de gálio (GaAs), que é o segundo semicondutor mais utilizado.
Os GaAs têm um intervalo de banda direto, que pode ser usado na fabricação de diodos, lasers e LEDs. Além do arseneto de gálio, existem outros arsenetos, como o arseneto de índio e o arseneto de alumínio, que também constituem semicondutores III-V.
Enquanto isso, o arseneto de cádmio é um semicondutor tipo II-IV. Arsine tem sido usado no doping de semicondutores.
Agricultura e conservação da madeira
A maioria das aplicações foi descartada devido à sua alta toxicidade e à de seus compostos. O As 2 O 3 tem sido usado como pesticida, enquanto o As 2 O 5 é um ingrediente em herbicidas e inseticidas.
O ácido arsênico (H 3 AsO 4 ) e sais como arsenato de cálcio e arsenato de chumbo têm sido utilizados para esterilizar solos e controlar pragas. Isso cria um risco de contaminação ambiental com arsênico.
O arseniato de chumbo foi usado como inseticida em árvores frutíferas, até a primeira metade do século XX. Porém, devido à sua toxicidade, foi substituído pelo metilarsenato de sódio, que deixou de ser utilizado pelo mesmo motivo desde 2013.
Medicinal
Até o século XX, vários de seus compostos eram usados como remédios. Arsfenamina e neolsalvarsan, por exemplo, foram utilizados no tratamento de sífilis e tripanossomíase.
Em 2000, o uso de As 2 O 3 , um composto muito tóxico , foi aprovado no tratamento de leucemia promielocítica aguda resistente ao ácido all-trans retinóico. Recentemente, o isótopo radioativo 74 As foi usado para localização de tumores.
O isótopo produz boas imagens, mais nítidas do que as obtidas com 124 I, porque o iodo é levado para a tireóide e produz ruído no sinal.
Outros usos
O arsênico era usado no passado como aditivo na alimentação de aves e suínos.
É usado como catalisador na fabricação de óxido de etileno. Também é usado em pirotecnia e bronzeamento. O óxido de arsênio é usado como alvejante na fabricação de vidro.
Onde está?
O arsênico pode ser encontrado em pequenas quantidades no estado elementar, com um alto grau de pureza. Está presente em inúmeros compostos, como: sulfetos, arsenetos e sulfoarseniidas.
Também é encontrado em vários minerais, incluindo: arsenopirita (FeSAs), loellingita (FeAs 2 ), enargita (Cu 3 AsS 4 ), oropimento (As 2 S 3 ) e realgar (As 4 S 4 ).
Como você consegue isso?
O arsenopirita é aquecido a 650-700 ° C, na ausência de ar. O arsênico evapora, deixando sulfeto de ferro (FeS) como um resíduo. Durante esse processo, o arsênico se liga ao oxigênio para formar As 4 O 6 , conhecido como “arsênico branco”.
Como 4 O 6 é modificado para formar As 2 O 3 , cujos vapores são coletados e condensados em um conjunto de câmaras de tijolos, sendo o arsênico purificado por sublimação.
A maior parte do arsênico é produzida pela redução de carbono do pó formado a partir de As 2 O 3 .
Referências
- Stephen R. Marsden (23 de abril de 2019). Química do arsênico. Química LibreTexts. Recuperado de: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (3 de dezembro de 2018). Fatos interessantes sobre o arsênico. Recuperado de: thoughtco.com
- Wikipedia (2019). Arsênico Recuperado de: en.wikipedia.org
- Dr. Dough Stewart. (2019). Fatos do elemento arsênico. Chemicool Recuperado de: chemicool.com
- Sociedade Real de Química. (2019). Arsênico Recuperado de: rsc.or
- Os editores da Encyclopaedia Britannica. (3 de maio de 2019). Arsênico Encyclopædia Britannica. Recuperado de: britannica.com