O brometo de lítio é um composto químico formado pela ligação do lítio com o bromo, sendo representado pela fórmula LiBr. Apresenta-se na forma de um sólido cristalino incolor ou branco e é altamente solúvel em água. Suas principais propriedades incluem sua capacidade de agir como um agente redutor e reagir com ácidos para formar brometo de hidrogênio.
Este composto é amplamente utilizado em diversas aplicações, tais como na produção de medicamentos, na síntese de compostos orgânicos, em processos de galvanoplastia e na indústria farmacêutica. No entanto, o brometo de lítio também apresenta riscos à saúde, como irritação da pele e dos olhos, efeitos nocivos à saúde respiratória e toxicidade em caso de ingestão. Portanto, é importante manuseá-lo com cuidado e seguir todas as medidas de segurança recomendadas.
Usos do lítio na indústria e na medicina: para que serve?
O lítio é um elemento químico amplamente utilizado na indústria e na medicina devido às suas propriedades únicas. Na indústria, o lítio é utilizado na fabricação de baterias recarregáveis, lubrificantes de alta temperatura, cerâmicas e vidros especiais. Já na medicina, o lítio é utilizado no tratamento de transtornos mentais, como o transtorno bipolar, devido às suas propriedades estabilizadoras do humor.
Brometo de lítio: estrutura, propriedades, usos, riscos
O brometo de lítio é um composto químico formado pela ligação do lítio com o bromo. Possui propriedades higroscópicas, ou seja, tem a capacidade de absorver umidade do ar. É utilizado na indústria farmacêutica como sedativo e no tratamento de envenenamento por lítio. Além disso, o brometo de lítio é utilizado na fabricação de sais de lítio para baterias recarregáveis.
Apesar de seus usos benéficos, o brometo de lítio também apresenta riscos à saúde. A exposição prolongada ao composto pode causar irritação na pele, nos olhos e no trato respiratório. Além disso, o consumo excessivo de brometo de lítio pode levar a sintomas como náuseas, vômitos e fraqueza muscular.
Benefícios do lítio: descubra as utilidades desse elemento na ciência e indústria.
O lítio é um elemento químico presente na tabela periódica com símbolo Li e número atômico 3. Conhecido por suas propriedades únicas, o lítio possui uma série de benefícios em diversas áreas, incluindo a ciência e a indústria.
Na ciência, o lítio é amplamente utilizado em pesquisas e aplicações devido à sua capacidade de interagir com outras substâncias e formar compostos estáveis. Um dos principais benefícios do lítio na ciência é sua utilização em baterias recarregáveis de íon-lítio, que são amplamente empregadas em dispositivos eletrônicos, veículos elétricos e armazenamento de energia renovável.
Além disso, o lítio é utilizado na indústria farmacêutica para o tratamento de transtornos mentais, como o transtorno bipolar. O carbonato de lítio é um dos medicamentos mais comuns utilizados para estabilizar o humor e prevenir episódios de mania e depressão.
Outra aplicação importante do lítio na indústria é na produção de ligas metálicas, que são utilizadas na fabricação de aviões, foguetes e equipamentos militares. O lítio também é empregado na produção de vidros especiais, como o vidro de lítio-alumínio-silicato, que possui alta resistência química e térmica.
Em resumo, o lítio é um elemento versátil e essencial em diversas áreas, contribuindo para o avanço da ciência e tecnologia. Seus benefícios na indústria e na medicina são inegáveis, tornando-o um elemento indispensável em nossa sociedade moderna.
Brometo de lítio: estrutura, propriedades, usos, riscos.
Características do minério de lítio: o que você precisa saber sobre essa substância.
O lítio é um metal alcalino encontrado em diversos minerais, sendo o principal deles a espodumena. Este minério de lítio é uma fonte essencial para a produção de diferentes compostos de lítio, como o brometo de lítio.
O brometo de lítio é um composto químico inorgânico formado por um átomo de lítio e um de bromo, com fórmula LiBr. Sua estrutura cristalina é do tipo cubica centrada no corpo, o que confere propriedades únicas a essa substância.
Entre as propriedades do brometo de lítio, destacam-se sua alta solubilidade em água, seu ponto de fusão em torno de 550°C e sua capacidade de conduzir eletricidade quando fundido. Além disso, o LiBr é amplamente utilizado na indústria farmacêutica, em sistemas de refrigeração e como agente químico em reações de síntese orgânica.
No entanto, é importante ressaltar que o brometo de lítio apresenta alguns riscos à saúde, sendo irritante para a pele, olhos e vias respiratórias. Portanto, é fundamental manusear essa substância com cuidado e seguir as medidas de segurança recomendadas.
Em resumo, o brometo de lítio é um composto químico com diversas aplicações industriais, mas que requer atenção devido aos seus potenciais riscos à saúde. Conhecer suas propriedades e usos é essencial para garantir um manuseio seguro e eficiente dessa substância.
Descobrindo a origem natural do lítio: onde e como é encontrado na natureza.
O lítio é um elemento químico que possui origem natural e pode ser encontrado na natureza de diversas formas. Ele é encontrado principalmente em minerais como a petalita, a espodumena e a lepidolita. Além disso, o lítio também pode ser encontrado em salmouras de lagos salgados e em águas subterrâneas.
Para extrair o lítio dos minerais, é necessário realizar um processo de mineração e purificação. O minério de lítio é triturado e moído, e em seguida passa por um processo de flotação para separar os minerais de interesse. Após essa etapa, o lítio é concentrado e purificado, resultando em um produto final de alta qualidade.
A descoberta da origem natural do lítio foi fundamental para o desenvolvimento de diversas aplicações industriais. O lítio é amplamente utilizado na fabricação de baterias recarregáveis, devido à sua alta densidade de energia e baixa densidade. Além disso, o lítio também é utilizado na produção de ligas metálicas, na indústria cerâmica e na medicina.
É importante ressaltar que o lítio, assim como outros elementos químicos, apresenta riscos para a saúde e o meio ambiente. O excesso de exposição ao lítio pode causar irritação na pele, nos olhos e nas vias respiratórias. Além disso, o descarte inadequado de produtos contendo lítio pode contaminar o solo e a água, prejudicando o ecossistema.
Em resumo, o lítio é um elemento químico de origem natural encontrado em minerais e salmouras. Sua descoberta foi fundamental para o desenvolvimento de diversas aplicações industriais, mas é importante ter cuidado com os riscos associados ao seu uso e descarte.
Brometo de lítio: estrutura, propriedades, usos, riscos
O brometo de lítio é um sal neutro de um metal alcalino, cuja fórmula química é o LiBr. A fórmula expressa que seu sólido cristalino é composto de íons Li + e Br – na proporção de 1: 1. Seus cristais são brancos ou bege claro. É muito solúvel em água e também é um sal bastante higroscópico.
Esta última propriedade permite seu uso como dessecante em sistemas de ar condicionado e refrigeração. Da mesma forma, o brometo de lítio foi utilizado desde o início do século XX no tratamento de certos distúrbios da saúde mental e seu uso foi abandonado devido ao uso inadequado de sal.
O LiBr é produzido através do tratamento de carbonato de lítio, Li 2 CO 3 , com ácido bromídrico. Após o aquecimento do meio, precipita na solução aquosa como um hidrato.
Este sal irrita o contato com a pele e os olhos, enquanto causa a inalação da irritação do trato respiratório. A ingestão de sais de lítio pode causar náusea, vômito, diarréia e tontura.
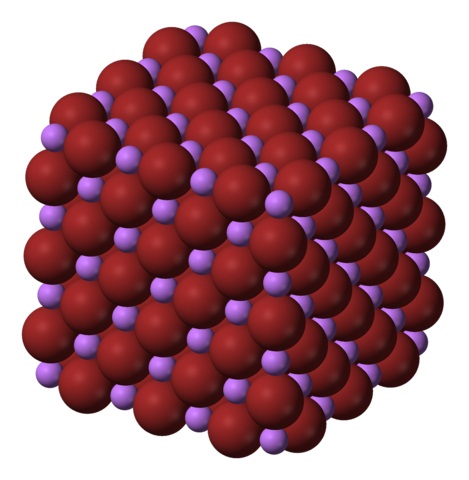
Estrutura de brometo de lítio
A fórmula LiBr deixa claro que a razão Li / Br é igual a 1; por cátions Li + deve ser um ânion Br – homólogo. Portanto, essa proporção deve ser mantida constante em todos os cantos do cristal LiBr.
Os iões Li + e Br – atraem uns aos outros, diminuindo repulsões entre cargas iguais, para assim fazer com que um tipo de cristal de sal gema cúbico; Isso é isomórfico para NaCl (imagem superior). Observe que todo o conjunto em si tem uma geometria cúbica.
Nesse cristal, o Li + é menor e tem uma cor violeta clara; enquanto os Br – são mais volumosos e de uma cor marrom intensa. Observa-se que cada íon tem seis vizinhos, o que é o mesmo que dizer que eles têm uma coordenação octaédrica: LiBr 6 ou Li 6 Br; no entanto, se a célula unitária for considerada, a razão Li / Br permanecerá 1.
Esta é a estrutura cristalina preferencialmente adotada pelo LiBr. No entanto, também pode formar outros tipos de cristais: wurzita, se cristalizar a baixas temperaturas (-50 ° C) em um substrato; ou cúbico centrado no corpo ou tipo CsCl, se o cristal cúbico do cristal de gema for submetido a alta pressão.
Hidratos e copos
O acima mencionado é aplicável ao LiBr anidro. Este sal é higroscópico e, portanto, pode absorver a umidade do ambiente, intercalando as moléculas de água dentro de seus próprios cristais. Assim, surgem hidratos de LiBr · nH 2 O (n = 1, 2, 3…, 10). Para cada hidrato, a estrutura cristalina é diferente.
Por exemplo, estudos cristalográficos determinado que o LiBr · H 2 O adopta uma estrutura tipo perovskite.
Quando esses hidratos estão em solução aquosa, eles podem ser super-resfriados e vitrificados; isto é, eles adotam uma estrutura que parece cristalina, mas molecularmente confusa. Sob tais condições, as pontes de hidrogênio na água se tornam bastante importantes.
Propriedades
Peso molecular
88.845 g / mol.
Aparência
Sólido cristalino bege branco ou claro.
Cheiro
WC
Ponto de fusão
552 ° C (1.026 ° F, 825 K).
Ponto de ebulição
1.256 ° C (2.309 ° F, 1.538 K).
Solubilidade em água
166,7 g / 100 mL a 20 ° C. Observe sua alta solubilidade.
Solubilidade em solventes orgânicos
Solúvel em metanol, etanol, éter e acetona. Levemente solúvel em piridina, composto aromático e menos polar que os anteriores.
Índice de refração (ηD)
1.784.
Capacidade calórica
51,88 J / mol · K.
Entropia molar padrão (S θ 298)
66,9 J / mol · K.
Ponto de inflamação
1.265 ° C. É considerado não inflamável.
Estabilidade
Estável. A forma anidra, no entanto, é extremamente higroscópica.
Decomposição
Quando se decompõe por aquecimento, causa óxido de lítio.
pH
Entre pH 6 e 7 em solução aquosa (100 g / L, 20 ° C).
Reatividade
O brometo de lítio não é reativo sob condições ambientais normais. No entanto, você pode experimentar reações intensas com ácidos fortes à medida que a temperatura aumenta.
Quando dissolvido em água, ocorre um aumento de temperatura, causado por uma entalpia negativa de hidratação.
Produção
O LiBr é produzido pela reação de hidróxido de lítio ou carbonato de lítio com ácido bromídrico em uma reação de neutralização:
Li 2 CO 3 + HBr => LiBr + CO 2 + H 2 O
O brometo de lítio é obtido como um hidrato. Para obter a forma anidra, é necessário aquecer o sal hidratado sob vácuo.
Nomenclatura
O nome “brometo de lítio” deriva do fato de ser um halogeneto de metal, nomeado após a nomenclatura das ações. Outros nomes, igualmente válidos, mas menos usados, são monobrometo de lítio, de acordo com a nomenclatura sistemática; e brometo de lítio (a valência única de +1 para o lítio), de acordo com a nomenclatura tradicional.
Usos
Dessecante
O LiBr é um sal higroscópico, formando uma salmoura concentrada capaz de absorver a umidade do ar em uma ampla faixa de temperaturas. Essa salmoura é usada como dessecante em sistemas de ar condicionado e refrigeração.
Fibras
É usado para aumentar o volume de lã, cabelos e outras fibras orgânicas.
Adutos Farmacêuticos
LiBr forma adutos com alguns compostos farmacêuticos, modulando sua ação. Um aducto é a combinação por coordenação de duas ou mais moléculas, sem alteração estrutural de nenhuma das moléculas ligadas.
Sedativo
O brometo de lítio foi inicialmente usado como sedativo em certos transtornos mentais, sendo descontinuado em 1940. Atualmente, o carbonato de lítio é usado; mas, em qualquer caso, o lítio é o elemento que exerce a ação terapêutica nos dois compostos.
O lítio é usado no tratamento do transtorno bipolar, tendo sido útil no controle de episódios maníacos do distúrbio. Pensa-se que o lítio iniba a atividade de neurotransmissores excitatórios, como dopamina e ácido glutâmico.
Por outro lado, aumenta a atividade do sistema inibitório mediado pelo neurotransmissor ácido gama-amino-butírico (GABA). Essas ações podem fazer parte da base da ação terapêutica do lítio.
Riscos
Toxicidade por contato
Irritação e sensibilização da pele, alergias. Lesões oculares graves ou irritação ocular nas vias aéreas, narinas e garganta.
Ingestão
Os principais sintomas da ingestão de brometo de lítio são: distúrbios gastrointestinais, vômitos e náusea. Outros efeitos adversos da ingestão de sal incluem agitação, espasmos e perda de consciência.
A condição conhecida como “bromismo” pode ocorrer com doses de brometo de lítio superiores a 225 mg / dia.
Alguns dos seguintes sintomas e sinais podem ocorrer no bromismo: exacerbação da acne e perda de apetite, tremor, problemas de fala, apatia, fraqueza e agitação maníaca.
Referências
- Formulação química (2019). Brometo de lítio Recuperado de: formulacionquimica.com
- David C. Johnson (10 de julho de 2008). Nova ordem para o brometo de lítio. Nature . doi.org/10.1038/454174a
- Aayushi Jain e RC Dixit. (sf). Transição de fase estrutural no brometo de lítio: efeito da pressão e da temperatura. [PDF]. Recuperado de: ncpcm.in
- Takamuku et al. (1997). Estudos de difração de raios X em soluções de brometo de lítio aquoso super-resfriadas e soluções de iodeto de lítio. Departamento de Química, Faculdade de Ciências, Universidade de Fukuoka, Nanakuma, Jonan-ku, Fukuoka 814-80, Japão.
- Centro Nacional de Informação Biotecnológica. (2019). Brometo de lítio PubChem Database, CID = 82050. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Wikipedia (2019). Brometo de lítio Recuperado de: en.wikipedia.org
- Sociedade Real de Química. (2019). Brometo de lítio Chemspider Recuperado de: chemspider.com