O bromo é um elemento químico pertencente ao grupo dos halogênios, apresentando o símbolo Br e o número atômico 35. Sua história remonta à descoberta em 1826 pelo químico francês Antoine-Jérôme Balard. O bromo é encontrado na natureza principalmente na forma de brometo de potássio e brometo de sódio.
Em relação à sua estrutura, o bromo possui um estado físico líquido à temperatura ambiente, sendo um líquido vermelho escuro altamente volátil e tóxico. Sua configuração eletrônica é [Ar] 4s² 3d¹⁰ 4p⁵.
O bromo possui diversas propriedades químicas e físicas, como alta reatividade, capacidade de formar compostos estáveis, e ser um excelente agente oxidante. Além disso, é utilizado em diversos setores, como na indústria farmacêutica, na produção de produtos químicos, na fabricação de corantes e na síntese de compostos orgânicos.
Em resumo, o bromo é um elemento químico essencial com diversas aplicações industriais, propriedades únicas e uma história interessante de descoberta e desenvolvimento.
Descubra a origem do elemento químico bromo e suas propriedades únicas.
O bromo é um elemento químico que pertence ao grupo dos halogênios e possui o símbolo Br na tabela periódica. Sua origem remonta ao século XIX, quando foi isolado pela primeira vez pelo químico francês Antoine-Jérôme Balard em 1826. O nome bromo deriva do grego “bromos”, que significa “mau cheiro”, devido ao odor forte e desagradável que o elemento possui.
O bromo é um líquido volátil de cor vermelha escura à temperatura ambiente e é altamente reativo, podendo reagir violentamente com outros elementos. Sua estrutura molecular é formada por moléculas diatômicas Br2, que são compostas por dois átomos de bromo ligados covalentemente.
A configuração eletrônica do bromo é [Ar] 4s2 3d10 4p5, o que significa que possui sete elétrons na camada de valência. Isso torna o bromo altamente reativo, especialmente na busca por um elétron adicional para completar sua camada de valência.
As propriedades únicas do bromo incluem seu baixo ponto de fusão e ebulição, sua capacidade de formar compostos estáveis com metais alcalinos e sua capacidade de reagir com compostos orgânicos para formar brometos orgânicos.
O bromo é amplamente utilizado na indústria química para a produção de corantes, pesticidas, medicamentos e produtos farmacêuticos. Além disso, é utilizado na fabricação de produtos para tratamento de água e na indústria de fotografia.
Em resumo, o bromo é um elemento químico fascinante com uma história rica, propriedades únicas e uma ampla gama de usos na indústria moderna.
Descubra a distribuição eletrônica do bromo, elemento químico da tabela periódica.
O bromo é um elemento químico que pertence ao grupo dos halogênios na tabela periódica. Sua história remonta à descoberta por Antoine Balard em 1826, e desde então tem sido utilizado em diversas aplicações industriais e medicinais.
A estrutura do bromo consiste em átomos com 35 elétrons e 35 prótons, resultando em uma distribuição eletrônica de 2-8-18-7. Isso significa que o bromo possui dois elétrons na primeira camada, oito na segunda, dezoito na terceira e sete na camada mais externa.
As propriedades do bromo incluem sua coloração vermelho-acastanhada em estado líquido e seu forte odor característico. Além disso, o bromo é altamente reativo e tóxico, sendo necessário manuseá-lo com cuidado.
Os principais usos do bromo incluem a produção de produtos químicos, como pesticidas e produtos farmacêuticos, bem como na fabricação de retardantes de chama. Sua capacidade de reagir facilmente com outros elementos o torna uma substância versátil em diversas indústrias.
Em resumo, a configuração eletrônica do bromo, juntamente com suas propriedades únicas e aplicações industriais, fazem dele um elemento químico de grande importância no cenário químico atual.
Qual é a valência do elemento químico bromo (Br)?
O elemento químico bromo (Br) possui valência -1. Isso significa que ele tem a capacidade de ganhar um elétron para completar sua camada de valência e atingir a estabilidade. O bromo pertence ao grupo 17 da tabela periódica, também conhecido como grupo dos halogênios. Os elementos desse grupo possuem sete elétrons na camada de valência, o que os torna altamente reativos.
O bromo foi descoberto em 1826 por Antoine-Jérôme Balard, e recebeu esse nome devido ao seu cheiro característico, que em grego significa “cheiro forte”. Sua estrutura é formada por moléculas diatômicas de Br2, e sua configuração eletrônica é 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5.
Entre as propriedades do bromo, destacam-se sua cor avermelhada, seu estado líquido em temperatura ambiente, sua alta reatividade e seu alto ponto de ebulição. O bromo é amplamente utilizado na indústria química para a produção de compostos orgânicos, como pesticidas, corantes e medicamentos.
Além disso, o bromo é empregado na fabricação de produtos para tratamento de água, na produção de plásticos e na indústria fotográfica. Sua valência -1 permite que ele forme facilmente compostos iônicos e covalentes com outros elementos, ampliando sua aplicação em diversas áreas.
Bromo: Em que estado físico se encontra?
O Bromo é um elemento químico que se encontra no estado físico líquido à temperatura ambiente. Ele possui o número atômico 35 e é representado pela letra Br na tabela periódica.
A história do Bromo remonta ao século XIX, quando foi isolado pela primeira vez por Antoine Balard. Sua estrutura é composta por átomos de bromo ligados entre si por meio de ligações covalentes.
A configuração eletrônica do Bromo é 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5, o que lhe confere propriedades únicas. Entre suas propriedades estão a cor avermelhada, o odor característico e a toxicidade em altas concentrações.
O Bromo é amplamente utilizado na indústria química para a produção de compostos orgânicos, como solventes, medicamentos e produtos agrícolas. Além disso, também é empregado na fabricação de produtos de limpeza e na indústria fotográfica.
Bromo: história, estrutura, configuração eletrônica, propriedades, usos
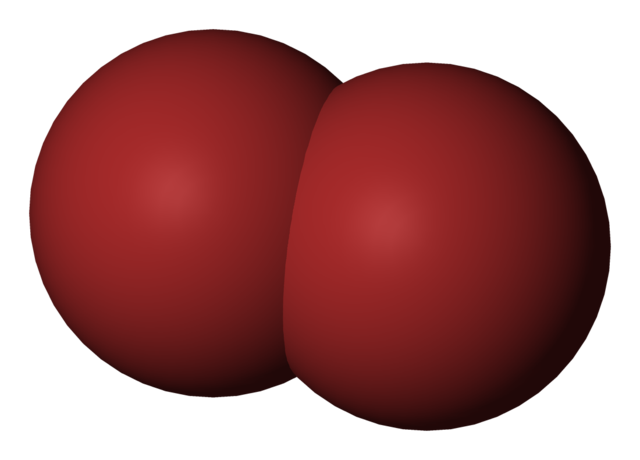
O bromo é um elemento não metálico pertencente ao do grupo de halogéneos, grupo 17 (VIIA) da Tabela Periódica. Seu símbolo químico é Br. É apresentada como uma molécula diatômica, cujos átomos são unidos por uma ligação covalente, de modo que é atribuída a fórmula molecular Br 2 .
Ao contrário do flúor e do cloro, o bromo em condições terrestres não é um gás, mas um líquido marrom-avermelhado (imagem abaixo). É fumante e é junto com mercúrio, os únicos elementos líquidos. Abaixo dele, o iodo, embora sua cor se intensifique e fique roxa, pode cristalizar em um sólido volátil.

O bromo foi descoberto, independentemente, em 1825 por Carl Löwig, que estudou sob a direção do químico alemão Leopold Gmelin; e em 1826, pelo químico francês Antoine-Jérome Balard. No entanto, a publicação dos resultados experimentais de Balard precedeu a de Löwig.
O bromo é o 62º elemento mais abundante da Terra, sendo distribuído em baixas concentrações por toda a crosta terrestre. No mar, a concentração média é de 65 ppm. O corpo humano contém 0,0004% de bromo, sua função não é definitivamente conhecida.
Este elemento é explorado comercialmente em salmoura ou em locais que, devido a condições especiais, são locais de alta concentração de sais; por exemplo, o Mar Morto, para o qual convergem as águas dos territórios vizinhos, saturado com sais.
É um elemento corrosivo capaz de atacar metais, como platina e paládio. Dissolvido em água, o bromo também pode exercer sua ação corrosiva nos tecidos humanos, agravando a situação porque o ácido bromídrico pode ser gerado. Em relação à sua toxicidade, pode causar danos significativos a órgãos, como fígado, rins, pulmão e estômago.
O bromo é muito prejudicial na atmosfera, sendo 40-100 vezes mais destrutivo para a camada de ozônio que o cloro. Metade da perda da camada de ozônio na Antártica é causada por reações relacionadas ao bromometil, um composto usado como fumigante.
Possui vários usos, tais como: retardante de fogo, agente de branqueamento, desinfetante de superfície, aditivo de combustível, intermediário na fabricação de sedativos, na fabricação de produtos químicos orgânicos, etc.
História
Trabalho de Carl Löwig
O bromo foi descoberto de forma independente e quase simultânea por Carl Jacob Löwig, químico alemão em 1825, e por Antoine Balard, químico francês em 1826.
Carl Löwig, discípulo do químico alemão Leopold Gmelin, coletou água de uma nascente de Bad Kreuznach e adicionou cloro; Após a adição de éter, a mistura líquida foi agitada.
Em seguida, o éter foi removido por destilação e concentrado por evaporação. Como resultado, ele obteve uma substância marrom avermelhada, que era o bromo.
O trabalho de Antoine Balard
Balard, enquanto isso, usava cinzas de algas marrons conhecidas como fucus e as misturava com salmoura, extraídas das salinas de Montpellier. Assim bromo libertado, cloro, passando através do material aquoso, em extracção, o que era brometo de magnésio presente, MgBr 2 .
Posteriormente, o material foi destilado na presença de dióxido de manganês e ácido sulfúrico, produzindo vapores vermelhos que se condensavam em um líquido escuro. Balard achou que era um novo elemento e o chamou muride, derivado da palavra latina muria, com a qual foi designado salmoura.
Foi apontado que Balard mudou o nome de muride para brôme por sugestão de Anglada ou Gay-Lussac, com base no fato de que brôme significa pestilento, que define o cheiro do elemento descoberto.
Os resultados foram publicados por Belard em Annales of Chemie and Physique, antes de Löwig publicar o seu.
Somente a partir de 1858, o bromo foi produzido em quantidades significativas; ano em que os depósitos de sal de Stassfurt foram descobertos e explorados, obtendo bromo como subproduto do potássio.
Estrutura e configuração eletrônica do bromo
Molécula
A molécula de bromo, Br 2 , com um modelo de enchimento compacto é mostrada na imagem acima . Na verdade, existe uma ligação covalente simples entre os dois átomos de bromo, Br-Br.
Sendo uma molécula homogênea e diatômica, carece de momento dipolar permanente e só pode interagir com outros do mesmo tipo pelas forças de dispersão de Londres.
Esta é a razão pela qual seu líquido avermelhado está fumando; nas moléculas de Br 2 , embora sejam relativamente pesadas, suas forças intermoleculares as mantêm fracamente unidas.
O bromo é menos eletronegativo que o cloro e, portanto, exerce um efeito menos atraente nos elétrons das camadas de valência. Como resultado, requer menos energia para transitar com níveis mais altos de energia, absorvendo fótons verdes e refletindo uma cor avermelhada.
Cristais
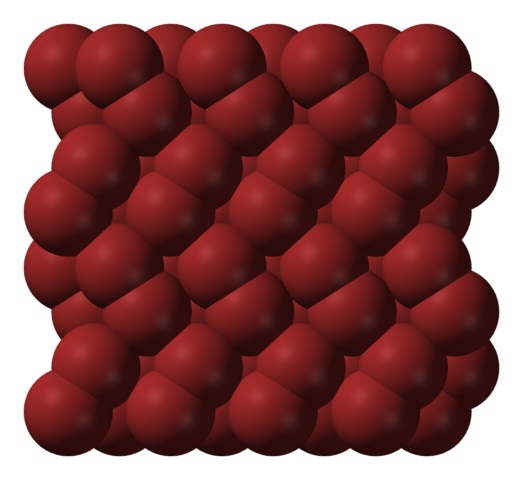
Na fase gasosa, as moléculas de Br 2 se separam consideravelmente até que haja interações eficientes entre elas. No entanto, abaixo do seu ponto de fusão, o bromo pode ser congelado em cristais ortorrômbicos avermelhados (imagem acima).
Observe como as moléculas de Br 2 estão posicionadas ordenadamente para que se pareçam com “vermes de bromo”. Aqui, nessas temperaturas (T <-7,2 ° C), as forças de dispersão são suficientes para que as vibrações das moléculas não quebrem o cristal no ato; mas ainda assim, vários deles constantemente sublimarão.
Camada de valência e estados de oxidação
A configuração eletrônica do bromo é:
[Ar] 3d 10 4s 2 4p 5
Sendo 3d 10 4s 2 4p 5 sua camada de valência (embora o 3d 10 orbital não tenha papel em suas reações químicas). Os elétrons dos orbitais 4s e 4p são os mais externos e somam um total de 7, apenas um elétron para completar o octeto de valência.
A partir dessa configuração, os possíveis estados de oxidação do bromo podem ser deduzidos: -1, se um elétron passar a ser isoeletrônico para o criptônio; +1, permanecendo como 3d 10 4s 2 4p 4 ; +3, +4 e +5, perdendo todos os elétrons do orbital 4p ([Ar] 3d 10 4s 2 4p 0 ); e +7, ficando sem elétrons no orbital 4s ([Ar] 3d 10 4s 0 4p 0 ).
Propriedades
Aspecto físico
Líquido de fumo marrom avermelhado escuro. É encontrado na natureza como uma molécula diatômica, com átomos unidos por uma ligação covalente. O bromo é um líquido mais denso que a água e afunda nele.
Peso atômico
79.904 g / mol.
Número atômico
35
Cheiro
Uma fumaça pungente, sufocante e irritante.
Ponto de fusão
-7,2 ° C.
Ponto de ebulição
58,8 ° C.
Densidade (Br 2 ) líquido
3,1028 g / cm 3
Solubilidade em água
33,6 g / L a 25 ° C. A solubilidade do bromo na água é baixa e tende a aumentar com a diminuição da temperatura; comportamento semelhante a outros gases.
Solubilidades
Livremente solúvel em álcool, éter, clorofórmio, tetracloreto de carbono, dissulfeto de carbono e ácido clorídrico concentrado. Solúvel em solventes não polares e alguns polares, como álcool, ácido sulfúrico e em muitos solventes halogenados.
Ponto triplo
265,9 K a 5,8 kPa.
Ponto crítico
588 K a 10,34 MPa.
Calor de derretimento (Br 2 )
10.571 kJ / mol.
Calor de vaporização (Br 2 )
29,96 kJ / mol.
Capacidade calórica molar (Br 2 )
75,69 kJ / mol.
Pressão de vapor
A uma temperatura de 270 K, 10 kPa.
Temperatura de auto ignição
Não inflamável
Ponto de inflamação
113 ° C.
Temperatura de armazenamento
De 2 a 8 ° C.
Tensão superficial
40,9 mN / m a 25 ° C.
Limiar de odor
0,05-3,5 ppm. 0,39 mg / m 3
Índice de refração (ηD)
1.6083 a 20 ° C e 1,6478 a 25 ° C.
Eletronegatividade
2,96 na escala de Pauling.
Energia de ionização
– Primeiro nível: 1.139,9 kJ / mol.
– Segundo nível: 2.103 kJ / mol.
– Terceiro nível: 3.470 kJ / mol.
Raio atômico
120 pm
Raio covalente
120.3 pm
Rádio Van der Waals
185 pm
Reatividade
É menos reativo que o cloro, mas mais reativo que o iodo. É um oxidante menos forte que o cloro e mais forte que o iodo. É também um agente redutor mais fraco que o iodo, mas mais forte que o cloro.
O vapor de cloro é altamente corrosivo para muitos materiais e tecidos humanos. Ataca muitos elementos metálicos, incluindo platina e paládio; mas não ataca chumbo, níquel, magnésio, ferro, zinco e, abaixo de 300 ° C, nem sódio.
O bromo na água sofre uma alteração e é transformado em brometo. Também pode existir como bromato (BrO 3 – ), dependendo do pH do líquido.
Devido à sua ação oxidante, o bromo pode induzir a liberação de radicais livres de oxigênio. Estes são oxidantes fortes e podem causar danos aos tecidos. Além disso, o bromo pode produzir uma ignição espontânea quando combinado com potássio, fósforo ou estanho.
Usos
Aditivo de gasolina
O dibrometo de etileno foi usado para eliminar possíveis depósitos de chumbo nos motores de automóveis. Após a combustão da gasolina, que usava chumbo como aditivo, o bromo combinado com o chumbo formava brometo de chumbo, um gás volátil que era expelido pelo tubo de escape.
Embora o bromo tenha removido o chumbo da gasolina, sua ação destrutiva sobre a camada de ozônio foi muito poderosa, razão pela qual foi descartada para esta aplicação.
Pesticidas
Metileno ou brometo de bromometil foram utilizados como pesticidas para purificar os solos, principalmente para eliminar nemátodos parasitas, como a ancilostomíase.
No entanto, o uso da maioria dos compostos contendo bromo foi descartado devido à sua ação destrutiva na camada de ozônio novamente.
Controle de emissão de mercúrio
O bromo é usado em algumas plantas para reduzir a emissão de mercúrio, um metal muito tóxico.
Fotografia
Brometo de prata, além de iodeto de prata e cloreto de prata, é usado como um composto sensível à luz em emulsões fotográficas.
Ações terapêuticas
O brometo de potássio, bem como o brometo de lítio, foram usados como sedativos gerais nos séculos XIX e XX. Brometos na forma de sais simples ainda são usados em alguns países como anticonvulsivantes.
No entanto, a FDA dos Estados Unidos não aprova o uso de bromo para o tratamento de qualquer doença atualmente.
Retardante de fogo
O bromo é transformado pelas chamas em ácido bromídrico, que interfere na reação de oxidação que ocorre durante o incêndio e causa sua extinção. Polímeros contendo bromo são usados para produzir resinas retardantes de fogo.
Aditivo alimentar
Traços de bromato de potássio foram adicionados à farinha para melhorar o cozimento.
Reagentes e intermediário químico
O brometo de hidrogênio é usado como agente redutor e catalisador para reações orgânicas. O bromo é usado como intermediário químico na fabricação de medicamentos, fluidos hidráulicos, agentes de refrigeração, desumidificadores e em preparações para cabelos ondulados.
Também é útil no desenvolvimento de fluidos de perfuração de poços, produtos de desinfecção de água, agentes de branqueamento, desinfetantes de superfície, corantes, aditivos de combustível, etc.
Ação biológica
Um estudo de 2014 indica que o bromo é um cofator necessário para a biossíntese do colágeno IV, o que torna o bromo um elemento essencial para o desenvolvimento do tecido animal. No entanto, não há informações sobre as consequências de um déficit de elemento.
Onde está
O bromo é extraído comercialmente de minas de sal e poços de salmoura profunda encontrados no estado de Arkansas e no Great Salt Lake de Utah, ambos nos Estados Unidos. Esta última salmoura tem uma concentração de bromo de 0,5%.
Para extrair o bromo, o cloro é adicionado no estado gasoso quente à salmoura, para oxidar os íons brometo da solução, coletando o bromo elementar.
O Mar Morto, na fronteira entre Jordânia e Israel, é um mar fechado que fica abaixo do nível do mar, o que faz com que ele tenha uma concentração muito alta de sais.
O bromo e a potassa são obtidos comercialmente por evaporação da água com alto teor de sal do Mar Morto. Neste mar, a concentração de bromo pode atingir 5 g / L.
Também é encontrado em altas concentrações em algumas fontes termais. O brominito, por exemplo, é um mineral de brometo de prata encontrado na Bolívia e no México.
Riscos
O bromo no estado líquido é corrosivo para os tecidos humanos. Mas o maior perigo para o homem vem dos vapores de bromo e de sua inalação.
Respirar em um ambiente com uma concentração de bromo de 11–23 mg / m 3 produz choques graves. Uma concentração de 30-60 mg / m 3 é extremamente prejudicial. Enquanto isso, uma concentração de 200 mg pode ser fatal.
Referências
- Shiver & Atkins. (2008). Química Inorgânica (Quarta edição). Mc Graw Hill
- Centro Nacional de Informação Biotecnológica. (2019). Bromo. Banco de Dados PubChem. CID = 23968. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Ross Rachel (8 de fevereiro de 2017). Fatos sobre o bromo. Recuperado de: livesscience.com
- Wikipedia (2019). Bórax Recuperado de: en.wikipedia.org
- Lenntech BV (2019). Bromo. Recuperado de: lenntech.com