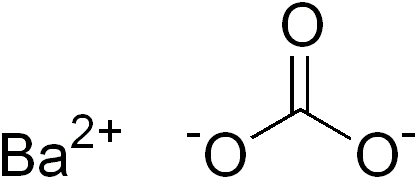O carbonato de bário é um composto químico inorgânico com a fórmula BaCO3. Ele é um sólido branco e cristalino, insolúvel em água, mas solúvel em ácidos. Suas propriedades incluem um ponto de fusão de aproximadamente 811°C e uma densidade de 4,29 g/cm3. O carbonato de bário é amplamente utilizado na indústria de vidro, na produção de produtos químicos, na fabricação de cerâmica e na metalurgia. Além disso, é empregado como um reagente em análises químicas e em outras aplicações industriais. Sua estrutura química é composta por um íon de bário e dois íons de carbonato.
Para que serve o bário e quais são suas principais aplicações na indústria e medicina?
O carbonato de bário é uma substância química composta por íons de bário e íons de carbonato. Sua fórmula química é BaCO3 e sua estrutura cristalina é cúbica. O carbonato de bário é um pó branco e inodoro, insolúvel em água, mas solúvel em ácidos.
O bário, elemento químico presente no carbonato de bário, possui várias aplicações na indústria e medicina. Na indústria, o bário é utilizado na produção de pigmentos, vidros especiais, cerâmicas e na fabricação de produtos químicos. Além disso, o bário é empregado em testes radiológicos, como o exame de bário, que ajuda a diagnosticar problemas no sistema digestivo.
Na medicina, o bário é utilizado como contraste em exames de imagem, como a radiografia de trato gastrointestinal. O contraste de bário permite a visualização de estruturas internas do corpo, auxiliando no diagnóstico de doenças e condições médicas. Além disso, o bário é empregado em tratamentos de certas intoxicações, atuando como antídoto para metais pesados.
Em resumo, o bário e o carbonato de bário desempenham um papel importante na indústria e medicina, sendo utilizados em diversas aplicações. Seja na produção de materiais industriais ou no diagnóstico de problemas de saúde, o bário é um elemento químico versátil e essencial para várias áreas.
Aplicações do bário em diferentes áreas e indústrias: conheça os principais usos desse elemento.
O bário é um elemento químico bastante versátil, com diversas aplicações em diferentes áreas e indústrias. Conheça a seguir os principais usos desse elemento tão importante para a sociedade.
Na indústria de petróleo e gás, o bário é utilizado na perfuração de poços como aditivo para fluidos de perfuração, ajudando a controlar a pressão e a estabilidade do poço. Além disso, é utilizado na produção de lubrificantes e na fabricação de produtos químicos.
Em medicina, o bário é utilizado em exames de imagem, como o raio-x gastrointestinal, onde o bário é ingerido pelo paciente para melhorar a visualização do trato digestivo. Também é utilizado em radioterapia para o tratamento de certos tipos de câncer.
No setor de eletrônicos, o bário é utilizado na fabricação de ímãs de bário-ferrita, que são amplamente utilizados em equipamentos eletrônicos, como alto-falantes e transformadores.
Na agricultura, o bário é utilizado como adubo, sendo essencial para o crescimento saudável das plantas. Além disso, é utilizado na fabricação de pesticidas e herbicidas.
Em resumo, o bário possui uma ampla gama de aplicações em diferentes áreas e indústrias, tornando-se um elemento indispensável para o desenvolvimento da sociedade.
Carbonato de bário: propriedades, estrutura química, usos
O carbonato de bário, cuja fórmula química é BaCO3, é um composto químico inorgânico que possui diversas propriedades e usos importantes. Sua estrutura química é formada por um átomo de bário, um átomo de carbono e três átomos de oxigênio.
Entre os principais usos do carbonato de bário estão a fabricação de vidros especiais, como os utilizados em tubos de raios-x, a produção de pigmentos para tintas e a fabricação de cerâmicas. Além disso, é utilizado como aditivo em plásticos e borrachas, melhorando suas propriedades mecânicas.
Por suas propriedades químicas únicas, o carbonato de bário é um composto essencial em diversas indústrias, contribuindo para o desenvolvimento de novos materiais e tecnologias. Sua versatilidade e eficácia fazem com que seja um dos compostos mais utilizados em processos industriais em todo o mundo.
Qual a importância do carbonato e qual sua função no meio ambiente?
O carbonato de bário é uma substância química de grande importância devido às suas diversas propriedades e usos. O carbonato é um composto químico formado por íons de carbono e oxigênio, e é amplamente utilizado em várias indústrias.
Uma das principais propriedades do carbonato de bário é a sua capacidade de ser um agente redutor em processos químicos. Além disso, o carbonato é utilizado na fabricação de vidro, cerâmica, tintas e até mesmo em produtos farmacêuticos.
No meio ambiente, o carbonato de bário pode ter um impacto significativo. Por um lado, o excesso de carbonato pode afetar a qualidade da água, tornando-a alcalina e prejudicando a vida aquática. Por outro lado, o carbonato pode ser utilizado como um agente de neutralização em processos de tratamento de água, ajudando a controlar o pH e remover impurezas.
Portanto, é importante compreender a importância do carbonato de bário e sua função no meio ambiente. Se usado de forma adequada, este composto químico pode trazer benefícios para diferentes indústrias e contribuir para a preservação do meio ambiente.
Característica química predominante do sulfato de bário: qual é a sua principal?
O carbonato de bário é um composto químico de fórmula BaCO3, que é amplamente utilizado em diversas aplicações industriais. Sua principal característica química é a presença do íon carbonato (CO3) ligado ao íon bário (Ba), formando uma estrutura cristalina.
O carbonato de bário é um sólido branco e inodoro, insolúvel em água e ácidos. Sua estrutura química consiste em um átomo de bário ligado a um átomo de carbono, que por sua vez está ligado a três átomos de oxigênio. Essa estrutura confere ao composto propriedades únicas que são exploradas em diversas aplicações.
Uma das principais aplicações do carbonato de bário é na indústria de vidro, onde é utilizado como fundente para reduzir a temperatura de fusão e melhorar a qualidade do vidro. Além disso, o composto também é empregado na fabricação de cerâmicas, esmaltes, pigmentos e produtos químicos.
Em resumo, o carbonato de bário é um composto químico com propriedades únicas devido à sua estrutura cristalina e à presença do íon carbonato. Suas aplicações são diversas e abrangem setores como a indústria de vidro, cerâmica e química, tornando-o uma substância importante no cenário industrial.
Carbonato de bário: propriedades, estrutura química, usos
O carbonato de bário é um sal inorgânico de bário metálico, elemento de penúltimo grupo 2 do quadro periódico e pertencente aos metais alcalino-terrosos. Sua fórmula química é BaCO 3 e está disponível comercialmente na forma de pó cristalino branco.
Como você consegue isso? O metal de bário é encontrado em minerais, como barita (BaSO 4 ) e whiterita (BaCO 3 ). O whiterito é associado a outros minerais que subtraem os níveis de pureza de seus cristais brancos em troca de corantes.

Para gerar BaCO 3 sintético , é necessário remover as impurezas do branco, conforme indicado pelas seguintes reações:
BaCO 3 (s, impuro) + 2NH 4 Cl (s) + Q (calor) => BaCl 2 (aq) + 2NH 3 (g) + H 2 O (l) + CO 2 (g)
BaCl 2 (aq) + (NH 4 ) 2 CO 3 (s) => BaCO 3 (s) + 2NH 4 Cl (aq)
A barita, no entanto, é a principal fonte de bário, e é por isso que a produção industrial de compostos de bário começa a partir dela. O sulfeto de bário (BaS) é sintetizado a partir deste mineral, um produto do qual resulta a síntese de outros compostos e BaCO 3 :
BaS (s) + Na 2 CO 3 (s) => BaCO 3 (s) + Na 2 S (s)
BaS (s) + CO 2 (g) + H 2 O (l) => BaCO 3 (s) + (NH 4 ) 2 S (aq)
Propriedades físicas e químicas
É um sólido em pó, branco e cristalino. É inodoro, insípido e seu peso molecular é de 197,89 g / mol. Tem uma densidade de 4,43 g / mL e uma pressão de vapor inexistente.
Possui índices de refração de 1.529, 1.676 e 1.677. O witherita emite luz quando absorve a radiação ultravioleta: de uma luz branca brilhante com tons azulados a uma luz amarela.
É altamente insolúvel em água (0,02 g / L) e em etanol. Em soluções ácidas de HCl a formar o sal solúvel de cloreto de bário (BaCl 2 ), o que explica a sua solubilidade em meio ácido estes. No caso de ácido sulfúrico, o sal insolúvel precipita como BaSO 4 .
BaCO 3 (s) + 2 HCl (aq) => BaCl 2 (aq) + CO 2 (g) + H 2 O (l)
BaCO 3 (s) + H 2 SO 4 (aq) => BaSO 4 (s) + CO 2 (g) + H 2 O (l)
Por ser um sólido iônico, também é insolúvel em solventes apolares. O carbonato de bário derrete a 811 ° C; se a temperatura subir em torno de 1380-1400 ° C, o líquido salgado sofre decomposição química em vez de ferver. Esse processo ocorre para todos os carbonatos metálicos: MCO 3 (s) => MO (s) + CO 2 (g).
Decomposição térmica
BaCO 3 (s) => BaO (s) + CO 2 (g)
Se os sólidos iônicos são caracterizados por serem muito estáveis, por que os carbonatos se decompõem? O metal M altera a temperatura na qual o sólido se decompõe? Os íons que compõem o carbonato de bário são Ba 2+ e CO 3 2– , ambos volumosos (isto é, com grandes raios iônicos). CO 3 2 – é responsável pela decomposição:
CO 3 2– (s) => O 2– (g) + CO 2 (g)
O íon óxido (O 2– ) se liga ao metal para formar MO, o óxido metálico. O MO gera uma nova estrutura iônica na qual, como regra geral, quanto mais semelhante o tamanho de seus íons, mais estável é a estrutura resultante (entalpia da rede). O oposto ocorre se os íons M + e O 2 tiverem raios iônicos muito desiguais.
Se a entalpia da rede para MO é grande, a reação de decomposição é favorecida energeticamente, exigindo temperaturas de aquecimento mais baixas (pontos de ebulição mais baixos).
Por outro lado, se MO tem uma pequena entalpia de rede (como no caso de BaO, onde Ba 2+ tem um raio iônico maior que O 2– ), a decomposição é menos favorecida e requer temperaturas mais altas (1380-1400ºC). Nos casos de MgCO 3 , CaCO 3 e SrCO 3 , eles se decompõem a temperaturas mais baixas.
Estrutura quimica
O ânion CO 3 2 tem uma ligação dupla ressoando entre três átomos de oxigênio, dois deles carregados negativamente para atrair o cátion Ba 2+ .
Embora os dois íons possam ser considerados esferas carregadas, o CO 3 2 – possui uma geometria do plano trigonal (o triângulo plano traçado pelos três átomos de oxigênio), possivelmente se tornando um “bloco” negativo para o Ba 2+ .
Esses íons interagem eletrostaticamente para formar um arranjo cristalino ortorrômbico, sendo as ligações predominantemente iônicas.
Nesse caso, por que o BaCO 3 não é solúvel em água? A explicação é simplesmente baseada no fato de que os íons são melhor estabilizados na rede cristalina do que hidratados por camadas esféricas moleculares de água.
Por outro ângulo, as moléculas de água acham difícil superar as fortes atrações eletrostáticas entre os dois íons. Dentro dessas redes cristalinas, eles podem abrigar impurezas que dão cor aos seus cristais brancos.
Usos
À primeira vista, uma parte do BaCO 3 pode não prometer nenhuma aplicação prática na vida cotidiana, mas se for observado um cristal de mineral branco, como o leite, a razão de sua demanda econômica começa a fazer sentido.
É usado para fazer vidros de bário ou como um aditivo para fortalecê-los. Também é usado na fabricação de vidros ópticos.
Devido à sua grande entalpia e insolubilidade na rede, é utilizado na fabricação de diferentes tipos de ligas, borrachas, válvulas, revestimentos de pisos, tintas, cerâmicas, lubrificantes, plásticos, graxas e cimentos.
Também é usado como veneno de rato. Em síntese, esse sal é usado para produzir outros compostos de bário e, portanto, serve como material para dispositivos eletrônicos.
O BaCO 3 pode ser sintetizado como nanopartículas, expressando escalas muito interessantes de whiterita em escalas muito pequenas. Essas nanopartículas são usadas para impregnar superfícies metálicas, especificamente catalisadores químicos.
Verificou-se que melhora os catalisadores de oxidação e, de alguma forma, favorece a migração de moléculas de oxigênio ao longo de sua superfície.
Eles são considerados instrumentos para acelerar os processos nos quais o oxigênio é incorporado. E, finalmente, eles são usados para sintetizar materiais supramoleculares.
Riscos
O BaCO 3 é venenoso se ingerido, causando um número infinito de sintomas desagradáveis que levam à morte devido a insuficiência respiratória ou parada cardíaca; Por esse motivo, não é recomendável transportar mantimentos.
Produz vermelhidão nos olhos e na pele, além de tosse e dor de garganta. É um composto tóxico, embora facilmente manipulado com as mãos, se a ingestão for evitada a todo custo.
Não é inflamável, mas em altas temperaturas se decompõe formando BaO e CO 2 , produtos tóxicos e oxidantes que podem queimar outros materiais.
No corpo, o bário é depositado nos ossos e outros tecidos, suplantando o cálcio em muitos processos fisiológicos. Ele também bloqueia os canais pelos quais os íons K + viajam , impedindo sua difusão pelas membranas celulares.
Referências
- PubChem (2018). Carbonato de bário Retirado em 24 de março de 2018, do PubChem: pubchem.ncbi.nlm.nih.gov
- Wikipedia (2017). Carbonato de bário Recuperado em 24 de março de 2018, da Wikipedia: en.wikipedia.org
- ChemicalBook (2017). O carbonato de bário . Recuperado em 24 de março de 2018, de ChemicalBook: chemicalbook.com
- Hong T., S. Brinkman K., Xia C. (2016). Nanopartículas de carbonato de bário como catalisadores sinérgicos da reação de redução de oxigênio em cátodos de células a combustível de óxido sólido de La0.6Sr0.4Co0.2Fe0.8O3! D ChemElectroChem 3, 1 – 10.
- Robbins Manuel A. (1983) Robbins O Livro do Colecionador de Minerais Fluorescentes. Descrição de minerais fluorescentes, p-117.
- Shiver & Atkins. (2008). Química Inorgânica In A estrutura de sólidos simples (quarta edição., P. 99-102). Mc Graw Hill