O cloreto de lítio é um composto químico formado pela ligação entre um átomo de lítio e um de cloro, sendo representado pela fórmula LiCl. Ele é um sólido branco e cristalino, solúvel em água e muito utilizado na indústria farmacêutica, na produção de baterias de íon-lítio, na fabricação de cerâmicas e na dessalinização da água.
Além de seus diversos usos, o cloreto de lítio também apresenta riscos à saúde, podendo causar irritação na pele, olhos e vias respiratórias em caso de contato direto. Por isso, é importante manuseá-lo com cuidado e seguir as normas de segurança recomendadas. Suas propriedades e características fazem dele um composto químico versátil e importante em diversos setores industriais.
Usos do lítio: para que serve esse elemento químico tão importante?
O lítio é um elemento químico de grande importância, sendo amplamente utilizado em diversos setores devido às suas propriedades únicas. Um dos compostos mais conhecidos do lítio é o cloreto de lítio, cuja fórmula química é LiCl.
O cloreto de lítio possui diversas propriedades interessantes, sendo um sólido branco e cristalino, altamente solúvel em água. É amplamente utilizado na indústria farmacêutica, principalmente em medicamentos psiquiátricos para tratar distúrbios como a bipolaridade. Além disso, o cloreto de lítio é utilizado na produção de cerâmicas, na indústria de vidro e na fabricação de lubrificantes.
Apesar de todos os usos benéficos do cloreto de lítio, é importante ressaltar que ele apresenta alguns riscos. O contato direto com a pele pode causar irritações, e a inalação do composto pode levar a problemas respiratórios. Portanto, é essencial manuseá-lo com cuidado e seguir todas as precauções de segurança necessárias.
Em resumo, o cloreto de lítio é um composto químico de grande importância, com uma variedade de usos em diferentes setores. Seu papel na indústria farmacêutica e em outras áreas é fundamental, tornando-o um elemento químico essencial para diversas aplicações.
Benefícios e aplicações do lítio: descubra para que serve esse importante mineral.
O lítio é um mineral de extrema importância, com diversos benefícios e aplicações em diferentes áreas. Conhecido principalmente por seu uso na indústria de baterias recarregáveis, o lítio também possui propriedades terapêuticas no tratamento de transtornos mentais, como o transtorno bipolar.
Além disso, o lítio é utilizado em ligas metálicas, na produção de cerâmicas e vidros, na indústria farmacêutica e até mesmo na indústria nuclear. Sua versatilidade e eficiência o tornam um mineral indispensável em diversos setores da sociedade moderna.
Cloreto de lítio: fórmula, propriedades, riscos e usos
O cloreto de lítio, cuja fórmula química é LiCl, é uma das formas mais comuns de composto de lítio. Possui propriedades higroscópicas, o que significa que tem capacidade de absorver umidade do ar. Essa característica é importante em aplicações como desumidificadores e sistemas de ar condicionado.
Em relação aos riscos, o cloreto de lítio pode ser irritante para a pele, olhos e vias respiratórias, sendo necessário o uso de equipamentos de proteção individual durante seu manuseio. No entanto, quando utilizado de maneira adequada, o cloreto de lítio é seguro e eficaz em diversas aplicações.
Os usos do cloreto de lítio são variados, incluindo a fabricação de baterias de lítio, na indústria farmacêutica, na produção de vidros especiais e na síntese de compostos químicos. Sua versatilidade e eficiência o tornam um componente essencial em muitos processos industriais.
Tutorial completo de como produzir cloreto de lítio de forma eficiente em casa.
Para produzir cloreto de lítio de forma eficiente em casa, você vai precisar de alguns materiais básicos, como carbonato de lítio, ácido clorídrico e água destilada. A fórmula química do cloreto de lítio é LiCl.
Primeiramente, misture o carbonato de lítio com o ácido clorídrico em um recipiente de vidro resistente ao calor. A reação entre esses dois compostos irá produzir cloreto de lítio e dióxido de carbono.
Após a reação, aqueça a solução em fogo baixo para evaporar a água. O cloreto de lítio irá se cristalizar no fundo do recipiente. Deixe esfriar e, em seguida, filtre os cristais para separá-los da solução restante.
Os cristais de cloreto de lítio podem ser secos em um forno a baixa temperatura para remover qualquer umidade restante. Depois disso, você terá seu próprio cloreto de lítio pronto para uso.
O cloreto de lítio é um composto químico com diversas propriedades, sendo utilizado em aplicações como soldagem, tratamento de ar, fabricação de cerâmica e na produção de lubrificantes. É importante ressaltar que o cloreto de lítio pode ser tóxico se ingerido ou inalado, portanto, tome cuidado ao manuseá-lo.
Em resumo, produzir cloreto de lítio em casa pode ser uma atividade interessante para quem deseja experimentar a química de forma prática. Seguindo o tutorial acima, você poderá obter seu próprio cloreto de lítio de forma eficiente e segura.
Processo de extração do lítio: entenda como é realizado o procedimento de obtenção desse mineral.
O lítio é um mineral de grande importância na indústria devido às suas propriedades únicas. Ele é extraído principalmente de salmouras e de minérios como a espodumena e a lepidolita. O processo de extração do lítio varia de acordo com a fonte de onde é obtido.
No caso das salmouras, o lítio é extraído através de evaporação solar ou por meio de processos químicos. Já para os minérios, o lítio é extraído por meio de processos de trituração, moagem, flotação e calcinação.
Após a extração, o lítio passa por processos de purificação para remover impurezas e alcançar a qualidade necessária para seus diversos usos industriais. O lítio purificado pode ser utilizado na fabricação de baterias, na indústria de vidros e cerâmicas, e em medicamentos, entre outros.
O processo de extração do lítio pode ser complexo e demanda cuidados específicos para garantir a eficiência e a segurança. É fundamental seguir normas e regulamentações ambientais para minimizar os impactos negativos da extração desse mineral.
Cloreto de lítio: fórmula, propriedades, riscos e usos.
Cloreto de lítio: fórmula, propriedades, riscos e usos
O cloreto de lítio é um composto químico de fórmula LiCl não inflamar cloreto de lítio, apesar de que é difícil, porque a reacção é violenta.
Desta forma, a forma anidra é produzida (sem água).O cloreto de lítio também pode ser extraído de outros cloretos de metais alcalinos com álcool amílico.

Até a década de 1990, o mercado de metal e lítio era dominado pela produção dos EUA a partir de depósitos minerais.
No entanto, no início do século XXI, a maior parte da produção era proveniente de fontes não americanas, sendo a Austrália, o Chile e Portugal os fornecedores mais importantes do mundo.
Como curiosidade, embora a Bolívia possua metade dos depósitos de lítio do mundo, ela não é uma grande produtora de lítio.
A forma comercial mais importante é o carbonato de lítio, Li 2 CO 3 , produzido a partir de minerais ou salmoura por vários processos diferentes.
A adição de ácido clorídrico (HCl) produz cloreto de lítio. Com este método, o composto hidratado é produzido (água ligada à molécula). A forma hidratada pode ser seca na forma anidra, aquecendo-a com cloreto de hidrogênio gasoso.
Propriedades físicas e químicas do cloreto de lítio
O cloreto de lítio é um sólido branco sem aroma particular e sabor salgado (National Center for Biotechnology Information, 2005). Sua aparência é mostrada na figura 2.

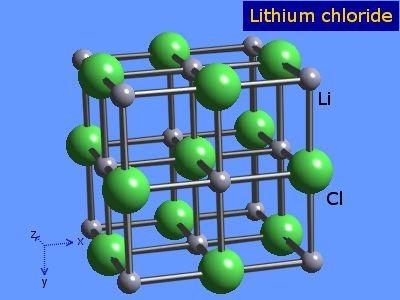
O cloreto de lítio são cristais altamente higroscópicos com geometria octaédrica semelhante à do cloreto de sódio. Sua estrutura cristalina é apresentada na Figura 3 (Winter, SF).
Seu peso molecular é de 42,39 g / mol, sua densidade é de 2.068 g / mL e os pontos de fusão e ebulição são 605 ° C e 1360 ° C, respectivamente.
O composto é muito solúvel em água, álcool, éter, piridina e nitrobenzeno (Royal Society of Chemistry, 2015).
O cloreto de lítio possui um poder oxidante ou redutor fraco. No entanto, reações redox ainda podem ocorrer. As soluções de cloreto de lítio geralmente não são fortemente ácidas nem fortemente básicas.
Por ser extremamente higroscópico, o cloreto de lítio também pode absorver até quatro equivalentes de amônia por mole. Soluções aquosas de cloreto de lítio podem corroer metais (LITHIUM CHLORIDE, SF).
Reatividade e perigos
O cloreto de lítio é um composto estável incompatível com agentes oxidantes fortes, ácidos fortes, tricloreto de bromo, trifluoreto de bromo.
Não é tóxico se ingerido, mas devido à sua natureza corrosiva, pode ser irritante em contato com a pele e os olhos, também pode irritar as narinas (Instituto Nacional de Segurança e Saúde Ocupacional, 2015).
Em caso de contato com os olhos, é necessário verificar se as lentes de contato estão sendo usadas e removê-las imediatamente.
Você deve enxaguar os olhos com água corrente por pelo menos 15 minutos, mantendo as pálpebras abertas. Você pode usar água fria. Pomada para os olhos não deve ser usada.
Se o produto químico entrar em contato com a roupa, remova-o o mais rápido possível, protegendo suas próprias mãos e corpo.
Coloque a vítima sob um chuveiro de segurança. Se o produto químico se acumular na pele exposta da vítima, como mãos, lave delicada e cuidadosamente a pele contaminada com água corrente e sabão não abrasivo.
Você pode usar água fria. Se a irritação persistir, procure atendimento médico. Lave a roupa contaminada antes de reutilizá-la.
Em caso de inalação, a vítima deve poder descansar em uma área bem ventilada. Se a inalação for grave, a vítima deve ser evacuada para uma área segura o mais rápido possível.
Afrouxe roupas apertadas, como colarinho da camisa, cintos ou gravata. Se for difícil para a vítima respirar, deve-se fornecer oxigênio.
Se a vítima não estiver respirando, é realizada uma ressuscitação boca a boca. Sempre levando em consideração que pode ser perigoso para a pessoa que fornece ajuda fazer reanimação boca a boca quando o material inalado é tóxico, infeccioso ou corrosivo.
Em todos os casos, deve-se procurar atendimento médico imediato (Folha de dados de segurança do material Cloreto de lítio, 2013).
Usos
O cloreto de lítio é o composto usado para produzir metal de lítio por eletrólise. O metal de lítio é produzido por eletrólise de uma mistura fundida de cloretos de lítio e potássio.
O ponto de fusão mais baixo da mistura (400-420 ° C ou 750-790 ° F) em comparação com o cloreto de lítio puro (610 ° C ou 1 130 ° F) permite que a eletrólise opere a uma temperatura mais baixa .
Como a tensão na qual a decomposição do cloreto de lítio ocorre é menor que a do cloreto de potássio, o lítio é depositado em um nível de pureza superior a 97% (Dye, 2017).
O cloreto de lítio líquido serve como um dessecante que pode reduzir os níveis de umidade no ar circundante em até 15%.
Dessecantes líquidos que combinam cloreto de lítio e cloreto de cálcio criam uma substância que é mais barata que o cloreto de lítio, mas mais estável que o cloreto de cálcio.
O cloreto de lítio resfria o ar rapidamente, porque o produto químico contém uma enorme quantidade de água pelo seu peso como sólido. A substância também seca grandes quantidades de gases industriais.
O cloreto de lítio é um corante vermelho em displays pirotécnicos, como fogos de artifício. O cloreto de lítio ou qualquer sal à base de lítio solúvel em água fica vermelho quando se inflama.
Efeitos pirotécnicos especiais podem ser inflamados pela mistura de sais iônicos com líquidos inflamáveis, como o álcool metílico.
Na década de 1940, o cloreto de lítio serviu como substituto do sal de mesa, mas alguns pacientes morreram devido a níveis tóxicos de lítio.
O composto tem aplicações farmacológicas, como antimaníacos, que são agentes usados para tratar distúrbios bipolares ou mania associados a outros distúrbios afetivos.
O corpo humano normalmente contém aproximadamente 7 miligramas de lítio a qualquer momento.
O lítio ocorre naturalmente nas plantas, pois os organismos usam a substância para estimular o crescimento.
Referências
- Dye, JL (2017, 23 de janeiro). Lítio (Li) . Recuperado da britannica: britannica.com.
- EMBL-EBI. (23 de novembro de 2009). cloreto de lítio . Recuperado do ChEBI: ebi.ac.uk.
- CLORETO DE LÍTIO . (SF). Recuperado do CAMEO: cameochemicals.noaa.gov.
- Ficha de dados de segurança do material Cloreto de lítio . (21 de maio de 2013). Recuperado de sciencelab.com.
- Centro Nacional de Informação Biotecnológica. . (26 de março de 2005). Banco de Dados Composto PubChem; CID = 433294 . Recuperado do PubChem.
- Instituto Nacional de Segurança e Saúde Ocupacional. (22 de julho de 2015). CLORETO DE LÍTIO . Recuperado de cdc.gov.
- Winter, M. (SF). Lítio: cloreto de lítio . Recuperado de elementos da web.