A constante de ionização é uma importante medida da capacidade de um ácido ou base de se ionizar em solução aquosa. Ela é representada pela letra Ka para ácidos e Kb para bases e está relacionada com o equilíbrio entre os íons e as moléculas não ionizadas. A equação da constante de ionização é dada pela divisão da concentração dos produtos pela concentração dos reagentes, elevadas aos seus respectivos coeficientes estequiométricos. Neste artigo, iremos explorar mais sobre a definição da constante de ionização, sua importância e como calcular através de exercícios práticos.
Métodos para determinar a constante de ionização de uma substância química.
Existem diversos métodos para determinar a constante de ionização de uma substância química, que é a medida da capacidade de uma substância se ionizar em solução aquosa. Um dos métodos mais comuns é o método potenciométrico, no qual a constante de ionização é determinada medindo-se o pH da solução em diferentes concentrações da substância.
Outro método utilizado é o método espectrofotométrico, no qual a constante de ionização é determinada através da absorção de radiação eletromagnética pela substância em solução. Este método é útil para substâncias que apresentam absorção em determinado comprimento de onda.
Além disso, o método condutimétrico também pode ser empregado para determinar a constante de ionização. Neste método, a condutividade da solução é medida em diferentes concentrações da substância, permitindo assim a determinação da constante de ionização.
Em resumo, a constante de ionização de uma substância química pode ser determinada através de métodos potenciométricos, espectrofotométricos e condutimétricos, cada um com suas vantagens e limitações. Estes métodos são fundamentais para o estudo e compreensão das propriedades químicas das substâncias.
Qual é a equação para calcular a constante de dissociação ácida (Ka)?
A constante de dissociação ácida (Ka) é uma medida da força de um ácido em solução aquosa. A equação para calcular a constante de dissociação ácida é dada pela seguinte expressão:
Ka = [H+][A-] / [HA]
Onde:
– Ka é a constante de dissociação ácida;
– [H+] é a concentração de íons hidrogênio na solução;
– [A-] é a concentração de íons hidroxila na solução;
– [HA] é a concentração da espécie química ácida não dissociada.
Para calcular a constante de dissociação ácida, é necessário conhecer as concentrações das espécies químicas envolvidas na reação ácido-base. Com essa informação, é possível determinar a força do ácido em solução através da constante de dissociação ácida.
Equação de ionização: como determinar as espécies químicas ionizadas durante uma reação química.
A Equação de ionização é uma ferramenta fundamental para determinar as espécies químicas que se ionizam durante uma reação química. Ela nos permite visualizar quais átomos ou moléculas perdem ou ganham elétrons, formando íons positivos ou negativos.
Para determinar as espécies químicas ionizadas durante uma reação, devemos primeiro identificar os reagentes e produtos da equação química. Em seguida, analisamos as cargas dos átomos em cada substância e observamos quais átomos se tornam íons durante a reação.
Por exemplo, na equação de ionização do ácido clorídrico (HCl), temos a seguinte reação:
HCl (aq) → H+ (aq) + Cl- (aq)
Neste caso, o ácido clorídrico se ioniza em íons de hidrogênio (H+) e cloreto (Cl-). A equação de ionização nos mostra claramente quais são as espécies químicas ionizadas durante essa reação.
Constante de ionização: equação e exercícios
A constante de ionização é uma medida da extensão em que um ácido ou base se ioniza em solução aquosa. Ela é representada pela constante de ionização (Ki) e pode ser calculada usando a equação:
Ki = [H+][A-] / [HA]
Onde [H+], [A-] e [HA] representam as concentrações dos íons hidrogênio, íons ânion e ácido não ionizado, respectivamente. A constante de ionização nos ajuda a determinar o grau de ionização de um ácido ou base em solução.
Para praticar o cálculo da constante de ionização, podemos resolver exercícios que envolvem equações químicas de ionização de ácidos e bases. Ao realizar esses exercícios, podemos aprimorar nossa compreensão sobre como determinar a constante de ionização e sua importância em reações químicas.
Passo a passo para equilibrar uma reação química utilizando as constantes de equilíbrio.
Para equilibrar uma reação química utilizando as constantes de equilíbrio, siga os passos abaixo:
Passo 1: Escreva a equação química da reação que deseja equilibrar.
Passo 2: Escreva a expressão da constante de equilíbrio (K) para a reação química.
Passo 3: Determine as concentrações dos reagentes e produtos na reação química.
Passo 4: Substitua as concentrações na expressão da constante de equilíbrio (K).
Passo 5: Resolva a equação para encontrar o valor de K.
Passo 6: Compare o valor de K encontrado com o valor de K conhecido. Se os valores forem diferentes, a reação não está em equilíbrio e você precisará ajustar as concentrações dos reagentes e produtos.
Seguindo esses passos, você conseguirá equilibrar uma reação química utilizando as constantes de equilíbrio. Lembre-se de praticar com diferentes reações para aprimorar suas habilidades.
Constante de ionização: equação e exercícios
A constante de ionização (ou dissociação) é uma propriedade que reflete a tendência de uma substância em liberar íons hidrogênio; isto é, está diretamente relacionado à força de um ácido. Quanto maior o valor da constante de dissociação (Ka), maior a liberação de íons hidrogênio pelo ácido.
Quando se trata de água, por exemplo, sua ionização é conhecida como ‘auto-hidrólise’ ou ‘auto-ionização’. Aqui, uma molécula de água produz um H + para outro, produzindo íons H 3 O + e OH – , como pode ser visto na imagem abaixo.
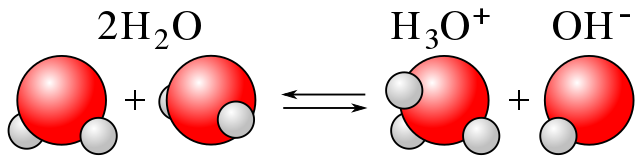
A dissociação de um ácido de uma solução aquosa pode ser esquematizada da seguinte forma:
HA + H 2 O <=> H 3 O + + A –
Onde HA representa o ácido ionizado, H 3 O + no íon hidrônio e A – sua base conjugada. Se o Ka for alto, uma grande parte do HA será dissociada e, portanto, haverá uma maior concentração do íon hidrônio. Esse aumento na acidez pode ser determinado pela observação de uma alteração no pH da solução, cujo valor é inferior a 7.
Equilíbrio de ionização
As setas duplas na equação química superior indicam que é estabelecido um equilíbrio entre reagentes e produto. Como todo equilíbrio tem uma constante, o mesmo ocorre com a ionização de um ácido e é expresso da seguinte forma:
K = [H 3 O + ] [A – ] / [HA] [H 2 O]
Termodinamicamente, a constante Ka é definida em termos de atividades, não em concentrações. No entanto, em soluções aquosas diluídas, a atividade da água é de cerca de 1, e as atividades do íon hidrônio, da base conjugada e do ácido não dissociado estão próximas de suas concentrações molares.
Por esses motivos, foi introduzido o uso da constante de dissociação (ka) que não inclui a concentração de água. Isso permite que a dissociação ácida fraca seja esquematizada de maneira mais simples, e a constante de dissociação (Ka) é expressa da mesma maneira.
HA <=> H + + A –
Ka = [H + ] [A – ] / [HA]
Ka
A constante de dissociação (Ka) é uma forma de expressão de uma constante de equilíbrio.
As concentrações do ácido não dissociado, da base do conjugado e do hidrônio ou íon hidrogênio permanecem constantes quando a condição de equilíbrio é atingida. Por outro lado, a concentração da base conjugada e a do íon hidrônio são exatamente as mesmas.
Seus valores são dados em potências de 10 com expoentes negativos; portanto, uma forma mais simples e mais gerenciável de expressão de Ka foi introduzida, que eles chamaram de pKa.
pKa = – log Ka
PKa é comumente chamado constante de dissociação ácida. O valor de pKa é uma indicação clara da força de um ácido.
Os ácidos que têm um valor de pKa menor ou mais negativo que -1,74 (pKa do íon hidrônio) são considerados ácidos fortes. Enquanto os ácidos que têm um pKa maior que -1,74, são considerados ácidos não fortes.
Equação de Henderson-Hasselbalch
A partir da expressão de Ka, deduz-se uma equação que é de imensa utilidade nos cálculos analíticos.
Ka = [H + ] [A – ] / [HA]
Tomando logaritmos,
log Ka = log H + + log A – – log HA
E limpando o log H + :
-log H = – log Ka + log A – – log HA
Em seguida, usando as definições de pH e pKa e reagrupando termos:
pH = pKa + log (A – / HA)
Esta é a famosa equação de Henderson-Hasselbalch.
Use
A equação de Henderson-Hasselbach é usada para estimar o pH das soluções tampão, bem como como as concentrações relativas da base conjugada e do ácido influenciam o pH.
Quando a concentração da base conjugada é igual à concentração do ácido, a razão entre as concentrações de ambos os termos é igual a 1; e, portanto, seu logaritmo é igual a 0.
Como conseqüência, o pH = pKa tem tanta importância, pois nessa situação a eficiência de amortecimento é máxima.
A zona de pH é geralmente obtida onde existe a capacidade máxima do buffer, aquela em que o pH = pka ± 1 unidade de pH.
Exercícios constantes de ionização
Exercício 1
A solução diluída de um ácido fraco tem as seguintes concentrações em equilíbrio: ácido não dissociado = 0,065 M e concentração da base conjugada = 9,10 -4 M. Calcule o Ka e o pKa do ácido.
A concentração de hidrogenação ou íon hidrônio é igual à concentração da base conjugada, pois provém da ionização do mesmo ácido.
Substituindo na equação:
Ka = [H + ] [A – ] / HA
Substituindo na equação por seus respectivos valores:
Ka = (9 x 10 -4 M) (9 · 10 -4 M) / 65 · 10 -3 M
= 1,246 x 10 -5
E então calculando seu pKa
pKa = – log Ka
= – log 1,246 x 10 -5
= 4.904
Exercício 2
Um ácido fraco com uma concentração de 0,03 M, tem uma constante de dissociação (Ka) = 1,5 · 10 -4 . Calcular: a) pH da solução aquosa; b) o grau de ionização do ácido.
No equilíbrio, a concentração de ácido é igual a (0,03 M – x), onde x é a quantidade de ácido que se dissocia. Portanto, a concentração de íon hidrogênio ou hidrônio é x, assim como a concentração da base conjugada.
Ka = [H + ] [A – ] / [HA] = 1,5 · 10 -6
[H + ] = [A – ] = x
Y [HA] = 0,03 M – x. O pequeno valor de Ka indica que o ácido provavelmente se dissociou muito pouco, então (0,03 M – x) é aproximadamente igual a 0,03 M.
Substituindo em Ka:
1.510 -6 = x 2 / 310-2
x 2 = 4.510 -8 M 2
x = 2,12 x 10 -4 M
E como x = [H + ]
pH = – log [H + ]
= – log [2,12 x 10 -4 ]
pH = 3,67
E finalmente, quanto ao grau de ionização: pode ser calculado pela seguinte expressão:
[H + ] ou [A – ] / HA] x 100%
(2,12 · 10 -4 / 3 · 10 -2 ) x 100%
0,71%
Exercício 3
Calculo o Ka a partir da porcentagem de ionização de um ácido, sabendo que ele é ionizado em 4,8% a partir de uma concentração inicial de 1,5 · 10 -3 M.
Para calcular a quantidade de ácido ionizado, são determinados 4,8%.
Quantidade ionizada = 1,5 · 10 -3 M (4,8 / 100)
= 7,2 x 10-5 M
Esta quantidade de ácido ionizado é igual à concentração da base conjugada e à concentração do íon hidrônio ou da hidrogenação no equilíbrio.
A concentração de ácido no equilíbrio = concentração inicial de ácido – a quantidade de ácido ionizado.
[HA] = 1,5 · 10 -3 M – 7,2 · 10 -5 M
= 1.428 x 10 -3 M
E resolvendo então com as mesmas equações
Ka = [H + ] [A – ] / [HA]
Ka = (7,2 · 10 -5 M x 7,2 · 10 -5 M) / 1.428 · 10 -3 M
= 3,63 x 10 -6
pKa = – log Ka
= – log 3,63 x 10 -6
= 5,44
Referências
- Química LibreTexts. (sf). Constante de dissociação. Recuperado de: chem.libretexts.org
- Wikipedia (2018). Constante de dissociação. Recuperado de: en.wikipedia.org
- Whitten, KW, Davis, RE, Peck, LP e Stanley, GG Chemistry. (2008) Oitava Edição. Cengage Learning
- Segel IH (1975). Cálculos bioquímicos 2nd. Edição John Wiley & Sons. INC.
- Kabara E. (2018). Como calcular a constante de ionização ácida. Estudo Recuperado de: study.com.