- L’ebulioscopia è un effetto colligativo: ΔTe dipende dal numero di particelle del soluto non volatile.
- Formula chiave: ΔTe = Ke · b · i, con il fattore di Van’t Hoff a pesare la dissociazione.
- Pressione di vapore e pressione atmosferica governano l’ebollizione; altitudine e pentola a pressione ne sono esempi pratici.
- Applicazioni: cucina, antifreeze, distillazioni, fluidi termici; attenzione alla scelta del solvente e alle forze intermolecolari.
Hai mai notato che l’acqua impiega un po’ di più a riprendere il bollore quando aggiungi lo zucchero o il sale? Non è solo una curiosità di cucina: è una finestra su un fenomeno fisico-chimico affascinante, direttamente collegato a come le molecole interagiscono tra loro e a come la pressione di vapore si equilibra con l’atmosfera. In poche parole, stiamo parlando di ebulioscopia, cioè l’aumento della temperatura di ebollizione di un solvente quando vi si scioglie un soluto non volatile.
L’argomento è più attuale di quanto sembri: dalla pentola a pressione alla distillazione industriale, passando per la scelta dei solventi in laboratorio, capire perché e come varia il punto di ebollizione aiuta a progettare processi più sicuri, efficienti e prevedibili. In questo articolo trovi un quadro completo: concetti chiave, relazione con pressioni e temperature, formule di calcolo, esempi pratici e un esperimento da fare in casa.
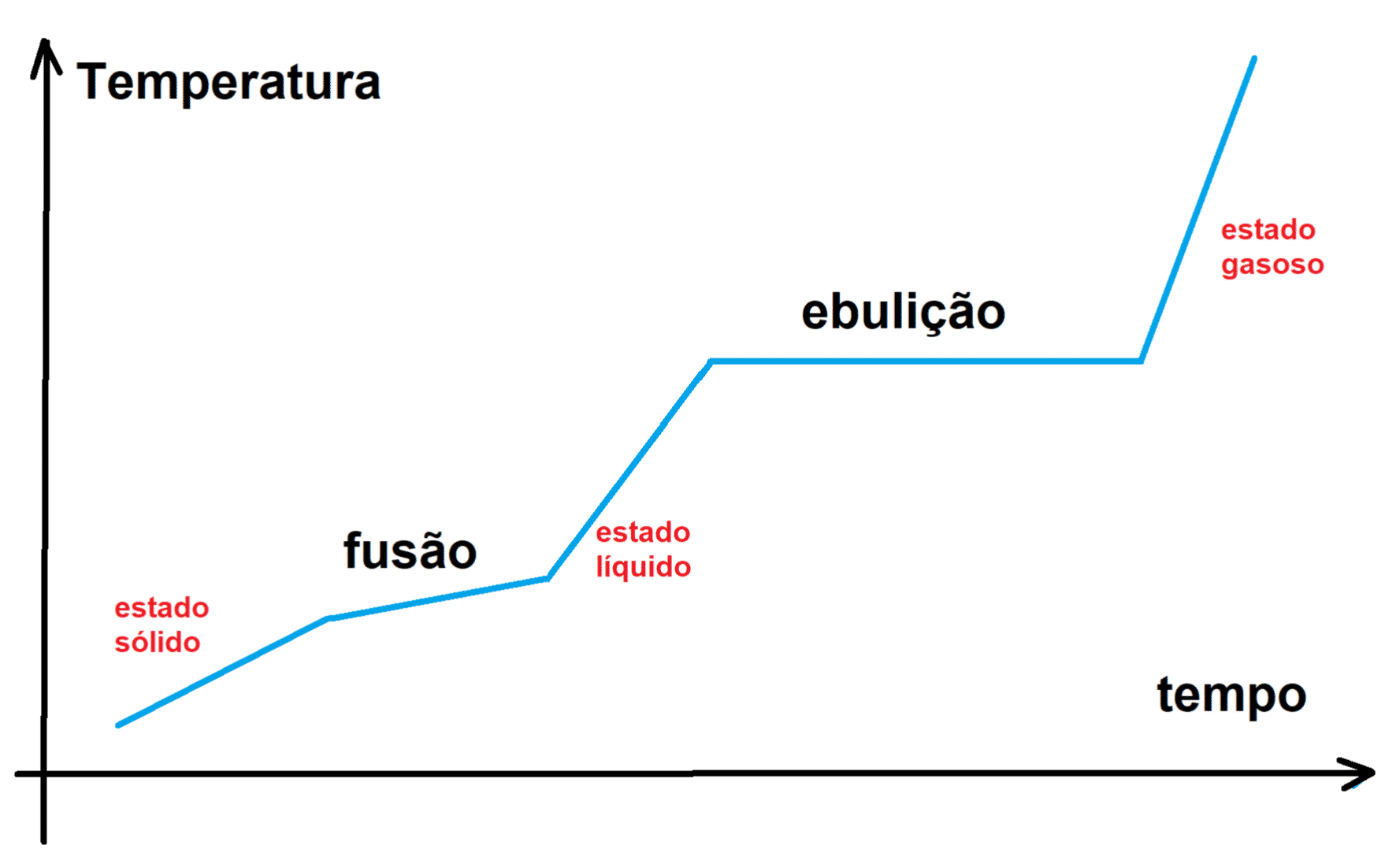
Che cos’è l’ebulioscopia e perché il punto di ebollizione aumenta
L’ebulioscopia (o ebuliometria) è una proprietà colligativa: dipende dal numero di particelle di soluto disciolte e non dalla loro natura chimica. Un liquido entra in ebollizione quando la sua pressione di vapore eguaglia la pressione esterna (tipicamente atmosferica). Se aggiungiamo un soluto non volatile, le particelle del soluto ostacolano il passaggio delle molecole del solvente alla fase gassosa, riducendo la pressione di vapore alla stessa temperatura. Serve quindi una temperatura più alta per raggiungere di nuovo l’uguaglianza tra pressione di vapore e pressione esterna.
Un esempio quotidiano è la preparazione del caffè o della pasta: se incorpori zucchero o sale in acqua quasi al bollore, la soluzione smette di ribollire e riparte solo quando la temperatura sale ulteriormente. All’inizio i cristalli possono essere ancora non completamente disciolti, ma anche dopo la dissoluzione l’effetto rimane: la soluzione bolle a una temperatura superiore rispetto al solvente puro.
La relazione quantitativa alla base dell’effetto è stata formalizzata nella legge di Raoult e porta a una conseguenza pratica: l’innalzamento del punto di ebollizione è proporzionale alla quantità di soluto in termini di particelle effettive. La variazione si esprime come differenza fra le temperature di ebollizione: molti testi scrivono ΔTe = Te,sol − Te,puro, mentre in alcune convenzioni troverai la forma ΔTe = Te2 − Te con Te2 riferito al solvente puro e Te alla soluzione; in ogni caso, l’innalzamento è positivo quando la soluzione bolle a temperatura più alta del solvente puro.
In simboli, l’effetto ebulioscopico si quantifica con: ΔTe = Ke · b · i, dove Ke è la costante ebulioscopica del solvente, b la molalità della soluzione e i il fattore di Van’t Hoff, che tiene conto del numero di particelle generate in soluzione (dissociazione/associazione).
Pressione di vapore e temperatura di ebollizione
La pressione di vapore è la pressione esercitata dal vapore in equilibrio con il proprio liquido in un sistema chiuso. Aumentando la temperatura, le molecole hanno più energia cinetica, evaporano più facilmente e la pressione di vapore cresce. Un liquido bolle quando la sua pressione di vapore uguaglia la pressione esterna; perciò, se il soluto non volatile abbassa la pressione di vapore a parità di temperatura, occorre scaldare di più per tornare alla condizione di ebollizione.
Liquidi diversi hanno pressioni di vapore differenti alla stessa temperatura, perché diverse sono le forze intermolecolari: sostanze con interazioni deboli sono più volatili, hanno pressione di vapore maggiore e punto di ebollizione più basso. Per esempio, l’etere etilico (interazioni dipolo-dipolo) è più volatile dell’acqua, che possiede robuste legami a idrogeno e quindi bolle più in alto.
L’effetto ebulioscopico è collegato alla tonoscopia (abbassamento della pressione di vapore): il soluto non volatile “diluisce” il solvente alla superficie e intralcia l’uscita delle sue molecole verso la fase gassosa. La minore pressione di vapore implica che la temperatura di ebollizione si sposti verso valori più elevati per riequilibrare le pressioni.
Pressione atmosferica, altitudine e pentola a pressione
La pressione atmosferica diminuisce con l’altitudine e questo abbassa il punto di ebollizione dei liquidi. Al livello del mare (circa 1 atm o 760 mmHg), l’acqua bolle a 100 °C. A quote più elevate, il bollore arriva prima: indicativamente a Campos do Jordão (~1.628 m) l’acqua bolle intorno a 95 °C, a La Paz (~3.636 m) attorno a 88 °C e sul Monte Everest (~8.848 m) si arriva persino a circa 70 °C.
In senso opposto agisce la pentola a pressione, spesso definita una “antimontagna” in cucina: intrappolando il vapore, la pressione interna cresce oltre quella atmosferica, così l’acqua deve raggiungere temperature maggiori di 100 °C per bollire, accelerando le cotture. L’idea è identica ma speculare: più pressione esterna, più alta la temperatura di ebollizione.
La relazione può essere ribaltata in un esperimento di vuoto: se si riduce drasticamente la pressione sopra la superficie del liquido (per esempio con una pompa da vuoto), l’ebollizione può avvenire a temperature molto più basse, talvolta persino prossime alla temperatura ambiente.
Natura del soluto: non elettroliti, elettroliti e fattore di Van’t Hoff (i)
Essendo una proprietà colligativa, ciò che conta è il numero di particelle in soluzione, non la loro specie chimica. Tuttavia, il modo in cui un soluto si comporta in soluzione cambia proprio quel numero: un non elettrolita di solito resta molecolare (i ≈ 1), un elettrolita si dissocia in più ioni (i > 1), amplificando l’effetto.
Non elettroliti: glucosio e saccarosio sono esempi classici; si dissolvono senza dissociarsi, contribuendo con una particella per ogni molecola. A parità di molalità, l’innalzamento del punto di ebollizione sarà minore rispetto a un sale che si dissocia in più ioni.
Elettroliti: il cloruro di sodio (NaCl) si separa in Na+ e Cl− (idealmente 2 particelle), mentre il solfato di alluminio Al2(SO4)3 genera 2 Al3+ e 3 SO4^2− (in totale 5 particelle). In pratica, l’elettrolita può dissociarsi in modo non perfettamente ideale, e per tenerne conto si usa il fattore di Van’t Hoff i, legato al grado di ionizzazione α con la relazione i = 1 + α(q − 1), dove q è il numero di particelle attese per unità formula.
Morale: a parità di concentrazione molale, una soluzione di elettrolita produce un innalzamento della temperatura di ebollizione maggiore di un non elettrolita, perché il numero effettivo di particelle è superiore.
Calcolo dell’innalzamento ebulioscopico (ΔTe)
La formula generale è: ΔTe = Ke · b · i. Qui Ke è la costante ebulioscopica del solvente (dipende solo dal solvente), b è la molalità (mol di soluto per kg di solvente), e i è il fattore di Van’t Hoff. La molalità è preferita perché non varia con la temperatura, a differenza della molarità.
Esempio 1 (glucosio, non elettrolita, i = 1): se 0,5 mol di glucosio sono disciolti in ~1,0 kg d’acqua, si osserva un ΔTe di circa 0,26 °C a 1 atm. In simboli: ΔTe(glucosio) = Ke · 0,5 · 1 ≈ 0,26 °C.
Esempio 2 (NaCl, elettrolita forte, i ≈ 2): la stessa quantità molale raddoppia all’incirca l’innalzamento: ΔTe(NaCl) = Ke · 0,5 · 2 ≈ 0,52 °C, cioè circa il doppio del caso glucosio, proprio perché il numero di particelle in soluzione è maggiore.
Esempio 3 (Al2(SO4)3, i ≈ 5): una soluzione 0,5 m di questo sale provoca un effetto circa cinque volte più grande del glucosio: ΔTe(Al2(SO4)3) = Ke · 0,5 · 5 ≈ 1,30 °C. La temperatura di ebollizione della soluzione si ottiene poi come Te,sol = Te,puro + ΔTe.
Nota sulle convenzioni di ΔTe: alcuni schemi riportano la differenza come ΔTe = Te2 − Te, con Te2 per il solvente puro e Te per la soluzione; ciò che conta è ricordare che in presenza di soluto non volatile la soluzione bolle a temperatura maggiore, quindi l’incremento è positivo rispetto al solvente puro.
Panoramica sulle proprietà colligative correlate
Le proprietà colligative classiche sono quattro: tonoscopia (abbassamento della pressione di vapore), ebulioscopia (innalzamento dell’ebollizione), crioscopia (abbassamento del congelamento) e pressione osmotica. Tutte dipendono dal numero di particelle in soluzione; la natura chimica del soluto, di per sé, non è determinante se non per come influisce sul numero di particelle.
Tonoscopia: aggiungendo un soluto non volatile si riduce la pressione di vapore del solvente puro alla stessa temperatura. Di conseguenza, l’evaporazione è più lenta: due bicchieri, uno con acqua e l’altro con acqua e zucchero, lasciano evaporare più lentamente il secondo.
Ebulioscopia: è l’effetto che stiamo descrivendo: il punto di ebollizione si sposta verso l’alto in presenza di soluto non volatile, perché la pressione di vapore della soluzione è minore e serve più calore per arrivare all’uguaglianza con la pressione esterna.
Crioscopia: il punto di congelamento si abbassa quando è presente un soluto; le particelle ostacolano la formazione del reticolo solido. È il principio alla base dell’uso di sale sulle strade innevate o dei liquidi antigelo nei circuiti: più soluto, più bassa la temperatura a cui il solvente solidifica.
Pressione osmotica: è la differenza di pressione necessaria a fermare il flusso di solvente attraverso una membrana semipermeabile tra due soluzioni a diversa concentrazione. In pratica, il solvente tende a passare dove ci sono più particelle disciolte; è il meccanismo sfruttato nella conservazione degli alimenti con il sale e osservabile sulle foglie d’insalata salate, che si afflosciano perdendo acqua.
La legge di Raoult formalizza questi effetti in termini di frazioni molari e pressioni parziali: per soluzioni diluite e ideali, la pressione di vapore del componente y vale p_v,parziale(y) = p_v(puro) · X_y e la pressione totale è la somma delle parziali, P_totale = Σ p_v,parziale. In soluzioni concentrate si osservano scostamenti dovuti a interazioni specifiche.
Solventi e soluti: definizioni e note pratiche
Solvente: il mezzo che dissolve, tipicamente un liquido, al cui interno il soluto si disperde in modo omogeneo; soluto: la sostanza disciolta, le cui particelle sono così piccole da non sedimentare e da risultare in un’unica fase anche al microscopio.
Soluti non volatili tipici sono sali e zuccheri (NaCl, MgCl2, saccarosio) ed etilenglicole, spesso usati per modulare ebollizione e congelamento. Attenzione: alcuni elenchi includono l’etanolo, ma l’etanolo è in realtà piuttosto volatile; nell’analisi ebulioscopica classica si considerano soluti con pressione di vapore trascurabile rispetto al solvente.
Liquidi ad alto punto di ebollizione: usi, esempi e controesempi
In ambito industriale, liquidi con alto punto di ebollizione sono impiegati dove servono stabilità termica e sicurezza operativa, per esempio come fluidi termovettori, in estrazioni ad alta temperatura o in alcune fasi di distillazione dove non conviene che il solvente evapori facilmente.
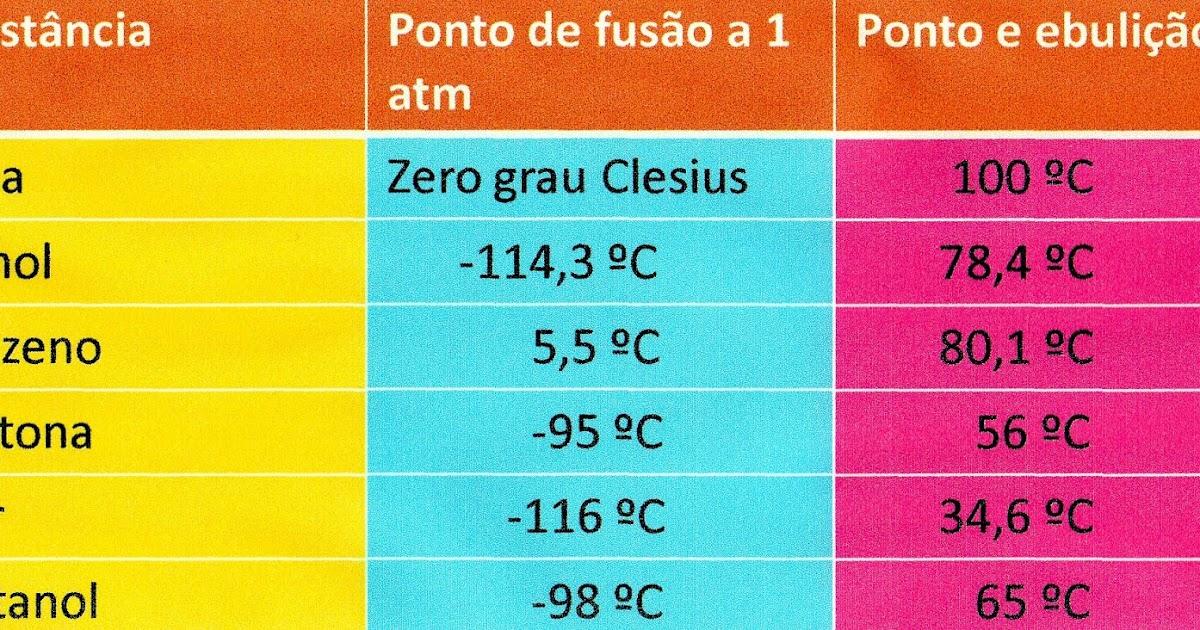
Esempi e osservazioni utili: l’acqua bolle a ~100 °C a 1 atm; il mercurio, metallo liquido, ha un punto di ebollizione molto alto; etanolo e acqua mostrano punti di ebollizione differenti (l’etanolo bolle più in basso, ~78 °C). La pressione esterna influenza sempre il valore misurato del punto di ebollizione.
Le interazioni intermolecolari contano molto: le sostanze che formano legami a idrogeno tendono ad avere punti di ebollizione elevati. All’aumentare della massa molare, crescono anche le forze di dispersione di London: ecco perché il decano (~174 °C) bolle più in alto dell’esano (~68,7 °C).
Nella pratica di laboratorio, solventi come DMSO (189 °C) e DMF sono preziosi perché permettono reazioni a temperature sostenute senza perdere rapidamente il mezzo. I liquidi ionici, sali liquidi a bassa temperatura, uniscono bassa volatilità e stabilità, risultando utili in estrazione e catalisi.
Nota sui refrigeranti: spesso si desiderano fluidi con punto di ebollizione relativamente basso (alle pressioni operative) per assorbire calore evaporando; in altri casi, invece, si usano fluidi termici ad alto punto di ebollizione per trasportare calore senza cambi di fase. La scelta dipende dall’applicazione e dal profilo di pressione-temperatura richiesto.
Esperimento domestico: osservare l’effetto ebulioscopico
Materiale necessario: acqua, zucchero, un recipiente che possa andare sul fuoco.
Procedura sintetica: 1) porta a ebollizione un bicchiere d’acqua; 2) al primo bollore, aggiungi tre cucchiai di zucchero mescolando; 3) osserva la momentanea cessazione del bollore e l’attesa necessaria per farlo riprendere.
Spiegazione: le particelle di soluto riducono la pressione di vapore della soluzione alla stessa temperatura; per ritornare all’uguaglianza con la pressione esterna, serve una temperatura più alta, e di conseguenza il bollore riparte solo dopo un ulteriore riscaldamento.
Clausius–Clapeyron e i contributi storici
La relazione tra pressione di vapore e temperatura si può descrivere con l’equazione di Clausius–Clapeyron: ln(P2/P1) = −ΔHvap/R · (1/T1 − 1/T2), dove ΔHvap è l’entalpia di vaporizzazione e R la costante dei gas. Questa formula consente di stimare come varia il punto di ebollizione al variare della pressione.
Pilastri storici: Robert Boyle gettò le basi della termodinamica dei gas; Antoine Lavoisier raffinò le misure su gas e liquidi introducendo rigore quantitativo; Svante Arrhenius illuminò il ruolo della ionizzazione e delle interazioni in soluzione, fondamentali per capire il fattore i; Gilbert N. Lewis e Linus Pauling chiarirono la natura dei legami e in particolare dei legami a idrogeno, spiegando perché l’acqua abbia un comportamento termico così peculiare.
Esempi ed esercizi (con soluzione)
Esercizio 1 (Fuvest): a parità di pressione, confronta le temperature di ebollizione e congelamento di una soluzione acquosa di zucchero con quelle dell’acqua pura. Opzioni: a) entrambe maggiori per la soluzione; b) entrambe minori; c) ebollizione maggiore e congelamento minore per la soluzione; d) ebollizione minore e congelamento maggiore per la soluzione; e) stessa ebollizione e congelamenti diversi.
Soluzione corretta: c). In presenza di soluto non volatile, il punto di ebollizione aumenta (ebulioscopia) e il punto di congelamento diminuisce (crioscopia) rispetto al solvente puro: più particelle, maggiore l’effetto.
Esercizio 2 (Unesp): tre soluzioni acquose diluite di uguale molarità: KNO3, MgSO4 e Cr(NO3)3. Quale ha il punto di congelamento più basso? Opzioni: a) uguali; b) KNO3 < MgSO4 < Cr(NO3)3; c) Cr(NO3)3; d) dipende dal volume; e) tutte maggiori dell’acqua.
Soluzione corretta: c). Considera il numero di particelle: KNO3 → K+ + NO3− (2 particelle), MgSO4 → Mg2+ + SO4^2− (2 particelle), Cr(NO3)3 → Cr3+ + 3 NO3− (4 particelle). Più particelle generano un abbassamento crioscopico maggiore, quindi Cr(NO3)3 determina la temperatura di congelamento più bassa.
Risorse e spunti per approfondire
Per esercitarti e rivedere i concetti con schemi e tabelle, può esserti utile consultare materiali di supporto e dispense accademiche. Un esempio: scarica un PDF introduttivo sull’ebuliometria. Inoltre, molte video-lezioni di Fisico-Chimica illustrano l’esperimento del “sale che ferma il bollore” e i diagrammi pressione–temperatura correlati.
L’ebulioscopia unisce teoria e pratica con eleganza: dal legame tra pressione di vapore e pressione esterna, passando per la legge di Raoult e la formula ΔTe = Ke · b · i, fino ai casi reali di cucine, laboratori e impianti industriali. Comprendere come il numero di particelle (e quindi la dissociazione elettrolitica, tramite il fattore i) moduli l’innalzamento del punto di ebollizione, insieme all’influenza della pressione atmosferica e delle forze intermolecolari, rende più semplice progettare processi, interpretare esperimenti e scegliere solventi e additivi con cognizione di causa in un’ampia gamma di situazioni.