O espectro de absorção é um fenômeno observado quando a luz passa através de um material e é absorvida em diferentes comprimentos de onda. Existem diversos tipos de espectro de absorção, sendo os mais comuns o espectro de absorção atômica, o espectro de absorção visível e o espectro de absorção em moléculas. Cada um desses tipos de espectro de absorção fornece informações importantes sobre a composição e propriedades dos materiais estudados, sendo amplamente utilizados em áreas como química, física e biologia. Neste contexto, este artigo abordará de forma sucinta cada um desses tipos de espectro de absorção e suas aplicações práticas.
Diferença entre espectroscopia de absorção atômica e molecular: entenda suas características distintas.
A espectroscopia de absorção é uma técnica amplamente utilizada em química analítica para determinar a concentração de diferentes substâncias em uma amostra. Existem várias formas de espectroscopia de absorção, incluindo a absorção atômica e a absorção molecular. Vamos entender as diferenças entre essas duas técnicas.
A espectroscopia de absorção atômica é utilizada para analisar elementos químicos individuais em uma amostra. Ela se baseia na absorção de radiação eletromagnética por átomos em diferentes estados de energia. Já a espectroscopia de absorção molecular, por outro lado, é utilizada para analisar moléculas complexas, como compostos orgânicos, e envolve a absorção de radiação por ligações químicas entre átomos na molécula.
Uma das principais diferenças entre a absorção atômica e a absorção molecular é o tipo de amostra que pode ser analisada. Enquanto a absorção atômica é mais adequada para análise de elementos individuais, a absorção molecular é mais adequada para análise de compostos complexos. Além disso, a absorção atômica geralmente é realizada em comprimentos de onda na região do ultravioleta e visível, enquanto a absorção molecular pode ocorrer em uma gama mais ampla de comprimentos de onda, incluindo o infravermelho.
Em resumo, a absorção atômica e a absorção molecular são técnicas diferentes de espectroscopia de absorção, cada uma com suas próprias características distintas. Enquanto a absorção atômica é utilizada para analisar elementos individuais em uma amostra, a absorção molecular é mais adequada para analisar compostos complexos. Ambas as técnicas são amplamente utilizadas em laboratórios de química analítica para determinar a concentração de diferentes substâncias em amostras.
Conceito e aplicações da espectroscopia de absorção molecular: entenda sua importância na química analítica.
A espectroscopia de absorção molecular é uma técnica analítica utilizada para identificar e quantificar substâncias com base na absorção de radiação eletromagnética por moléculas. Esta técnica é amplamente utilizada em diversas áreas da química, como na análise de compostos orgânicos, inorgânicos, e até mesmo na determinação de concentração de metais em soluções.
A absorção molecular ocorre quando as moléculas absorvem energia de uma fonte de radiação eletromagnética, resultando em transições eletrônicas ou vibracionais. O espectro de absorção é gerado a partir da relação entre a intensidade da radiação absorvida e comprimento de onda da radiação incidente.
Na espectroscopia de absorção molecular, existem diferentes tipos de espectros, como o espectro de absorção atômica, que é utilizado para analisar a concentração de átomos em solução, o espectro de absorção visível, que é utilizado para identificar compostos orgânicos coloridos, e o espectro de absorção em moléculas, que é aplicado na análise de compostos orgânicos e inorgânicos.
A importância da espectroscopia de absorção molecular na química analítica se deve à sua capacidade de fornecer informações precisas sobre a composição química de uma amostra, permitindo a identificação de substâncias desconhecidas, a determinação da concentração de compostos em solução, e até mesmo a monitorização de reações químicas em tempo real.
Em resumo, a espectroscopia de absorção molecular é uma técnica poderosa e versátil, que desempenha um papel fundamental na química analítica, contribuindo para o avanço da ciência e tecnologia em diversas áreas.
Entendendo o funcionamento do espectro de absorção em processos químicos e físicos.
Entendendo o funcionamento do espectro de absorção em processos químicos e físicos, podemos observar como a absorção atômica, visível e em moléculas ocorrem de maneira específica em cada caso. O espectro de absorção é uma técnica utilizada para analisar a interação da luz com a matéria, permitindo identificar elementos químicos e determinar concentrações de substâncias.
A absorção atômica ocorre quando átomos absorvem energia luminosa em comprimentos de onda específicos, levando a transições eletrônicas que resultam em um espectro característico para cada elemento. Essa técnica é amplamente utilizada em análises químicas, especialmente na determinação de metais em soluções.
Já a absorção visível envolve a interação da luz visível com moléculas, resultando em transições eletrônicas que podem ser observadas em determinados comprimentos de onda. Essa técnica é comumente utilizada em estudos de compostos orgânicos e inorgânicos, permitindo identificar grupos funcionais e realizar análises quantitativas.
Por fim, a absorção em moléculas refere-se à capacidade das moléculas de absorver determinados comprimentos de onda da luz, resultando em espectros de absorção únicos para cada substância. Essa técnica é essencial em estudos de estrutura molecular, identificação de compostos orgânicos e análises de misturas complexas.
Em resumo, o espectro de absorção em processos químicos e físicos permite obter informações valiosas sobre a composição e propriedades das substâncias, sendo uma ferramenta fundamental em diversas áreas da ciência. Ao compreender como a absorção atômica, visível e em moléculas funcionam, é possível realizar análises precisas e avançar no conhecimento científico.
Entenda o funcionamento da espectrofotometria de absorção atômica em detalhes claros e práticos.
A espectrofotometria de absorção atômica é uma técnica analítica utilizada para determinar a concentração de elementos químicos em uma amostra. O princípio por trás dessa técnica é a absorção de radiação eletromagnética por átomos em estados excitados.
Para realizar a análise, a amostra é atomizada e introduzida em um feixe de luz de uma determinada frequência. Os átomos do elemento de interesse absorvem a energia da radiação, passando para um estado excitado. A quantidade de radiação absorvida é proporcional à concentração do elemento na amostra.
Um detector mede a intensidade da radiação que passou pela amostra e compara com a intensidade inicial. A diferença entre essas duas intensidades é utilizada para calcular a concentração do elemento na amostra. Este processo é repetido para diferentes frequências de radiação, gerando um espectro de absorção.
A espectrofotometria de absorção atômica é amplamente utilizada em diversas áreas, como química, biologia, geologia e indústria. Ela permite a análise de uma grande variedade de elementos, com alta sensibilidade e precisão.
Em resumo, a espectrofotometria de absorção atômica é uma técnica poderosa e versátil para a determinação de concentrações de elementos em amostras, baseada na absorção de radiação eletromagnética por átomos em estados excitados.
Espectro de absorção: absorção atômica, visível e em moléculas
Um espectro de absorção é o produto da interação da luz com um material ou substância em qualquer um de seus estados físicos. Mas a definição vai além de uma simples luz visível, uma vez que a interação compreende uma ampla faixa do comprimento de onda e da faixa de energia da radiação eletromagnética.
Portanto, alguns sólidos, líquidos ou gases podem absorver fótons de diferentes energias ou comprimentos de onda; da radiação ultravioleta, seguida pela luz visível, à radiação ou luz infravermelha, com variações de comprimento de onda de microondas.
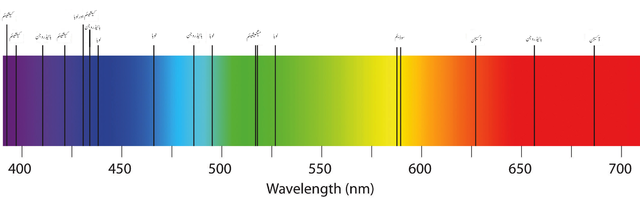
O olho humano percebe apenas as interações da matéria com a luz visível. Também é capaz de contemplar a difração da luz branca através de um prisma ou meio em seus componentes coloridos (imagem acima).
Se o raio de luz fosse “capturado” depois de percorrer um material e analisado, seria encontrada a ausência de certas faixas de cores; isto é, listras pretas seriam vistas contrastando com o fundo. Esse é o espectro de absorção e sua análise é fundamental na química analítica instrumental e na astronomia.
Absorção atômica
Na imagem acima, é mostrado um espectro de absorção típico dos elementos ou átomos. Observe que as faixas pretas representam os comprimentos de onda absorvidos, enquanto as outras são as emitidas. Isso significa que, pelo contrário, um espectro de emissão atômica pareceria uma faixa preta com faixas de cores emitidas.
Mas o que são essas listras? Como saber em poucas palavras se os átomos absorvem ou emitem (sem introduzir fluorescência ou fosforescência)? As respostas recaem sobre os estados eletrônicos permitidos dos átomos.
Transições e energias eletrônicas
Os elétrons são capazes de se afastar do núcleo, deixando-o carregado positivamente enquanto transitam de um orbital de menos energia para um de maior energia. Para fazer isso, explicado pela física quântica, eles absorvem fótons de uma energia específica para realizar a referida transição eletrônica.
Portanto, a energia é quantizada e não absorve meio ou três quartos de um fóton, mas os valores da frequência do concreto (ν) ou do comprimento de onda (λ).
Uma vez que o elétron é excitado, ele não permanece por um tempo ilimitado no estado eletrônico de maior energia; libera energia na forma de um fóton e o átomo retorna ao seu estado basal ou original.
Dependendo se os fótons absorvidos são registrados, um espectro de absorção será obtido; e se os fótons emitidos forem registrados, o resultado será um espectro de emissão.
Esse fenômeno pode ser observado experimentalmente se amostras gasosas ou atomizadas de um elemento forem aquecidas. Na astronomia, a comparação desses espectros pode conhecer a composição de uma estrela e até sua localização em relação à Terra.
Espectro visível
Como pode ser visto nas duas primeiras imagens, o espectro visível inclui cores de violeta a vermelho e todas as suas tonalidades em relação à quantidade que o material absorve (tonalidades escuras).
Os comprimentos de onda da luz vermelha correspondem a valores de 650 nm em diante (até desaparecer na radiação infravermelha). E na extrema esquerda, os tons violeta e roxo cobrem os valores de comprimento de onda de até 450 nm. O espectro visível varia então de aproximadamente 400 a 700 nm.
À medida que λ aumenta, a frequência do fóton diminui e, portanto, sua energia. Assim, a luz violeta tem mais energia (comprimentos de onda mais curtos) do que a luz vermelha (comprimentos de onda mais longos). Portanto, um material que absorve a luz púrpura implica transições eletrônicas de energias mais altas.
E se o material absorver a cor violeta, que cor ele refletirá? Ele ficará amarelo esverdeado, o que significa que seus elétrons fazem transições muito energéticas; enquanto que se o material absorver a cor vermelha, de menor energia, ele refletirá uma cor verde azulada.
Quando um átomo é muito estável, geralmente possui estados eletrônicos muito distantes em energia; e, portanto, você precisará absorver fótons de maior energia para permitir transições eletrônicas:
Espectro de absorção de moléculas
Moléculas têm átomos, e eles também absorvem radiação eletromagnética; no entanto, seus elétrons fazem parte da ligação química , portanto suas transições são diferentes. Um dos grandes triunfos da teoria orbital molecular é poder relacionar os espectros de absorção com a estrutura química.
Assim, ligações simples, duplas, triplas, conjugadas e estruturas aromáticas têm seus próprios estados eletrônicos; e, portanto, eles absorvem fótons muito específicos.
Tendo vários átomos, além das interações intermoleculares e das vibrações de suas ligações (que também absorvem energia), os espectros de absorção das moléculas são modelados como “montanhas”, que indicam as bandas que compreendem os comprimentos de onda onde ocorrem transições eletrônicas.
Graças a esses espectros, um composto pode ser caracterizado, identificado e até, por análise multivariada, quantificado.
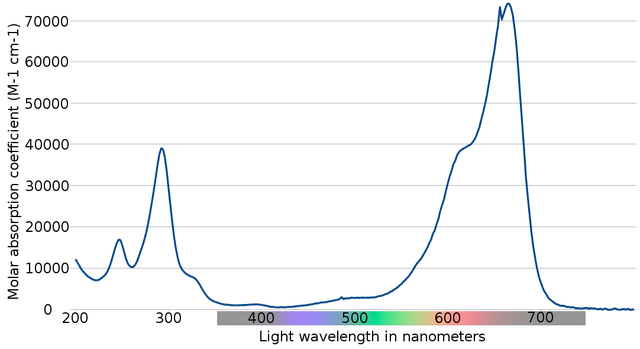
Azul de metileno
O espectro do indicador azul de metileno é mostrado na imagem acima. Como o nome evidentemente indica, é azul; Mas pode ser verificado com seu espectro de absorção?
Observe que existem bandas entre os comprimentos de onda de 200 e 300 nm. Entre 400 e 500 nm, quase não há absorção, ou seja, não absorve as cores violeta, azul ou verde.
No entanto, possui uma banda de absorção intensa após 600 nm e, portanto, possui transições eletrônicas de baixa energia que absorvem fótons de luz vermelha.
Consequentemente, e dados os altos valores das absorvências molares, o azul de metileno exibe uma cor azul intensa.
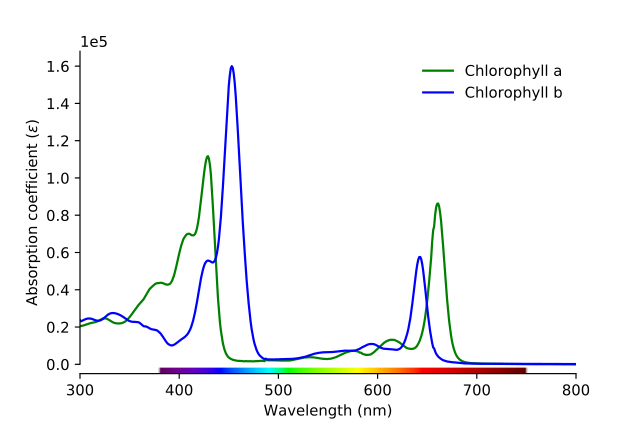
Clorofilas aeb
Como pode ser visto na imagem, a linha verde corresponde ao espectro de absorção da clorofila a, enquanto a linha azul corresponde à da clorofila b.
Primeiro, as bandas onde as absorvências molares são maiores devem ser comparadas; neste caso, os da esquerda, entre 400 e 500 nm. A clorofila a absorve fortemente as cores roxas, enquanto a clorofila b (linha azul) o faz com a cor azul.
Ao absorver a clorofila b em torno de 460 nm, o azul reflete a cor amarela. Por outro lado, ele também absorve intensamente cerca de 650 nm, a luz laranja, o que significa que exibe a cor azul. Se as cores amarela e azul se misturam, qual é o resultado? Cor verde.
E, finalmente, a clorofila absorve a cor violeta azulada e também uma luz vermelha perto de 660 nm. Portanto, exibe uma cor verde “suavizada” pelo amarelo.
Referências
- Observatório de Paris. (sf). Os diferentes tipos de espectros. Recuperado de: media4.obspm.fr
- Campus Universitário de Rabanales. (sf). Espectrofometria: espectros de absorção e quantificação colorimétrica de biomoléculas. [PDF]. Recuperado de: uco.es
- Day, R. & Underwood, A. (1986). Quantitative Analytical Chemistry (quinta ed.). PEARSON, Prentice Hall, p. 461-464.
- Reush W. (sf). Espectroscopia visível e ultravioleta. Recuperado de: 2.chemistry.msu.edu
- David Darling (2016). Espectro de Absorção Recuperado de: daviddarling.info
- Khan Academy (2018). Linhas de absorção / emissão. Recuperado de: khanacademy.org