A estrutura de Lewis é uma representação visual que mostra os átomos e as ligações entre eles em uma molécula. Ela é utilizada para entender a distribuição dos elétrons ao redor dos átomos e prever a geometria molecular. A estrutura de Lewis é feita colocando-se os símbolos dos elementos químicos no papel e conectando-os com pares de elétrons representados por pontos. Além disso, são utilizadas regras específicas para distribuir os elétrons de valência de forma a minimizar a carga formal nos átomos.
Um exemplo simples de estrutura de Lewis é a molécula de água (H2O), onde o oxigênio está ligado a dois átomos de hidrogênio por meio de ligações covalentes. O oxigênio possui 6 elétrons de valência, enquanto o hidrogênio possui 1 elétron de valência. Portanto, o oxigênio compartilha um par de elétrons com cada hidrogênio, formando assim a estrutura de Lewis da molécula de água.
Estrutura de Lewis: entenda como é feita a representação dos elétrons dos átomos.
A Estrutura de Lewis é uma forma de representar os elétrons dos átomos utilizando símbolos e linhas. Essa representação ajuda a visualizar a distribuição dos elétrons na camada de valência dos átomos, facilitando a compreensão de como os átomos interagem entre si para formar ligações químicas.
Para fazer a Estrutura de Lewis de um átomo, primeiro é necessário conhecer o número de elétrons da camada de valência. Os elétrons são representados por pontos (•) e são distribuídos ao redor do símbolo do elemento químico de acordo com a regra do octeto, que diz que os átomos tendem a completar a camada de valência com 8 elétrons.
Um exemplo simples de Estrutura de Lewis é o átomo de oxigênio, que possui 6 elétrons na camada de valência. Nesse caso, o símbolo do oxigênio (O) é rodeado por 6 pontos representando os elétrons da camada de valência.
Outro exemplo é a molécula de água (H2O), onde o átomo de oxigênio compartilha elétrons com os átomos de hidrogênio. Na Estrutura de Lewis da molécula de água, o oxigênio está rodeado por 2 pares de elétrons não ligantes e 2 elétrons compartilhados com cada átomo de hidrogênio.
Em resumo, a Estrutura de Lewis é uma ferramenta importante para entender as ligações químicas entre os átomos, pois permite visualizar de forma clara a distribuição dos elétrons na camada de valência. É uma representação simples e eficaz que auxilia no estudo da química.
Passo a passo para desenhar a estrutura de Lewis de moléculas e íons.
Para desenhar a estrutura de Lewis de moléculas e íons, siga estes passos simples.
Passo 1: Calcule o número total de elétrons de valência na molécula ou íon. Este número é determinado pela posição do elemento na tabela periódica.
Passo 2: Escolha o átomo central na molécula. Este será geralmente o átomo menos eletronegativo.
Passo 3: Coloque os átomos ligados ao átomo central ao redor dele, utilizando uma ligação para cada par de elétrons compartilhados entre os átomos.
Passo 4: Distribua os elétrons restantes ao redor dos átomos para satisfazer a regra do octeto, ou seja, cada átomo deve ter 8 elétrons de valência.
Passo 5: Se ainda houver elétrons restantes, coloque-os no átomo central como pares não ligantes.
Com estes passos, você será capaz de desenhar a estrutura de Lewis de moléculas e íons de forma clara e precisa. Agora, vamos ver alguns exemplos de estruturas de Lewis.
Entenda o conceito da Lei de Lewis, fundamental para compreender a ligação entre átomos.
A Estrutura de Lewis é uma representação gráfica dos elétrons de valência de um átomo, proposta pelo químico Gilbert Lewis. Essa representação é fundamental para entender a ligação entre átomos, pois mostra como os elétrons são compartilhados ou transferidos durante a formação de ligações químicas.
De acordo com a Lei de Lewis, um átomo tende a completar sua camada de valência com oito elétrons, seguindo o princípio do octeto. Isso pode ser alcançado por meio de ligações iônicas, covalentes ou metálicas.
Para representar a Estrutura de Lewis de um átomo, devemos primeiro contar o número de elétrons de valência. Em seguida, desenhamos o símbolo do átomo e representamos os elétrons de valência ao redor dele, em pares ou solitários.
Por exemplo, o átomo de oxigênio tem 6 elétrons de valência. Portanto, em sua Estrutura de Lewis, desenhamos o símbolo do oxigênio (O) e colocamos seis elétrons ao redor dele, distribuídos em pares e solitários.
Compreender a Estrutura de Lewis é essencial para prever como os átomos se ligam entre si, formando moléculas e compostos químicos. Ao dominar esse conceito, é possível compreender melhor as propriedades e comportamentos dos diferentes elementos químicos.
A relevância da estrutura de Lewis e geometria molecular na química moderna.
A estrutura de Lewis é uma representação gráfica utilizada na química para mostrar a distribuição dos elétrons em uma molécula. Ela foi desenvolvida pelo químico Gilbert N. Lewis no início do século XX e é fundamental para compreender a ligação química e a geometria molecular.
Para representar a estrutura de Lewis de uma molécula, seguimos algumas regras simples. Cada átomo é representado pelo seu símbolo químico e os elétrons de valência são representados por pontos ao redor do átomo. Os elétrons são distribuídos de forma a satisfazer a regra do octeto, ou seja, cada átomo tende a completar oito elétrons na sua camada de valência.
A estrutura de Lewis é importante porque nos permite prever o comportamento químico de uma molécula, como a sua reatividade e propriedades físicas. Além disso, a geometria molecular, que é determinada pela distribuição dos elétrons ao redor dos átomos, influencia diretamente nas propriedades da substância, como o seu ponto de fusão e ebulição.
Portanto, a estrutura de Lewis e a geometria molecular são ferramentas essenciais na química moderna, ajudando os cientistas a entenderem melhor as substâncias e a desenvolverem novos materiais com aplicações em diversas áreas, como a medicina, a indústria e a tecnologia.
Estrutura de Lewis: o que é, como é feito, exemplos
A estrutura de Lewis é qualquer representação das ligações covalentes dentro de uma molécula ou ião. Nele, as referidas ligações e elétrons são representados por pontos longos ou traços, embora na maioria das vezes os pontos correspondam a elétrons não compartilhados e traços a ligações covalentes.
Mas o que é uma ligação covalente? É o compartilhamento de um par de elétrons (ou pontos) entre dois átomos da tabela periódica. Com esses diagramas, muitos esqueletos de um determinado composto podem ser esboçados. Qual deles está correto dependerá das cargas formais e da natureza química dos próprios átomos.
Na imagem acima, há um exemplo do que é uma estrutura de Lewis. Neste caso, o composto representado é 2-bromopropano. Você pode ver os pontos pretos correspondentes aos elétrons, tanto os que participam das ligações quanto os que não são compartilhados (o único par logo acima do Br).
Se os pares de pontos “:” fossem substituídos por um traço longo “-“, o esqueleto de carbono do 2-bromopropano seria representado como: C – C – C. Por que, em vez da “estrutura molecular” desenhada, não poderia ser C – H – H – C? A resposta está nas características eletrônicas de cada átomo.
Assim, como o hidrogênio tem um único elétron e um único orbital disponível para preenchimento, ele forma apenas uma ligação covalente. Portanto, nunca pode formar duas ligações (não deve ser confundida com ligações de hidrogênio ). Por outro lado, a configuração eletrônica do átomo de carbono permite (e requer) a formação de quatro ligações covalentes.
Por esse motivo, as estruturas de Lewis onde C e H intervêm devem ser consistentes e respeitar as regras de suas configurações eletrônicas. Dessa maneira, se o carbono tiver mais de quatro ligações ou o hidrogênio mais de uma, o esboço poderá ser descartado e um novo, mais alinhado à realidade, poderá começar.
É aqui que um dos principais motivos ou endossos dessas estruturas aparece, introduzido por Gilbert Newton Lewis em sua busca por representações moleculares fiéis aos dados experimentais: estrutura molecular e cargas formais.
Todos os compostos existentes podem ser representados por estruturas de Lewis, dando uma primeira aproximação de como a molécula ou os íons poderiam ser.
Qual é a estrutura de Lewis?
É uma estrutura representativa de elétrons de valência e ligações covalentes em uma molécula ou íon que serve para ter uma idéia de sua estrutura molecular.
No entanto, essa estrutura falha em prever alguns detalhes importantes, como a geometria molecular em relação a um átomo e seu ambiente (se for quadrado, plano trigonal, bipiramidal etc.).
Também não diz nada sobre o que é a hibridação química de seus átomos, mas onde estão localizadas as ligações duplas ou triplas e se há ressonância na estrutura.
Com essas informações, pode-se discutir sobre a reatividade de um composto, sua estabilidade, como e qual mecanismo a molécula seguirá quando reagir.
Por esse motivo, as estruturas de Lewis nunca deixam de ser consideradas e são muito úteis, pois podem condensar novos aprendizados químicos.
Como se faz?
Para desenhar ou esboçar uma estrutura, fórmula ou diagrama de Lewis, a fórmula química do composto é essencial. Sem ele, você nem consegue saber quais são os átomos que o compõem. Depois disso, a tabela periódica é usada para localizar a quais grupos eles pertencem.
Por exemplo, se você possui o composto C 14 O 2 N 3 , deve procurar os grupos onde estão carbono, oxigênio e nitrogênio. Isso feito, independentemente do composto, o número de elétrons de valência permanece o mesmo, para que mais cedo ou mais tarde eles sejam memorizados.
Assim, o carbono pertence ao grupo IVA, o oxigênio ao grupo VIA e o nitrogênio ao VA. O número do grupo é igual ao número de elétrons (pontos) de valência. Todos eles têm em comum a tendência de completar o octeto da camada de valência.
Isso se aplica a todos os elementos não metálicos ou encontrados nos blocos de sopro da tabela periódica. No entanto, nem todos os elementos obedecem à regra do octeto. Casos particulares são metais de transição, cujas estruturas se baseiam mais em cobranças formais e no número do grupo.
Aplicando a fórmula matemática
Sabendo a qual grupo os elementos pertencem e, portanto, o número de elétrons de valência disponíveis para formar ligações, prosseguimos com a seguinte fórmula, útil para desenhar estruturas de Lewis:
C = N – D
Onde C significa elétrons compartilhados , isto é, aqueles que participam de ligações covalentes. Como cada link é composto de dois elétrons, C / 2 é igual ao número de links (ou traços) que devem ser desenhados.
N são os elétrons necessários , que devem ter o átomo em sua camada de valência para ser isoeletrônicos ao gás nobre que se segue no mesmo período. Para todos os elementos que não H (uma vez que requer dois elétrons para comparar com He), eles precisam de oito elétrons.
D são os elétrons disponíveis , determinados pelo grupo ou pelo número de elétrons de valência. Assim, como Cl pertence ao grupo VIIA, ele deve ser cercado por sete pontos pretos ou elétrons, e lembre-se de que é necessário um par para formar uma ligação.
Tendo os átomos, seus pontos e o número de ligações C / 2, uma estrutura de Lewis pode então ser improvisada. Além disso, é necessário ter uma noção de outras “regras”.
Onde colocar os átomos menos eletronegativos
Os átomos menos eletronegativos na grande maioria das estruturas ocupam os centros. Por esse motivo, se você possui um composto com átomos de P, O e F, P deve, portanto, estar no centro da estrutura hipotética.
Além disso, é importante observar que os hidrogênios normalmente se ligam a átomos muito eletronegativos. Se você tiver um composto Zn, H e O, H seguirá para O e não com Zn (Zn – O – H e não H – Zn – O). Há exceções a essa regra, mas geralmente ocorre com átomos não metálicos.
Simetria e encargos formais
A natureza tem uma grande preferência por originar estruturas moleculares o mais simétricas possível. Isso ajuda a evitar o posicionamento de estruturas desordenadas, com átomos dispostos de tal maneira que eles não obedeçam a nenhum padrão aparente.
Por exemplo, para o composto C 2 A 3 , onde A é um átomo fictício, a estrutura mais provável seria A – C – A – C – A. Observe a simetria de seus lados, ambos reflexos do outro.
As cobranças formais também desempenham um papel importante ao desenhar estruturas de Lewis, especialmente para íons. Assim, os links podem ser adicionados ou removidos para que a carga formal de um átomo corresponda à carga total exibida. Este critério é muito útil para compostos de metais de transição.
Limitações na regra do octeto
Nem todas as regras são atendidas, o que não significa necessariamente que a estrutura esteja incorreta. Exemplos típicos disso são observados em muitos compostos onde elementos do grupo IIIA (B, Al, Ga, In, Tl) intervêm. Aqui, o trifluoreto de alumínio (AlF 3 ) é considerado especificamente .
Aplicando a fórmula descrita acima, você tem:
D = 1 × 3 (um átomo de alumínio) + 7 × 3 (três átomos de flúor) = 24 elétrons
Aqui 3 e 7 são os respectivos grupos ou números de elétrons de valência disponíveis para alumínio e flúor. Então, considerando os elétrons necessários N:
N = 8 × 1 (um átomo de alumínio) + 8 × 3 (três átomos de flúor) = 32 elétrons
E, portanto, os elétrons compartilhados são:
C = N – D
C = 32 – 24 = 8 elétrons
C / 2 = 4 links
Como o alumínio é o átomo menos eletronegativo, ele deve ser colocado no centro e o flúor apenas forma uma ligação. Considerando isso, temos a estrutura de Lewis de AlF 3 (imagem superior). Os elétrons compartilhados são destacados com pontos verdes para diferenciá-los dos não-compartilhados.
Embora os cálculos prevejam a existência de 4 ligações que devem ser formadas, o alumínio carece de elétrons suficientes e também não existe um quarto átomo de flúor. Como resultado, o alumínio não cumpre a regra do octeto e esse fato não se reflete nos cálculos.
Exemplos de estruturas de Lewis
Iodo
O iodo é um halogênio e, portanto, pertence ao grupo VIIA. Possui sete elétrons de valência, e essa molécula diatômica simples pode ser representada improvisando ou aplicando a fórmula:
D = 2 × 7 (dois átomos de iodo) = 14 elétrons
N = 2 × 8 = 16 elétrons
C = 16-14 = 2 elétrons
C / 2 = 1 link
Como 14 elétrons 2 participam da ligação covalente (pontos e traços verdes), 12 permanecem como não compartilhados; e por serem dois átomos de iodo, 6 devem ser distribuídos a um deles (seus elétrons de valência). Somente essa estrutura é possível nesta molécula, cuja geometria é linear.
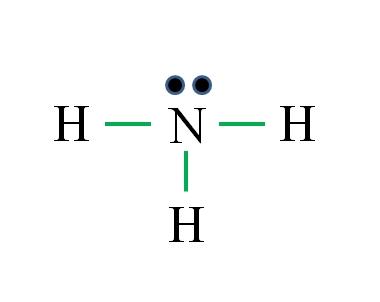
Amoníaco
Qual é a estrutura de Lewis para a molécula de amônia? Como o nitrogênio é do grupo VA, ele possui cinco elétrons de valência e, em seguida:
D = 1 × 5 (um átomo de nitrogênio) + 1 × 3 (três átomos de hidrogênio) = 8 elétrons
N = 8 × 1 + 2 × 3 = 14 elétrons
C = 14 – 8 = 6 elétrons
C / 2 = 3 links
Desta vez, a fórmula está correta com o número de links (três links verdes). Como os 8 elétrons disponíveis 6 participam das ligações, existe um par não compartilhado localizado acima do átomo de nitrogênio.
Essa estrutura diz tudo o que deve ser conhecido sobre a base de amônia. Aplicando o conhecimento de TEV e TRPEV, segue-se que a geometria é distorcida tetraédrica pelo par livre de nitrogênio e, portanto, sua hibridação é sp 3 .
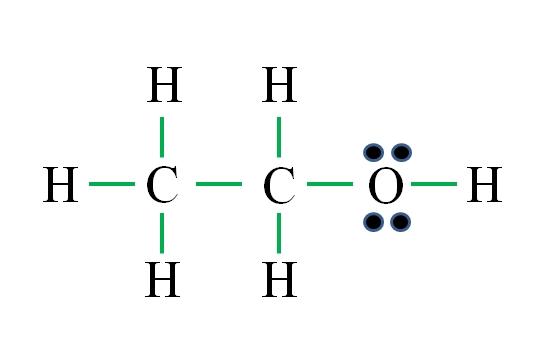
C 2 H 6 O
A fórmula corresponde a um composto orgânico. Antes de aplicar a fórmula, deve-se lembrar que os hidrogênios formam uma ligação simples, oxigênio dois, carbono quatro e que a estrutura deve ser o mais simétrica possível. Prosseguindo como nos exemplos anteriores, você tem:
D = 6 × 1 (seis átomos de hidrogênio) + 6 × 1 (um átomo de oxigênio) + 4 × 2 (dois átomos de carbono) = 20 elétrons
N = 6 × 2 (seis átomos de hidrogênio) + 8 × 1 (um átomo de oxigênio) + 8 × 2 (dois átomos de carbono) = 36 elétrons
C = 36 – 20 = 16 elétrons
C / 2 = 8 links
O número de traços verdes corresponde aos 8 links calculados. estrutura de Lewis é proposto etanol CH 3 CH 2 OH. No entanto, isto também teria sido correcta propor estrutura dimetílico CH 3 OCH 3 , que é mais simétrica.
Qual dos dois é “mais” correto? Ambos são iguais, uma vez que as estruturas emergiram como isômeros estruturais da mesma fórmula molecular C 2 H 6 O.
Íon permanganato
A situação é complicada quando se deseja criar estruturas de Lewis para compostos de metais de transição. O manganês pertence ao grupo VIIB. Da mesma forma, o elétron da carga negativa deve ser adicionado entre os elétrons disponíveis. Aplicando a fórmula que você possui:
D = 7 × 1 (um átomo de manganês) + 6 × 4 (quatro átomos de oxigênio) + 1 elétron por carga = 32 elétrons
N = 8 × 1 + 8 × 4 = 40 elétrons
C = 40 – 32 = 8 elétrons compartilhados
C / 2 = 4 links
No entanto, os metais de transição podem ter mais de oito elétrons de valência. Além disso, para o ião MnO 4 – expor a carga negativa é necessária para diminuir as cargas formais de átomos de oxigénio. Como Através dos links duplos.
Se todos os links de MnO 4 – eram simples, acusações formais de oxigênios seria igual a -1. Como existem quatro, a carga resultante seria -4 para o ânion, o que obviamente não é verdade. Quando as ligações duplas são formadas, é garantido que um único oxigênio tenha uma carga formal negativa, refletida no íon.
No íon permanganato, pode-se ver que há ressonância. Isso implica que a única ligação simples Mn – O é deslocalizada entre os quatro átomos de O.
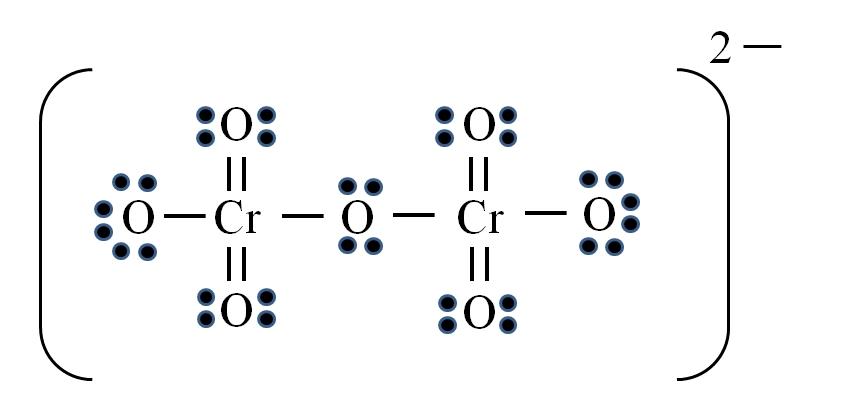
Dicromato Iônico
Finalmente, um caso semelhante ocorre com o íon dicromato (Cr 2 O 7 ). O cromo pertence ao grupo VIB, por isso possui seis elétrons de valência. Aplicando a fórmula novamente:
D = 6 × 2 (dois átomos de cromo) + 6 × 7 (sete átomos de oxigênio) + 2 elétrons por carga divalente = 56 elétrons
N = 8 × 2 + 8 × 7 = 72 elétrons
C = 72 – 56 = 16 elétrons compartilhados
C / 2 = 8 links
Mas não há 8 elos, mas 12. Pelas mesmas razões encontradas, no íon permanganato, deve ser deixado dois oxigênio com cargas formais negativas que somam -2, a carga do íon dicromato.
Assim, são adicionados quantos links duplos forem necessários. Dessa maneira, a estrutura de Lewis da imagem para Cr 2 O 7 2– é atingida .
Referências
- Whitten, Davis, Peck e Stanley. Química (8a ed.). Aprendizagem CENGAGE, p 251.
- Estruturas de Lewis Retirado de: chemed.chem.purdue.edu
- Steven A. Hardinger, Departamento de Química e Bioquímica, UCLA. (2017). Estrutura de Lewis Retirado de: chem.ucla.edu
- Wayne Breslyn (2012). Desenho de estruturas de Lewis. Retirado de: terpconnect.umd.edu
- Webmaster (2012). Estruturas de Lewis (“ponto de elétron”). Departamento de Química, Universidade de Maine, Orono. Retirado de: chemistry.umeche.maine.edu
- Lancaster, Sean. (25 de abril de 2017). Como determinar quantos pontos existem na estrutura de pontos de Lewis de um elemento. Sciencing Recuperado de: sciencing.com