O éter etílico, também conhecido como éter dietílico, é um líquido incolor, volátil e altamente inflamável. Sua fórmula química é C4H10O e sua estrutura molecular é caracterizada por uma ligação de oxigênio entre dois átomos de carbono. O éter etílico é amplamente utilizado como solvente em laboratórios químicos e na indústria farmacêutica, sendo também empregado na produção de explosivos, perfumes e na extração de óleos essenciais. É importante ressaltar que o éter etílico deve ser manuseado com cuidado devido ao seu alto potencial de inflamabilidade e toxicidade. É possível adquirir o éter etílico em lojas especializadas em produtos químicos ou em farmácias, devendo-se sempre seguir as orientações de segurança para seu uso adequado.
Aplicações do éter etílico e suas utilizações variadas em diferentes indústrias e processos.
O éter etílico, também conhecido como éter dietílico, é um líquido incolor, inflamável e volátil com um odor característico. Sua fórmula química é C4H10O e sua estrutura consiste em duas moléculas de etanol ligadas por um átomo de oxigênio. O éter etílico é amplamente utilizado em diversas indústrias devido às suas propriedades únicas.
Uma das principais aplicações do éter etílico é como solvente em laboratórios químicos e farmacêuticos. Sua capacidade de dissolver uma ampla variedade de substâncias torna-o ideal para a realização de reações químicas e extração de compostos. Além disso, o éter etílico é utilizado na produção de medicamentos, cosméticos e produtos de limpeza.
Outra importante utilização do éter etílico é como anestésico em procedimentos médicos. O éter etílico foi amplamente utilizado como anestésico geral no passado, mas foi substituído por anestésicos mais seguros. Ainda assim, o éter etílico é utilizado em alguns casos específicos, como em cirurgias veterinárias e odontológicas.
Na indústria de alimentos, o éter etílico é utilizado como aromatizante e flavorizante em produtos como bebidas alcoólicas, sorvetes e doces. Sua capacidade de realçar o sabor e o aroma de alimentos torna-o um ingrediente valioso na indústria alimentícia.
Para adquirir éter etílico, é importante buscar fornecedores confiáveis que sigam as normas de segurança e qualidade estabelecidas. Antes de comprar o produto, verifique a pureza do éter etílico e certifique-se de que atende aos padrões exigidos para a sua aplicação específica.
Em resumo, o éter etílico é um composto químico versátil com uma ampla gama de aplicações em diferentes indústrias e processos. Sua capacidade de atuar como solvente, anestésico e flavorizante o torna um componente essencial em diversos produtos e procedimentos. Portanto, o éter etílico desempenha um papel fundamental em várias áreas, contribuindo para o desenvolvimento e inovação em diversos setores.
Descubra a organização molecular do éter: como é formado e suas propriedades únicas.
O éter etílico, também conhecido simplesmente como éter, é uma substância orgânica que possui uma estrutura molecular única. Ele é formado por átomos de carbono, hidrogênio e oxigênio, ligados de forma a criar uma molécula com propriedades especiais. A sua fórmula química é C4H10O, o que significa que cada molécula de éter etílico contém quatro átomos de carbono, dez átomos de hidrogênio e um átomo de oxigênio.
Uma das propriedades únicas do éter etílico é a sua capacidade de se misturar tanto com compostos polares quanto com compostos apolares. Isso faz com que ele seja um solvente muito versátil, podendo ser utilizado em uma grande variedade de aplicações. Além disso, o éter etílico possui um ponto de ebulição relativamente baixo, o que o torna fácil de ser evaporado e utilizado em processos de destilação e extração.
No que diz respeito às compras, o éter etílico pode ser encontrado em lojas especializadas em produtos químicos, tanto na forma pura quanto em soluções diluídas. É importante ter cuidado ao manusear essa substância, uma vez que ela é inflamável e pode causar irritações na pele e nos olhos.
Quanto aos usos, o éter etílico é amplamente utilizado na indústria química e farmacêutica como solvente e anestésico. Ele também pode ser empregado na síntese de compostos orgânicos e na purificação de substâncias. Devido às suas propriedades únicas, o éter etílico é uma ferramenta essencial em muitos laboratórios e processos industriais.
Em resumo, o éter etílico é uma substância orgânica com uma organização molecular especial, que lhe confere propriedades únicas e versáteis. Se você está buscando um solvente eficaz e fácil de manusear, o éter etílico pode ser a escolha ideal para as suas necessidades.
Aplicações do éter na indústria, medicina e pesquisa científica: descubra seus diversos usos.
O éter etílico, também conhecido simplesmente como éter, é uma substância química com diversas aplicações na indústria, medicina e pesquisa científica. Suas propriedades incluem ser um líquido incolor, volátil e altamente inflamável, com um odor característico e sabor adocicado.
Na indústria, o éter é usado como solvente em diversas reações químicas, especialmente aquelas que envolvem substâncias insolúveis em água. Além disso, é utilizado na produção de plásticos, vernizes e produtos farmacêuticos. Sua capacidade de dissolver uma ampla variedade de compostos o torna uma ferramenta valiosa em processos de fabricação.
Na medicina, o éter foi amplamente utilizado como anestésico geral no passado, embora tenha sido em grande parte substituído por anestésicos mais seguros. Ainda assim, é empregado em procedimentos cirúrgicos menores e em alguns países em desenvolvimento onde recursos limitados impedem o acesso a anestésicos modernos. Além disso, é utilizado como solvente em produtos farmacêuticos e cosméticos.
Na pesquisa científica, o éter é empregado em diversas aplicações, como extração de compostos orgânicos, cristalização de substâncias e síntese de produtos químicos. Sua versatilidade e baixo custo o tornam uma escolha popular em laboratórios de química e biologia.
Em resumo, o éter etílico desempenha um papel fundamental em diversas áreas, desde a indústria até a medicina e a pesquisa científica. Suas propriedades únicas e ampla gama de aplicações o tornam uma substância valiosa em muitos processos e procedimentos.
Características do éter: quais são as propriedades dessa substância tão peculiar?
O éter etílico, também conhecido simplesmente como éter, é uma substância química com propriedades únicas e interessantes. Este composto orgânico é conhecido por sua capacidade de ser um excelente solvente, bem como por suas propriedades anestésicas. Mas quais são exatamente as características do éter?
Em termos de estrutura, o éter é uma molécula que consiste em dois grupos alquila ligados a um átomo de oxigênio. Esta estrutura molecular confere ao éter a capacidade de dissolver uma ampla variedade de substâncias, tornando-o um solvente muito versátil.
Além disso, o éter é uma substância volátil, o que significa que evapora facilmente em temperatura ambiente. Isso faz com que seja fácil de manusear, mas também requer cuidados especiais ao lidar com ele devido ao seu alto potencial inflamável.
Quando se trata de compras, o éter etílico pode ser encontrado em lojas de produtos químicos ou farmácias especializadas. É importante ter em mente que, devido às suas propriedades inflamáveis, o éter deve ser armazenado de forma segura, longe de fontes de calor ou chamas.
Quanto aos usos, o éter etílico é comumente utilizado como solvente em laboratórios e na indústria química. Também é conhecido por suas propriedades anestésicas, sendo utilizado em procedimentos médicos e odontológicos. No entanto, devido aos seus efeitos colaterais e potencial para causar dependência, o uso do éter como anestésico tem sido amplamente substituído por outros compostos mais seguros.
Em resumo, o éter etílico é uma substância com propriedades únicas e versáteis. Sua capacidade de dissolver uma ampla variedade de substâncias o torna um solvente valioso, enquanto suas propriedades anestésicas o tornam útil em certos procedimentos médicos. No entanto, é importante ter cuidado ao lidar com o éter devido à sua inflamabilidade e potencial para causar dependência.
Éter etílico: propriedades, estrutura, compras, usos
O éter etílico , também conhecido como éter dietílico, é um composto orgânico, cuja fórmula química é C 4 H 10 O. Caracteriza-se como um líquido volátil incolor, e, por conseguinte, as garrafas devem ser mantidos fechados tão firmemente quanto possível.
Este éter é classificado como um membro dos éteres dialquílicos; isto é, eles têm a fórmula ROR ‘, em que R e R’ representam diferentes segmentos de carbono. E como o nome do meio descreve, éter dietílico, existem dois radicais – etil que se ligam ao átomo de oxigênio.

Inicialmente o éter etílico foi usado como anestésico geral, introduzido em 1846 por William Thomas Green Morton. No entanto, devido à sua inflamabilidade, seu uso foi descartado, substituindo-o por outros anestésicos menos perigosos.
Este composto também tem sido utilizado para estimar o tempo de circulação sanguínea, durante a avaliação do estado cardiovascular dos pacientes.
Dentro do corpo, o éter dietílico pode ser transformado em dióxido de carbono e metabolitos; Estes últimos acabam sendo excretados na urina. No entanto, a maior parte do éter administrado é exalada nos pulmões, sem sofrer nenhuma modificação.
Por outro lado, é utilizado como solvente para sabões, óleos, perfumes, alcalóides e gomas.
Estrutura de éter etílico
Na imagem acima, há uma representação com um modelo de esferas e barras da estrutura molecular do éter etílico.
Como pode ser visto, a esfera vermelha, correspondente ao átomo de oxigênio, tem dois grupos etil ligados a ambos os lados. Todos os links são simples, flexíveis e rotativos livremente em torno dos eixos σ.
Essas rotações causam estereoisômeros conhecidos como conformes; que mais do que isômeros, são estados espaciais alternativos. A estrutura da imagem corresponde exatamente ao anticonformista, no qual todos os seus grupos de átomos são escalonados (separados um do outro).
Qual seria o outro conformador? O eclipsado, e embora sua imagem não esteja disponível, é suficiente visualizá-lo em forma de U. Nas extremidades superiores do U, os grupos metil estariam localizados, –CH 3 , que experimentaria repulsões estéricas (colidiriam no espaço).
Por isso, é esperado que a molécula CH 3 CH 2 OCH 2 CH 3 adoptar o anti maior parte do tempo de conformação.
Forças intermoleculares
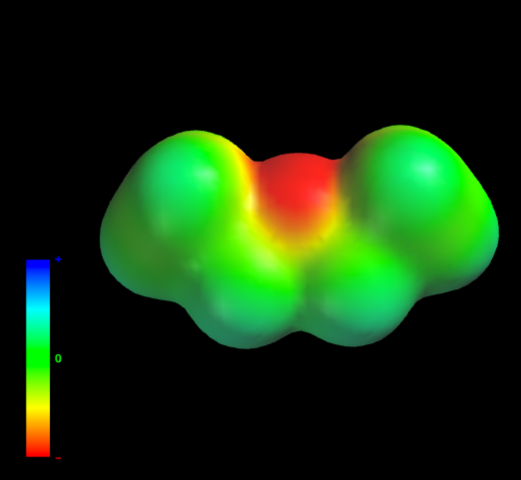
Por quais forças intermoleculares são governadas as moléculas de éter etílico na fase líquida? Eles permanecem no líquido principalmente devido às forças de dispersão, uma vez que seu momento dipolar (1.5D) carece de uma região suficientemente deficiente em densidade eletrônica (δ +)
Isso ocorre porque nenhum átomo de carbono nos grupos etil produz sua densidade eletrônica demais para o átomo de oxigênio. O exposto acima é evidente com o mapa de potencial eletrostático do éter etílico em mãos (imagem inferior). Observe a ausência de uma região azul.
O oxigênio não pode formar pontes de hidrogênio, novamente, porque não existem ligações OH disponíveis na estrutura molecular.Portanto, são os dipolos instantâneos e sua massa molecular que favorecem suas forças de dispersão.
Apesar disso, é altamente solúvel em água. Porque Porque seu átomo de oxigênio, de maior densidade eletrônica, pode aceitar ligações de hidrogênio de uma molécula de água:
(CH 3 CH 2 ) 2 O δ- – δ + H-OH
Essas interações são responsáveis por 6,04g deste éter dissolvendo-se em 100mL de água.
Propriedades físicas e químicas
Outros nomes
-Éter dietílico
-Etoxietano
Óxido de etilo
Fórmula molecular
C 4 H 10 O ou (C 2 H 5 ) 2 O.
Peso molecular
74,14 g / mol.
Aspecto físico
Líquido incolor
Cheiro
Doce e picante
Sabor
Queima e doce.
Ponto de ebulição
94,3 ºF (34,6 ºC) a 760 mmHg.
Ponto de fusão
-177,3 ºF (-116,3 ºC). Cristais estáveis.
Ponto de inflamação
-49 ºF (recipiente fechado).
Solubilidade em água
6,04 g / 100mL a 25 ° C.
Solubilidade em outros líquidos
Miscível com álcoois alifáticos de cadeia curta, benzeno, clorofórmio, éter de petróleo, solvente de gordura, muitos óleos e ácido clorídrico concentrado.
Solúvel em acetona e muito solúvel em etanol. Também é solúvel em nafta, benzeno e óleos.
Densidade
0,714 mg / mL a 68 ° F (20 ° C).
Densidade de vapor
2,55 (em relação ao ar aspirado com densidade 1).
Pressão de vapor
442 mmHg a 68 ºF. 538 mmHg a 25 ° C. 58,6 kPa a 20 ° C.
Estabilidade
É lentamente oxidado pela ação do ar, umidade e luz com formação de peróxido.
A formação de peróxido pode ocorrer em recipientes de éter que foram abertos e permanecem em armazenamento por mais de seis meses. Os peróxidos podem detonar por atrito, impacto ou aquecimento.
Deve-se evitar o contato com zinco, halogênios, oxihaletos não metálicos, oxidantes fortes, cloreto de cromil, óleos de tementina, nitratos e cloretos de metal.
Auto ignição
180 ° C.
Decomposição
Quando aquecido, decompõe-se, emitindo uma fumaça pungente e irritante.
Viscosidade
0,2448 cPoise a 20 ° C.
Calor de combustão
8,807 Kcal / g.
Calor de vaporização
89,8 cal / g a 30 ° C.
Tensão superficial
17,06 dines / cm a 20º C.
Potencial de ionização
9,53 eV.
Limiar de odor
0,83 ppm (a pureza não é dada).
Índice de refração
1.355 a 15 ° C.
Obtenção
De álcool etílico
Éter etílico pode ser obtido a partir de álcool etílico, na presença de ácido sulfúrico como catalisador. O ácido sulfúrico em um meio aquoso se dissocia produzindo o íon hidrônio, H 3 O + .
O álcool etílico anidro flui através da solução de ácido sulfúrico, aquecida entre 130 ° C e 140 ° C, resultando na protonação das moléculas de álcool etílico. Posteriormente, outra molécula de álcool etílico não protonada reage com a molécula protonada.
Quando isso acontece, o ataque nucleofílico da segunda molécula de álcool etílico promove a liberação de água da primeira molécula (a protonada); como um resultado, um éter etílico protonada (CH formado 3 CH 2 OHCH 2 CH 3 ), carregado com o oxigénio parcialmente positiva.
No entanto, esse método de síntese perde eficiência porque o ácido sulfúrico é diluído com a água produzida no processo (produto da desidratação do álcool etílico).
A temperatura da reação é crítica. A temperaturas abaixo de 130 ° C, a reação é lenta e a maior parte do álcool etílico será destilada.
Acima de 150 ° C, o ácido sulfúrico causa a formação de etileno (o alceno de ligação dupla), em vez de combinar com álcool etílico para formar éter etílico.
De etileno
No processo oposto, isto é, hidratação do etileno na fase de vapor, o éter etílico pode ser formado como um produto colateral, além do álcool etílico. De fato, essa rota sintética produz a maior parte desse composto orgânico.
Este processo utiliza catalisadores de ácido fosfórico ligados a um suporte sólido e pode ser ajustado para produzir mais éter.
A desidratação na fase de vapor do etanol na presença de catalisadores de alumina pode render 95% na produção de éter etílico.
Toxicidade
Pode causar irritação na pele e nos olhos em contato. O contato com a pele pode causar ressecamento e rachaduras. O éter geralmente não penetra na pele, pois é rapidamente evaporado.
A irritação ocular causada pelo éter é geralmente leve e, no caso de irritação grave, o dano é geralmente reversível.
A ingestão produz efeitos narcóticos e irritação no estômago. A ingestão grave pode causar danos nos rins.
A inalação do éter pode causar irritação no nariz e na garganta. No caso de inalação com éter, podem ocorrer sonolência, excitação, tontura, vômito, respiração irregular e aumento da salivação.
A alta exposição pode causar perda de consciência e até morte.
A OSHA define um limite de exposição aérea de 800 ppm, em média, durante um turno de 8 horas.
Níveis de irritação ocular: 100 ppm (humano). Níveis de irritação ocular: 1200 mg / m 3 (400 ppm).
Usos
Solvente orgânico
É um solvente orgânico usado para dissolver bromo, iodo e outros halogênios; a maioria dos lipídios (gorduras), resinas, borrachas puras, alguns alcalóides, gomas, perfumes, acetato de celulose, nitrato de celulose, hidrocarbonetos e corantes.
Além disso, é utilizado na extração de ingredientes ativos de tecidos animais e vegetais, pois possui uma densidade menor que a água e flutua sobre ela, deixando dissolvidas as substâncias desejadas no éter.
Anestesia geral
É utilizado como anestésico geral desde 1840, substituindo o clorofórmio por ter uma vantagem terapêutica. No entanto, é uma substância inflamável e, portanto, encontra sérias dificuldades para seu uso em ambientes clínicos.
Além disso, produz nos pacientes alguns efeitos colaterais pós-operatórios indesejáveis, como náusea e vômito.
Por esses motivos, o uso de éter como anestésico geral foi descartado, substituindo-o por outros anestésicos, como o halotano.
Espírito do éter
O éter misturado com etanol foi usado para formar a solução denominada espírito do éter, usada no tratamento de flatulência gástrica e formas mais leves de gastralgia.
Avaliação da circulação sanguínea
O éter foi usado para avaliar a circulação sanguínea entre um braço e os pulmões. O éter é injetado no braço, levando sangue ao átrio direito, depois ao ventrículo direito e daí para os pulmões.
O tempo decorrido desde a injeção do éter até a captura do cheiro do éter no ar expirado é de aproximadamente 4 a 6 s.
Laboratórios de ensino
O éter é usado em laboratórios de ensino em muitos experimentos; por exemplo, na demonstração das leis da genética de Mendel.
O éter é usado para anestesiar as moscas do gênero Drosophila e permitir os cruzamentos necessários entre elas, para destacar as leis da genética.
Referências
- Graham Solomons TW, Craig B. Fryhle. (2011). Química Orgânica Aminas (10 ª edição). Wiley Plus
- Carey F. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill
- The Sevier (2018). Éter dietílico. Science Direct Recuperado de: sciencedirect.com
- Os editores da Encyclopaedia Britannica. (2018). Éter etílico. ncyclopædia Britannica. Recuperado de: britannica.com
- PubChem (2018). Éter Recuperado de: pubchem.ncbi.nlm.nih.gov
- Wikipedia (2018). Éter dietílico. Recuperado de: en.wikipedia.org
- Ficha de segurança XI: éter etílico. [PDF]. Recuperado de: quimica.unam.mx