O hipoclorito de cálcio (Ca(ClO)2) é um composto químico amplamente utilizado como agente desinfetante e oxidante. Sua fórmula química indica que é formado por um átomo de cálcio ligado a dois átomos de cloro e dois átomos de oxigênio. Este composto é sólido, branco e solúvel em água, o que facilita sua utilização em diversas aplicações.
O hipoclorito de cálcio é conhecido por suas propriedades desinfetantes e alvejantes, sendo amplamente utilizado na purificação de água, no tratamento de piscinas, na indústria têxtil e na limpeza de superfícies. Além disso, também é utilizado na agricultura, na indústria de papel e celulose, e até mesmo na fabricação de explosivos.
Devido às suas propriedades oxidantes, o hipoclorito de cálcio é eficaz na eliminação de bactérias, vírus, fungos e algas, tornando-se uma opção popular para a desinfecção de ambientes e superfícies. No entanto, é importante utilizá-lo com cautela, seguindo as instruções de diluição e segurança, uma vez que pode ser irritante para a pele e mucosas.
Para que serve o Hipoclorito de Cálcio?
O Hipoclorito de Cálcio, com fórmula Ca(ClO)2, é um composto químico amplamente utilizado em diversas aplicações devido às suas propriedades desinfetantes e oxidantes. É conhecido por sua capacidade de eliminar microrganismos e oxidar materiais orgânicos, sendo eficaz na desinfecção de água, piscinas e superfícies.
Uma das principais propriedades do Hipoclorito de Cálcio é a liberação controlada de cloro ativo, que age na eliminação de bactérias, vírus e algas. Além disso, sua formulação sólida em grânulos ou tabletes facilita o manuseio e armazenamento, tornando-o uma opção prática e eficiente para a desinfecção de ambientes.
Os usos do Hipoclorito de Cálcio são diversos, destacando-se na purificação de água potável, no tratamento de piscinas e spas, na desinfecção de superfícies em hospitais e indústrias alimentícias, e até mesmo na remoção de odores desagradáveis. Sua versatilidade e eficácia tornam-no uma escolha popular em aplicações que requerem higienização e esterilização.
Sua formulação sólida e facilidade de uso o tornam uma opção prática e confiável para a desinfecção de água, piscinas, superfícies e outros ambientes.
Fórmula química do Hipoclorito de Cálcio: Conheça a composição desse composto químico.
O Hipoclorito de Cálcio, cuja fórmula química é Ca(ClO)2, é um composto químico composto por cálcio, cloro e oxigênio. Esse composto é conhecido por suas propriedades desinfetantes e oxidantes, sendo amplamente utilizado em diversos setores.
O Hipoclorito de Cálcio é um sólido branco e solúvel em água. Sua principal função é a liberação de cloro ativo, que é eficaz na eliminação de bactérias, vírus e outros microrganismos. Além disso, também é utilizado na clarificação de água e no tratamento de piscinas.
Os usos do Hipoclorito de Cálcio são variados, sendo encontrado em produtos de limpeza, produtos para tratamento de água, e até mesmo em processos industriais. Sua eficácia como agente desinfetante o torna uma escolha popular em diversas aplicações.
Sua composição única o torna uma ferramenta essencial em diversas áreas, garantindo a higienização e a segurança em diferentes contextos.
Propriedades do Hipoclorito de Sódio: características e usos desse composto químico comum.
O Hipoclorito de Sódio é um composto químico comumente utilizado como desinfetante, alvejante e agente de limpeza. Sua fórmula química é NaClO e é conhecido por suas propriedades oxidantes e antimicrobianas.
Este composto é geralmente encontrado em forma de líquido ou sólido branco, e é altamente solúvel em água. O Hipoclorito de Sódio é amplamente utilizado na indústria de tratamento de água, na limpeza de superfícies e na desinfecção de piscinas.
Entre os usos mais comuns do Hipoclorito de Sódio, estão a desinfecção de água potável, a esterilização de equipamentos médicos e a remoção de manchas em tecidos. Além disso, ele é frequentemente utilizado na indústria alimentícia para desinfetar frutas e vegetais.
Propriedades do Hipoclorito de cálcio (Ca (ClO) 2): fórmula, propriedades, usos.
O Hipoclorito de cálcio é outro composto químico que possui propriedades semelhantes ao Hipoclorito de Sódio, mas com a fórmula química Ca(ClO)2. Este composto é conhecido por suas propriedades desinfetantes e alvejantes.
Assim como o Hipoclorito de Sódio, o Hipoclorito de cálcio é utilizado na desinfecção de água, na limpeza de superfícies e na remoção de manchas em tecidos. Ele também é amplamente utilizado na indústria de tratamento de água e na indústria alimentícia.
Importância da função química do Hipoclorito de Sódio na desinfecção e saneamento.
O Hipoclorito de cálcio (Ca(ClO)2) é um composto químico amplamente utilizado na desinfecção e saneamento devido à sua poderosa ação antimicrobiana. Sua fórmula química indica a presença de um átomo de cálcio e dois de cloro ligados a um átomo de oxigênio, formando assim uma substância altamente reativa.
As propriedades do Hipoclorito de cálcio incluem sua capacidade de liberar íons de cloro quando em contato com a água, tornando-se um eficaz agente oxidante. Essa característica é fundamental para sua ação bactericida e germicida, eliminando microrganismos nocivos e prevenindo a propagação de doenças.
Os usos do Hipoclorito de cálcio são variados, sendo amplamente empregado na purificação de água potável, piscinas, tratamento de esgotos, desinfecção de superfícies e equipamentos, entre outros. Sua eficácia na eliminação de vírus, bactérias e fungos o torna indispensável em processos de limpeza e higienização.
Sua função química como agente desinfetante e saneante é crucial para garantir a segurança e o bem-estar da população, tornando-o um componente fundamental em processos de higienização e purificação.
Hipoclorito de cálcio (Ca (ClO) 2): fórmula, propriedades, usos
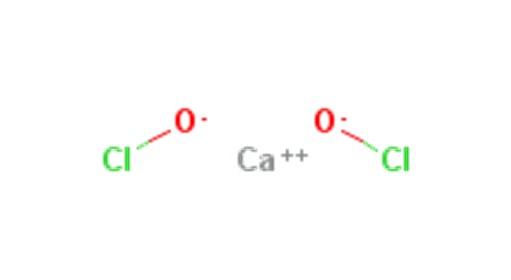
O hipoclorito de cálcio é um composto inorgânico de fórmula Ca (ClO) 2. É um sal comercializado como grânulos ou comprimidos.Decompõe-se facilmente na água liberando oxigênio e cloro. Possui um forte odor a cloro e é usado principalmente como agente clareador ou desinfetante. Sua estrutura é apresentada na figura 1.
O processo de produção do hipoclorito de cálcio consiste basicamente em uma reação de cal hidratada (hidróxido de cálcio) com cloro gasoso por cloração de uma suspensão de cal e soda cáustica com subsequente precipitação do hipoclorito de cálcio dihidratado, secagem a vácuo (Lewis, 2007).
A reação é: 2Cl2 + 2Ca (OH) 2 → Ca (OCl) 2 + CaCl2 + 2H2O.
O alvejante em pó não é uma mistura simples de hipoclorito de cálcio, cloreto de cálcio e hidróxido de cálcio. Em vez disso, uma mistura consistindo principalmente de hipoclorito de cálcio Ca (OCl) 2, hipoclorito de cálcio dibásico, Ca3 (OCl) 2 (OH) 4 e cloreto de cálcio dibásico, Ca3Cl2 (OH) 4. É feito de limão ligeiramente úmido.
Propriedades físicas e químicas
O hipoclorito de cálcio é um sólido granular branco que geralmente é comprimido comercialmente em comprimidos e possui um odor característico de cloro (National Center for Biotechnology Information, 2017). Sua aparência é ilustrada na figura 2 (kingnod, 2015).
O composto tem um peso molecular de 142,98 g / mol e uma densidade de 2,35 g / ml. Possui um ponto de fusão de 100 ° C e um ponto de ebulição de 175 ° C, onde começa a se decompor (Royal Society of Chemistry, 2015).
O composto é solúvel em água, sendo capaz de dissolver 21 gramas por 100 ml deste solvente. Também reage com os álcoois, oxidando-os em seus respectivos ácidos carboxílicos.
O hipoclorito de cálcio é um poderoso agente oxidante, particularmente em meios aquosos e quando se decompõe quando aquecido para liberar gases de oxigênio e cloro. Pode reagir explosivamente com carbono finamente dividido. Reage com acetileno para formar cloroacetilenos explosivos.
A reação com álcoois pode levar a explosões. As reações com nitrometano, metanol, etanol (e outros álcoois) podem se tornar violentas depois de um tempo. Reage com possível ignição e / ou explosão com compostos e sulfetos orgânicos de enxofre.
Decompõe a evolução do oxigênio, uma mudança que pode ser catalisada pela ferrugem em recipientes de metal. NCl3 altamente explosivo se forma em contato com uréia ou amônia. Evolui gás cloro gasoso altamente tóxico quando aquecido ou em contato com ácidos.
Reage violentamente com uma mistura de enxofre úmido, expelindo enxofre fundido. A combinação de hipoclorito de cálcio, hidrogenossulfato de sódio, amido e carbonato de sódio. Quando comprimido, causa a incandescência dos materiais, seguida de explosão (hipoclorito de cálcio, 2016).
Reatividade e perigos
O hipoclorito de cálcio é um composto instável classificado como um forte agente oxidante. É corrosivo e irritante em caso de contato com a pele, de contato com os olhos e de ingestão. Também é muito perigoso em caso de inalação.
O produto químico possui propriedades (efeitos corrosivos e toxicidade respiratória aguda) que indicam um perigo para a saúde humana.
Embora existam alguns usos abertos, a exposição do consumidor é suficientemente regulada pelas leis da água potável e outras atividades relacionadas à água e a exposição ocupacional são adequadamente controladas no país patrocinador para garantir o manuseio seguro (CALCIUM HYPOCHLORITE, 2016).
Contato com os olhos
Em caso de contato com os olhos, é necessário verificar se as lentes de contato estão sendo usadas e removê-las imediatamente.
Você deve enxaguar os olhos com água corrente por pelo menos 15 minutos, mantendo as pálpebras abertas. Você pode usar água fria. Pomada para os olhos não deve ser usada.
Contato com a pele
Se o produto químico entrar em contato com a roupa, remova-o o mais rápido possível, protegendo suas próprias mãos e corpo.
Coloque a vítima sob um chuveiro de segurança. Se o produto químico se acumular na pele exposta da vítima, como mãos, lave delicada e cuidadosamente a pele contaminada com água corrente e sabão não abrasivo.
O ácido também pode ser neutralizado com hidróxido de sódio diluído ou com uma base fraca como o bicarbonato de sódio. Se a irritação persistir, procure atendimento médico. Lave a roupa contaminada antes de reutilizá-la.
Se o contato com a pele for grave, ele deve ser lavado com sabão desinfetante e cobrir a pele contaminada com um creme antibacteriano.
Inalação
Em caso de inalação, a vítima deve poder descansar em uma área bem ventilada. Se a inalação for grave, a vítima deve ser evacuada para uma área segura o mais rápido possível. Afrouxe roupas apertadas, como colarinho da camisa, cintos ou gravata.
Se for difícil para a vítima respirar, deve-se fornecer oxigênio. Se a vítima não estiver respirando, é realizada uma ressuscitação boca a boca.
Sempre levando em consideração que pode ser perigoso para a pessoa que fornece ajuda a fazer ressuscitação boca a boca, quando o material inalado é tóxico, infeccioso ou corrosivo.
Ingestão
Em caso de ingestão, não provoque vômito. Afrouxe roupas apertadas, como colarinhos, cintos ou gravatas. Se a vítima não estiver respirando, faça uma ressuscitação boca a boca.
Em todos os casos, deve-se procurar atendimento médico imediato (Instituto Nacional de Segurança e Saúde Ocupacional, 2015).
Usos
O principal uso do hipoclorito de sódio é como desinfetante de água sanitária e água (hipoclorito de cálcio: um produto químico para piscinas e muito mais, SF). O composto é adicionado como granulado ou comprimido à água da piscina para matar os germes que podem deixar os nadadores doentes.
Utilizado corretamente, por operadores de pool bem treinados, esse composto destrói germes capazes de causar inúmeros problemas de saúde para os usuários do pool.
Alguns deles são diarréia, ouvido do nadador (uma dor desagradável no ouvido) e várias infecções respiratórias, cutâneas e feridas. Fontes termais e hidromassagem também são desinfetadas com hipoclorito de cálcio.
Sua vantagem, quando comparada com o hipoclorito de sódio, é que, devido à sua razão estequiométrica, possui um maior teor de cloro, 65 a 70% maior que o seu análogo de sódio (3v-tech, 2017).
O composto também é usado como algicida, bactericida, desodorizante, desinfetante, fungicida e na refinação de açúcar.
O hipoclorito de cálcio é um agente oxidante geral e, portanto, encontra algum uso na química orgânica. Por exemplo, o composto é usado para clivar glicóis, ácidos a-hidroxicarboxílicos e cetoácidos. Também para produzir aldeídos ou ácidos carboxílicos fragmentados.
O hipoclorito de cálcio também pode ser usado na reação haloforme para produzir clorofórmio de acordo com a reação:
3Ca (ClO) 2 + 2 (CH3) 2CO → 2CHCl3 + 2Ca (OH) 2+ Ca (CH3COO) 2
Referências
1. 3v-tech. (2017). Hipoclorito de cálcio. Recuperado de 3v-tech.com.
2. hipoclorito de cálcio. (2016). Recuperado de cameochemicals.gov.
3. HIPOCLORITO DE CÁLCIO. (22 de agosto de 2016). Recuperado de inchem.org.
4. Hipoclorito de cálcio: um produto químico para piscinas e muito mais. (SF). Recuperado de americanchemistry.com.
5. kingnod. (2015). Hipoclorito de cálcio. Recuperado de ikingnod.com.
6. Lewis, RS (2007). Dicionário químico condensado de Hawley 15a edição. Nova York: John Wiley & Sons, Inc.
7. Centro Nacional de Informações sobre Biotecnologia. (15 de abril de 2017). Banco de Dados Composto PubChem; CID = 24504. Recuperado do PubChem.
8. Instituto Nacional de Segurança e Saúde Ocupacional. (22 de julho de 2015). HIPOCLORITO DE CÁLCIO. Recuperado de cdc.gov.
9. Sociedade Real de Química. (2015). Hipoclorito de cálcio. Obtido em chemspider.com.
