A Lei de Proporções Múltiplas é um princípio da química que estabelece que quando dois elementos se combinam para formar mais de um composto, a massa de um dos elementos que se combina com uma massa fixa do outro elemento, está numa proporção de números inteiros simples. Isso significa que a relação entre as massas dos elementos em diferentes compostos formados é sempre uma proporção fixa e pode ser expressa por números inteiros simples.
Essa lei foi proposta por John Dalton no século XIX e é fundamental para a compreensão da composição dos compostos químicos e para a determinação de suas fórmulas. Ela tem diversas aplicações na química, sendo utilizada, por exemplo, na determinação da estequiometria de reações químicas, na identificação de compostos desconhecidos e no desenvolvimento de novos materiais.
Em resumo, a Lei de Proporções Múltiplas é um conceito importante que ajuda os cientistas a entenderem melhor a natureza dos compostos químicos e a realizarem experimentos com precisão e confiabilidade.
Entenda o funcionamento da lei das proporções múltiplas de forma simplificada.
A Lei das proporções múltiplas é uma lei da química que afirma que quando dois elementos formam mais de um composto, a massa de um dos elementos que se combina com uma massa fixa do outro elemento está em uma razão de números inteiros simples. Este princípio foi formulado por John Dalton no século XIX e é fundamental para entender a estequiometria das reações químicas.
Para explicar de forma simplificada, imagine que temos dois elementos, A e B, que podem se combinar em diferentes proporções para formar diferentes compostos. Se a massa de A que se combina com uma massa fixa de B é sempre um múltiplo inteiro da massa de A que se combina com a mesma massa de B, então estamos diante de um exemplo da lei das proporções múltiplas.
Essa lei é importante porque nos permite prever a composição de diferentes compostos formados pelos mesmos elementos. Ela também é útil para determinar a fórmula química de um composto desconhecido, analisando as proporções em que os elementos estão presentes.
Aplicações práticas da lei das proporções múltiplas incluem a determinação da composição dos gases que compõem a atmosfera terrestre e a análise de amostras de substâncias desconhecidas em laboratórios químicos.
Aplicação da Lei de Lavoisier: onde ela se faz presente na física e química.
A Lei de Lavoisier, também conhecida como Lei da Conservação da Massa, afirma que em uma reação química, a massa total dos reagentes é igual à massa total dos produtos, ou seja, a massa é conservada. Isso significa que a matéria não pode ser criada nem destruída, apenas transformada.
Na física, a Lei de Lavoisier se faz presente em diversas situações, como por exemplo, na Termodinâmica, onde a conservação da massa é fundamental para o estudo das transformações de energia. Já na química, a aplicação da Lei de Lavoisier é fundamental em todas as reações químicas, pois ela é a base para o balanceamento de equações químicas.
Na física, a Lei de Lavoisier é essencial para o entendimento das leis de conservação de energia e massa, enquanto na química, ela é fundamental para o estudo das transformações químicas e para garantir a correta execução de experimentos laboratoriais.
Lei de proporções múltiplas: explicação, aplicações.
A Lei de Proporções Múltiplas, proposta por John Dalton, estabelece que quando dois elementos formam mais de um composto, as massas de um dos elementos que se combinam com uma massa fixa do outro elemento estão numa relação de números inteiros simples. Em outras palavras, as proporções em que os elementos se combinam são múltiplos inteiros uns dos outros.
Na prática, a Lei de Proporções Múltiplas é aplicada no estudo das estequiometrias das reações químicas, auxiliando na determinação das quantidades de reagentes necessárias para formar determinados produtos. Além disso, ela também é utilizada para prever a composição de substâncias desconhecidas com base nas proporções em que os elementos se combinam.
Em resumo, a Lei de Proporções Múltiplas é uma ferramenta importante na química para determinar as quantidades exatas dos elementos envolvidos em uma reação e prever a composição de substâncias com base em suas proporções. Sua aplicação é fundamental para o avanço da ciência e tecnologia no campo da química.
Aplicação prática da Lei de Proust na química e na vida cotidiana.
A Lei de Proust, também conhecida como Lei das Proporções Definidas, é um princípio fundamental da química que afirma que uma substância pura sempre terá a mesma composição em termos de proporção em massa dos seus elementos constituintes. Em outras palavras, independentemente da quantidade da substância, a proporção entre os elementos que a compõem será sempre a mesma.
Um exemplo clássico da aplicação da Lei de Proust é a formação da água (H2O). Independentemente da quantidade de água que analisarmos, sempre encontraremos a proporção de dois átomos de hidrogênio para um átomo de oxigênio, seguindo a fórmula H2O.
Na vida cotidiana, a Lei de Proust também pode ser observada em diversas situações. Por exemplo, ao cozinhar uma receita que pede uma certa quantidade de ingredientes, é essencial seguir as proporções corretas para garantir o resultado desejado. Se a receita pede uma xícara de farinha para meia xícara de açúcar, a Lei de Proust garante que a proporção entre esses ingredientes será a mesma, independentemente da quantidade final do prato.
Em resumo, a Lei de Proust é um conceito importante na química que nos ajuda a entender a composição das substâncias e suas proporções. Essa lei tem aplicações práticas tanto na química quanto na vida cotidiana, auxiliando em processos como a preparação de alimentos, fabricação de produtos químicos e análise de compostos.
Onde as leis ponderais são aplicadas na natureza e na química.
As leis ponderais são aplicadas tanto na natureza quanto na química, sendo fundamentais para o estudo das proporções entre os elementos químicos em diferentes substâncias. Uma das leis mais importantes nesse contexto é a Lei de proporções múltiplas, que foi formulada por John Dalton no século XIX.
Essa lei estabelece que quando dois elementos formam mais de um composto químico, a massa de um dos elementos que se combina com uma massa fixa do outro elemento está em uma relação de números inteiros simples. Isso significa que as substâncias se combinam em proporções definidas e específicas, o que é essencial para a compreensão da química moderna.
Na natureza, a Lei de proporções múltiplas pode ser observada em diversos fenômenos, como na formação de minerais e rochas, na composição dos diferentes tipos de água, na constituição dos organismos vivos, entre outros. Essa lei também é aplicada em análises químicas, na síntese de compostos e na determinação de fórmulas químicas.
Em resumo, as leis ponderais, como a Lei de proporções múltiplas, desempenham um papel fundamental na natureza e na química, permitindo a compreensão das relações entre os elementos químicos e contribuindo para o desenvolvimento de novas tecnologias e materiais. É importante estudar e aplicar essas leis para avançar no conhecimento científico e na prática da química.
Lei de proporções múltiplas: explicação, aplicações
A lei das proporções múltiplas é um dos princípios da estequiometria e foi formulada pela primeira vez em 1803 pelo químico e matemático John Dalton, para oferecer uma explicação sobre a maneira como os elementos químicos são combinados para formar compostos. .
Esta lei estabelece que, se dois elementos se combinam para gerar mais de um composto químico, a proporção das massas do elemento número dois quando integrada a uma massa invariável do elemento número um estará em relações inteiras pequenas.

Assim, pode-se dizer que, a partir da lei de proporções definidas formulada por Proust, a lei de conservação de massa proposta por Lavoisier e a lei de proporções definidas, a idéia da teoria atômica (um marco no história da química), bem como a abordagem de fórmulas para compostos químicos.
Explicação
A união de dois elementos em proporções diferentes sempre resulta em compostos únicos com características diferentes.
Isso não significa que os elementos possam ser associados a qualquer relacionamento, pois sua configuração eletrônica sempre deve ser levada em consideração para determinar quais links e estruturas podem ser formados.
Por exemplo, para os elementos carbono (C) e oxigênio (O), apenas duas combinações são possíveis:
– CO, onde a razão entre carbono e oxigênio é de 1: 1.
– CO 2 , onde a proporção de oxigênio para carbono é 2: 1.
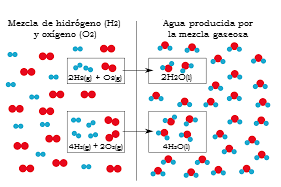
Aplicações
Foi demonstrado que a lei de proporções múltiplas é aplicada mais precisamente em compostos simples. Da mesma forma, é de grande utilidade quando se trata de determinar a proporção necessária para combinar dois compostos e formar um ou mais através de uma reação química.
No entanto, esta lei apresenta erros de grande magnitude quando aplicados a compostos que não possuem uma relação estequiométrica entre seus elementos.
Também mostra grandes falhas quando se trata de usar polímeros e substâncias similares devido à complexidade de suas estruturas.
Exercícios resolvidos
Primeiro exercício
A porcentagem de massa de hidrogênio em uma molécula de água é de 11,1%, enquanto no peróxido de hidrogênio é de 5,9%. Qual é a razão do hidrogênio em cada caso?
Solução
Na molécula de água, a proporção de hidrogênio é igual a O / H = 8/1. Na molécula de peróxido é um O / H = 16/1
Isso é explicado porque a razão entre os dois elementos está intimamente ligada à sua massa, portanto, no caso da água, haveria uma razão de 16: 2 para cada molécula, ou o que é igual a 8: 1, como ilustrado. Ou seja, 16 g de oxigênio (um átomo) para cada 2 g de hidrogênio (2 átomos).
2º exercício
O átomo de nitrogênio forma cinco compostos com oxigênio que são estáveis sob condições atmosféricas padrão (25 ° C, 1 atm). Esses óxidos têm as seguintes fórmulas: N 2 O, NO, N 2 O 3 , N 2 O 4 e N 2 O 5 . Como você explica esse fenômeno?
Solução
Pela lei de múltiplas proporções, é necessário que o oxigênio se ligue ao nitrogênio com uma razão de massa invariável deste (28 g):
– Em N 2 O, a proporção de oxigênio (16 g) em relação ao nitrogênio é de aproximadamente 1.
– No NO, a proporção de oxigênio (32 g) em relação ao nitrogênio é de aproximadamente 2.
– No N 2 O 3, a proporção de oxigênio (48 g) em relação ao nitrogênio é de aproximadamente 3.
– No N 2 O 4, a proporção de oxigênio (64 g) em relação ao nitrogênio é de aproximadamente 4.
– No N 2 O 5, a proporção de oxigênio (80 g) em relação ao nitrogênio é de aproximadamente 5.
Terceiro exercício
Há um par de óxidos metálicos dos quais um contém 27,6% e o outro 30,0% em massa de oxigênio. Se foi determinado que a fórmula estrutural do óxido número um é M 3 O 4 . Qual seria a fórmula do óxido número dois?
Solução
No óxido número um, a presença de oxigênio é de 27,6 partes em 100. Portanto, a quantidade de metal é representada pela quantidade total menos a quantidade de oxigênio: 100-27,4 = 72, 4%
Por outro lado, no óxido número dois, a quantidade de oxigênio é igual a 30%; isto é, 30 partes por 100. Assim, a quantidade de metal seria: 100-30 = 70%.
Note-se que a fórmula do óxido número um é M 3 O 4 ; Isso implica que 72,4% do metal é igual a três átomos do metal, enquanto 27,6% de oxigênio é igual a quatro átomos de oxigênio.
Portanto, 70% do metal (M) = (3 / 72,4) x átomos de 70 M = átomos de 2,9 M. Da mesma forma, 30% de oxigênio = (4 / 72,4) x 30 O átomos = 4,4 M. átomos.
Finalmente, a proporção ou proporção do metal em relação ao oxigênio no óxido número dois é M: O = 2,9: 4,4; isto é, é igual a 1: 1,5 ou, que é igual, 2: 3. Portanto, a fórmula do segundo óxido seria M 2 O 3 .
Referências
- Wikipedia (2017). Wikipedia Recuperado de en.wikipedia.org
- Leicester, HM, Klickstein, HS (1952), A Source Book in Chemistry, 1400-1900. Recuperado de books.google.co.ve
- Mascetta, JA (2003). Química da maneira fácil. Recuperado de books.google.co.ve
- Hein, M., Arena, S. (2010). Fundamentos de Química da Faculdade, Alternate. Recuperado de books.google.co.ve
- Khanna, SK, Verma, NK, Kapila, B. (2006). Excel com perguntas objetivas em química. Recuperado de books.google.co.ve