O manganês é um elemento químico de número atômico 25 e símbolo Mn, que desempenha um papel fundamental em diversas áreas da indústria e da ciência. Sua história remonta à Antiguidade, quando era utilizado na produção de ligas metálicas, sendo posteriormente descoberto como um elemento químico isolado por Johan Gottlieb Gahn em 1774. Suas propriedades incluem alta resistência ao desgaste, boa condutividade elétrica e capacidade de formar compostos com diferentes estados de oxidação. O manganês é amplamente utilizado na fabricação de aço, ligas metálicas, pilhas e baterias, fertilizantes e pigmentos, entre outros produtos. Sua estrutura cristalina e comportamento químico contribuem para a sua versatilidade e importância em diversas aplicações industriais e tecnológicas.
Conheça as principais características do manganês: propriedades e aplicações.
O manganês é um elemento químico de número atômico 25 e símbolo Mn. Foi descoberto em 1774 por Johan Gottlieb Gahn, que o isolou a partir do mineral pirolusita. Este metal de transição possui diversas propriedades que o tornam bastante útil em diversas aplicações.
Em relação às suas propriedades, o manganês é um metal de coloração prateada, duro e quebradiço. Apresenta alta resistência à corrosão e é um bom condutor de eletricidade. Além disso, é essencial para a saúde humana, desempenhando um papel importante no metabolismo e no sistema imunológico.
A estrutura do manganês é cúbica de corpo centrado, o que confere estabilidade ao elemento. Sua alta reatividade faz com que forme diversas ligas metálicas, como o aço manganês, amplamente utilizado na indústria siderúrgica.
Quanto aos usos do manganês, destacam-se sua aplicação na produção de pilhas secas, ligas metálicas, fertilizantes, pigmentos e vidros. Além disso, é utilizado na fabricação de aços especiais, que possuem alta resistência e durabilidade.
Sua importância na indústria e na saúde humana torna indispensável o conhecimento de suas características e usos.
De onde vem o manganês?
O manganês é um elemento químico que pode ser encontrado na crosta terrestre e é amplamente distribuído na natureza. Ele é o 12º elemento mais abundante na Terra e pode ser encontrado em minérios como a pirolusita, a rodocrosita e a braunita. Estes minérios são extraídos principalmente de minas localizadas em diferentes partes do mundo, como Brasil, África do Sul, Austrália, Índia e Gabão.
O manganês foi descoberto no século XVII por um químico sueco chamado Johan Gottlieb Gahn. Ele isolou o elemento a partir da pirolusita, um minério de manganês. Desde então, o manganês tem sido amplamente utilizado em diversas aplicações devido às suas propriedades únicas.
O manganês é um metal de transição que possui uma estrutura cristalina cúbica de corpo centrado. Ele é conhecido por sua resistência à corrosão e por sua capacidade de formar ligas fortes e maleáveis. Além disso, o manganês é um importante componente de ligas de aço, sendo utilizado na fabricação de aço inoxidável, aço carbono e aço de manganês.
Além de sua importância na indústria siderúrgica, o manganês também é utilizado em outras áreas, como na produção de pilhas e baterias, na indústria química, na produção de fertilizantes e na fabricação de vidro. Suas propriedades únicas tornam o manganês um elemento essencial em diversos processos industriais e produtos do dia a dia.
Aplicações do manganês: descubra os diferentes usos desse mineral na indústria e na saúde.
O manganês é um mineral essencial com uma longa história de uso em diversas aplicações. Suas propriedades únicas o tornam um elemento valioso em várias indústrias e também na área da saúde.
Na indústria, o manganês é amplamente utilizado na produção de aço e ferroligas. Ele atua como um agente dessulfurante e dessoxidante, melhorando a qualidade e a durabilidade dos materiais metálicos. Além disso, o manganês é empregado na fabricação de pilhas e baterias, pigmentos, fertilizantes e produtos químicos.
Na área da saúde, o manganês desempenha um papel crucial no metabolismo de gorduras, carboidratos e aminoácidos. Ele também atua como um cofator enzimático em várias reações bioquímicas essenciais para o bom funcionamento do organismo. A deficiência de manganês pode levar a problemas de saúde, como fraqueza muscular, distúrbios do crescimento e comprometimento do sistema imunológico.
Além disso, o manganês é utilizado em medicamentos e suplementos nutricionais para tratar condições como osteoporose, artrite e diabetes. Sua ação antioxidante também contribui para a prevenção de danos celulares e o envelhecimento precoce.
Sua importância como mineral essencial evidencia a necessidade de garantir sua presença adequada na dieta e nos processos produtivos.
Locais de ocorrência do manganês na natureza: descubra onde esse elemento é encontrado no ambiente.
O manganês é um elemento químico que pode ser encontrado em diversos locais da natureza. Ele é amplamente distribuído na crosta terrestre, sendo encontrado em minerais como pirolusita, rodocrosita e braunita. Além disso, o manganês também pode ser encontrado em sedimentos marinhos, águas subterrâneas e até mesmo em alguns organismos vivos.
Os maiores depósitos de manganês estão localizados em países como África do Sul, Ucrânia, Austrália, Brasil e Índia. Nessas regiões, o manganês é extraído principalmente para a produção de ligas metálicas, como o aço. A presença desse elemento é fundamental para a indústria siderúrgica, pois ajuda a melhorar as propriedades do metal, tornando-o mais resistente e durável.
Além disso, o manganês também é encontrado em pequenas quantidades em diversos alimentos, como frutas, vegetais, grãos integrais e frutos do mar. Ele desempenha um papel importante no organismo humano, atuando como cofator enzimático e participando de diversas reações bioquímicas.
Manganês: história, propriedades, estrutura, usos
O manganês é um elemento químico que consiste de um metal de transição representado pelo símbolo Mn, e número atómico 25. O seu nome é devido à magnésia preto, agora mineral pirolusite dia, que foi estudada em magnésia, uma Região da Grécia.
É o décimo segundo elemento mais abundante na crosta terrestre, encontrado em uma variedade de minerais, como íons com diferentes estados de oxidação. De todos os elementos químicos, o manganês se distingue por estar presente em seus compostos com muitos estados de oxidação, dos quais +2 e +7 são os mais comuns.

Na sua forma pura e metálica, não possui muitas aplicações. No entanto, ele pode ser adicionado ao aço como um dos principais aditivos para torná-lo inoxidável. Assim, sua história está intimamente relacionada à do ferro; mesmo quando seus compostos estão presentes em pinturas rupestres e em vidro antigo.
Seus compostos encontram aplicações em baterias, métodos analíticos, catalisadores, oxidações orgânicas, fertilizantes, corantes de vidro e cerâmica, secadores e suplementos nutricionais para atender à demanda biológica de manganês em nossos corpos.
Além disso, os compostos de manganês são muito coloridos; independentemente de haver interações com espécies inorgânicas ou orgânicas (organomanganês). Suas cores dependem do número ou estado de oxidação, sendo o +7 o mais representativo no agente oxidante e antimicrobiano KMnO 4 .
Além dos usos anteriores em ambientes de manganês, suas nanopartículas e estruturas metálicas orgânicas são opções para o desenvolvimento de catalisadores, sólidos adsorventes e materiais de dispositivos eletrônicos.
História
Os primórdios do manganês, como o de muitos outros metais, estão associados aos do seu mineral mais abundante; neste caso, a pirolusita, MnO 2 , que eles chamaram de magnésia negra, devido à sua cor e porque foi coletada em Magnésia, na Grécia. Sua cor preta chegou a ser usada mesmo em pinturas rupestres francesas.
Seu primeiro nome foi manganês, dado por Michele Mercati, e depois mudou para manganês. O MnO 2 também foi usado para descolorir o vidro e, de acordo com algumas pesquisas, foi encontrado nas espadas dos espartanos, que até então faziam seus próprios aços.
O manganês admirava as cores de seus compostos, mas somente em 1771 o químico suíço Carl Wilhelm propôs sua existência como elemento químico.
Mais tarde, em 1774, Johan Gottlieb Gahn conseguiu reduzir o MnO 2 ao manganês metálico usando carvão mineral; atualmente reduzido com alumínio ou transformado em sal de sulfato, MgSO 4 , que acaba eletrolisando.
No século XIX, o manganês adquiriu seu enorme valor comercial, demonstrando que melhorava a resistência do aço sem alterar sua maleabilidade, produzindo ferromanganês. Da mesma forma, o MnO 2 encontrou uso como material catódico em baterias de zinco-carbono e alcalinas.
Propriedades
Aparência
Cor metálica prateada.
Peso atômico
54.938 u
Número atômico (Z)
25
Ponto de fusão
1.246 ° C
Ponto de ebulição
2.061 ° C
Densidade
-Em temperatura ambiente: 7,21 g / mL.
– No ponto de fusão (líquido): 5,95 g / mL
Calor de fusão
12,91 kJ / mol
Calor de vaporização
221 kJ / mol
Capacidade de calorias molares
26,32 J / (mol · K)
Eletronegatividade
1,55 na escala de Pauling
Energias de ionização
Primeiro nível: 717,3 kJ / mol.
Segundo nível: 2.150, 9 kJ / mol.
Terceiro nível: 3.348 kJ / mol.
Raio atômico
127 horas empíricas
Condutividade térmica
7,81 W / (mK)
Resistividade elétrica
1,44 µΩ · a 20 ° C
Ordem magnética
Paramagnético, é fracamente atraído por um campo elétrico.
Dureza
6.0 na escala de Mohs
Reacções químicas
O manganês é menos eletronegativo do que seus vizinhos mais próximos na tabela periódica, o que o torna menos reativo. No entanto, pode queimar no ar na presença de oxigênio:
3 Mn (s) + 2 O 2 (g) => Mn 3 O 4 (s)
Também pode reagir com nitrogênio a uma temperatura aproximada de 1.200 ° C, para formar nitreto de manganês:
3 Mn (s) + N 2 (s) => Mn 3 N 2
Também é diretamente combinado com boro, carbono, enxofre, silício e fósforo; Mas não com hidrogênio.
O manganês se dissolve rapidamente em ácidos, causando sais com íons manganês (Mn 2+ ) e liberando gás hidrogênio. Ele também reage com halogênios, mas requer altas temperaturas:
Mn (s) + Br 2 (g) => MnBr 2 (s)
Organocompósitos
O manganês pode formar ligações com átomos de carbono, Mn-C, permitindo originar uma série de compostos orgânicos chamados organomanganês.
Nas interações de organomanganês são devidas às ligações Mn-C ou Mn-X, onde X é um halogênio, ou ao posicionamento do centro positivo de manganês com as nuvens eletrônicas dos sistemas π conjugados de compostos aromáticos.
Para exemplos dos acima referidos compostos são fenilmanganeso iodeto, PhMnI, tricarbonilo metilciclopentadienil manganês e (C 5 H 4 CH 3 ) -Mn- (CO) 3 .
Organomanganeso últimas formas uma Mn-C de títulos para o CO, mas também interage com o anel aromático nuvem C 5 H 4 CH 3 , formando uma estrutura em sanduíche em meia:
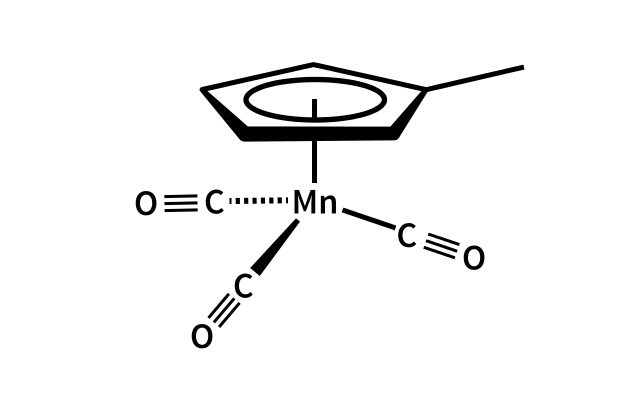
Isótopos
Possui um único isótopo estável de 55 Mn com 100% de abundância. Os outros isótopos são radioativos: 51 Mn, 52 Mn, 53 Mn, 54 Mn, 56 Mn e 57 Mn.
Estrutura e configuração eletrônicas
A estrutura do manganês à temperatura ambiente é complexa. Embora seja considerado cúbico centrado no corpo (cco), experimentalmente sua célula unitária provou ser um cubo distorcido.
Essa primeira fase ou alótropo (no caso do metal como elemento químico), chamada α-Mn, é estável até 725 ° C; Uma vez atingida essa temperatura, ocorre uma transição para outro alótropo semelhante a “raro”, o β-Mn. Então, o alótropo β predomina até 1095 ° C quando se torna novamente um terceiro alótropo: γ-Mn.
Γ-Mn tem duas estruturas cristalinas diferenciáveis. Um cúbico centrado na face (fcc) e o outro tetragonal centrado na face (fct ) à temperatura ambiente. E finalmente, a 1134 ° C, o γ-Mn é transformado no alótropo δ-Mn, que cristaliza em uma estrutura cco comum.
Assim, o manganês tem até quatro formas alotrópicas, todas dependentes da temperatura; e com relação aos dependentes de pressão, não há muitas referências bibliográficas para consultá-los.
Nessas estruturas, os átomos de Mn são ligados por uma ligação metálica governada por seus elétrons de valência, de acordo com sua configuração eletrônica:
[Ar] 3d 5 4s 2
Estados de oxidação
A configuração eletrônica do manganês mostra que ele possui sete elétrons de valência; cinco no orbital 3d e dois no orbital 4s. Ao perder todos esses elétrons durante a formação de seus compostos, assumindo a existência do cátion Mn 7+ , diz-se que ele adquire um número de oxidação de +7 ou Mn (VII).
O KMnO 4 (K + Mn 7+ O 2- 4 ) é um exemplo de um composto com Mn (VII), e é fácil reconhecê-lo por suas cores roxas brilhantes:

O manganês pode gradualmente perder cada um de seus elétrons. Assim, seus números de oxidação também podem ser +1, +2 (Mn2 + , o mais estável de todos), +3 (Mn3 + ) e assim por diante até +7, já mencionado.
Quanto mais positivos os números de oxidação, maior a sua tendência a ganhar elétrons; isto é, seu poder oxidante será maior, pois eles “roubam” os elétrons de outras espécies para reduzir e suprir a demanda eletrônica. É por isso que o KMnO 4 é um ótimo agente oxidante.
Cores
Todos os compostos de manganês são caracterizados por serem coloridos e o motivo é o das transições eletrônicas dd, diferentes para cada estado de oxidação e seus ambientes químicos. Assim, os compostos de Mn (VII) são geralmente de cor violeta, enquanto os de Mn (VI) e Mn (V), por exemplo, são verdes e azuis, respectivamente.

Os compostos Mn (II) parecem um pouco desbotados, contrastando o KMnO 4 . Por exemplo, o MnSO 4 e MnCl 2 são sólidos, cor-de-rosa pálido quase branco.
Essa diferença se deve à estabilidade do Mn 2+ , cujas transições eletrônicas requerem mais energia e, portanto, dificilmente absorvem a radiação da luz visível, refletindo quase todas elas.
Onde está o magnésio?

O manganês constitui 0,1% da crosta terrestre e ocupa o décimo segundo lugar entre os elementos presentes nela. Seus principais depósitos estão na Austrália, África do Sul, China, Gabão e Brasil.
Entre os principais minerais de manganês estão os seguintes:
-Pirolusita (MnO 2 ) com 63% Mn
-Ramsdelita (MnO 2 ) com 62% de Mn
-Manganita (Mn 2 O 3 .H 2 O) com 62% de Mn
-Criptomelano (KMn 8 O 16 ) com 45 – 60% de Mn
-Hausmanita (Mn · Mn 2 O 4 ) com 72% de Mn
-Braunita (3Mn 2 O 3 · MnSiO 3 ) com 50 – 60% de Mn e (MnCO 3 ) com 48% de Mn.
Somente minerais que contêm mais de 35% de manganês são considerados comercialmente exploráveis.
Embora exista muito pouco manganês (10 ppm) na água do mar, há longas áreas cobertas com nódulos de manganês no fundo do mar; também chamado de nódulos polimetálicos. Nestes existem aglomerados de manganês e um pouco de ferro, alumínio e silício.
A reserva de manganês dos nódulos é estimada em uma quantidade muito maior que a reserva de metal na superfície da Terra.
Nódulos de alto grau contêm entre 10 e 20% de manganês, com algum cobre, cobalto e níquel. No entanto, existem dúvidas sobre a lucratividade comercial da exploração de mineração dos nódulos.
Alimentos de manganês
O manganês é um elemento essencial na dieta do homem, pois está envolvido no desenvolvimento do tecido ósseo; bem como na sua formação e na síntese de proteoglicanos, formadores de cartilagem.
Por tudo isso, é necessária uma dieta adequada de manganês, selecionando os alimentos que contêm o elemento.
A seguir, é apresentada uma lista de alimentos que contêm manganês, com os valores expressos em mg de manganês / 100 g de alimento:
-Ananá 1,58 mg / 100g
-Framboesa e morango 0,71 mg / 100g
– Banana fresca 0,27 mg / 100g
Espinafre cozido 0,90 mg / 100g
Batata-doce 0,45 mg / 100g
– Feijão de soja 0,5 mg / 100g
– Couve cozida 0,22 mg / 100g
-Brócolis cozido 0,22 mg / 100g
– Grão-de-bico em lata 0,54 m / 100g
– Quinoa cozida 0,61 mg / 100g
– Farinha de Trigo Integral 4,0 mg / 100g
– Arroz integral cozido 0,85 mg / 100g
-Todos os cereais de marca 7,33 mg / 100g
– Sementes de Chia 2,33 mg / 100g
-Amêndoas torradas 2,14 mg / 100g
Com esses alimentos, é fácil atender aos requisitos de manganês, que foram estimados em homens em 2,3 mg / dia; enquanto as mulheres precisam tomar 1,8 mg / dia de manganês.
Papel biológico
O manganês está envolvido no metabolismo de carboidratos, proteínas e lipídios, bem como na formação óssea e no mecanismo de defesa contra os radicais livres.
O manganês é um cofator para a atividade de inúmeras enzimas, incluindo: superóxido redutase, ligases, hidrolases, cinases e descarboxilases. A deficiência de manganês tem sido associada à perda de peso, náusea, vômito, dermatite, retardo de crescimento e anormalidades esqueléticas.
O manganês está envolvido na fotossíntese, especificamente no funcionamento do fotossistema II, relacionado à dissociação da água para formar oxigênio. A interação entre os fotossistemas I e II é necessária para a síntese do ATP.
O manganês é considerado necessário para a fixação de nitrato pelas plantas, fonte de nitrogênio e um componente nutricional primário das plantas.
Usos
Aços
O manganês sozinho é um metal com propriedades insuficientes para aplicações industriais. No entanto, quando misturados em pequenas proporções com ferro fundido, os aços resultantes. Essa liga, chamada ferromanganês, também é adicionada a outros aços, sendo um componente essencial para torná-la inoxidável.
Além de aumentar sua resistência e resistência ao desgaste, também dessulfuriza, desoxigenados e desfosforilados, removendo átomos indesejáveis de S, O e P na produção de aço. O material formado é tão forte que é usado para a criação de trilhos, barras de gaiolas em prisões, capacetes, cofres, rodas, etc.
O manganês também pode ser ligado com cobre, zinco e níquel; isto é, para produzir ligas não ferrosas.
Latas de alumínio
O manganês também é usado para a produção de ligas de alumínio, normalmente destinadas ao fabrico de latas de refrigerantes ou cervejas. Essas ligas Al-Mn são resistentes à corrosão.
Fertilizantes
Como o manganês é benéfico para plantas, como MnO 2 ou MgSO 4, ele é usado na formulação de fertilizantes, para que os solos sejam enriquecidos com esse metal.
Oxidante
Mn (VII), especificamente como KMnO 4 , é um poderoso agente oxidante. Sua ação é tal que ajuda a desinfetar as águas, com o desaparecimento de sua cor violeta indicando que neutralizou os micróbios presentes.
Também serve como titulante nas reações analíticas redox; por exemplo, na determinação de ferro ferroso, sulfitos e peróxidos de hidrogênio. Além disso, é um reagente para realizar certas oxidações orgânicas, sendo na maioria das vezes síntese de ácidos carboxílicos; entre eles, ácido benzóico.
De vidro
O vidro naturalmente possui uma cor verde devido ao seu teor de óxido férrico ou silicatos ferrosos. Se for adicionado um composto que possa reagir com o ferro e isolá-lo do material, o vidro irá descolorir ou perder sua cor verde característica.
Quando o manganês é adicionado como MnO 2 para essa finalidade, e nada mais, o vidro transparente acaba cobrando tons de rosa, violeta ou azulado; é por isso que outros íons metálicos são sempre adicionados para neutralizar esse efeito e manter o vidro incolor, se esse for o desejo.
Por outro lado, se houver excesso de MnO 2 , é obtido um copo com tons marrom ou preto.
Secadores
sais de manganês, especialmente MnO 2 , Mn 2 O 3 , MnSO 4 , MnC 2 O 4 (oxalato), e outros, são usados para secar ou óleos de linhaça, a temperaturas baixas ou elevadas.
Nanopartículas
Como outros metais, seus cristais ou agregados podem ser tão pequenos até atingirem as escalas nanométricas; São nanopartículas de manganês (NPs-Mn), reservadas para aplicações que não são de aço.
Os NPs-Mn fornecem maior reatividade ao lidar com reações químicas nas quais o manganês metálico pode intervir. Embora seu método de síntese seja verde, usando extratos de plantas ou microorganismos, mais amigáveis serão suas possíveis aplicações com o meio ambiente.
Alguns de seus usos são:
Águas residuais -Depuran
– Fornecer demandas nutricionais de manganês
– Servir como agente antimicrobiano e antifúngico
-Degrada corantes
-Eles fazem parte de supercapacitores e baterias de íon de lítio
-Catalisar a epoxidação de olefinas
-Purificar extratos de DNA
Entre essas aplicações, as nanopartículas de seus óxidos (NPs MnO) também podem participar ou até substituir as metálicas.
Armações de metal orgânico
Os íons manganês podem interagir com uma matriz orgânica para estabelecer uma estrutura metálica orgânica (MOF: Metal Organic Framework ). Dentro das porosidades ou interstícios desse tipo de sólido, com ligações e estruturas direcionais bem definidas, reações químicas podem ser produzidas e catalisadas de forma heterogênea.
Por exemplo, a partir de MnCl 2 · 4H 2 O, benzenotricarboxilico e dimetilformamida, estas moléculas orgânicas são coordenados com o Mn 2+ para formar um MOF.
Este MOF-Mn é capaz de catalisar a oxidação de alcanos e alcenos, como: ciclo-hexeno, estireno, cicloocteno, adamantano e etilbenzeno, transformando-os em epóxidos, álcoois ou cetonas. As oxidações ocorrem dentro do sólido e de suas intrincadas redes cristalinas (ou amorfas).
Referências
- M. Weld e outros. (1920). Manganês: usos, preparação, custos de mineração e produção de ferroligas. Recuperado de: digicoll.manoa.hawaii.edu
- Wikipedia (2019). Manganês Recuperado de: en.wikipedia.org
- J. Bradley e J. Thewlis. (1927). A estrutura cristalina do α-manganês. Recuperado de: royalsocietypublishing.org
- Fullilove F. (2019). Manganês: fatos, usos e benefícios. Estudo Recuperado de: study.com
- Sociedade Real de Química. (2019). Tabela periódica: manganês. Recuperado de: rsc.org
- Vahid H. e Nasser G. (2018). Síntese verde de nanopartículas de manganês: Aplicações e perspectiva futura – Uma revisão. Jornal de Fotoquímica e Fotobiologia B: Biology Volume 189, Pages 234-243.
- Clark J. (2017). Manganês Recuperado de: chemguide.co.uk
- Farzaneh e L. Hamidipour. (2016). Estrutura Orgânica Mn-Metal como Catalisador Heterogêneo para Oxidação de Alcanos e Alcenos. Journal of Sciences, República Islâmica do Irã 27 (1): 31-37, Universidade de Teerã, ISSN 1016-1104.
- Centro Nacional de Informação Biotecnológica. (2019). Manganês Banco de Dados PubChem. CID = 23930. Recuperado de: pubchem.ncbi.nlm.nih.gov