Micelas são agregados de moléculas de surfactante que se formam em soluções aquosas. Essas estruturas possuem uma camada externa hidrofílica e uma camada interna hidrofóbica, permitindo que moléculas insolúveis em água sejam solubilizadas e transportadas. As micelas desempenham um papel fundamental em processos biológicos e industriais, atuando como agentes de limpeza, emulsificantes e transportadores de nutrientes. Neste contexto, é importante compreender a estrutura, função e formação das micelas para explorar seu potencial em diversas aplicações.
A importância das micelas no processo de limpeza da pele e remoção de impurezas.
As micelas são estruturas formadas por moléculas de surfactantes, que possuem a capacidade de se agrupar em formato de esfera em soluções aquosas. Essas micelas são fundamentais no processo de limpeza da pele e remoção de impurezas, pois atuam como verdadeiros ímãs que atraem e encapsulam as sujidades presentes na superfície da pele.
A principal função das micelas é capturar as impurezas lipofílicas, como o óleo, a maquiagem e a poluição, que não são solúveis em água. Ao formarem uma camada hidrofóbica ao redor dessas impurezas, as micelas conseguem removê-las de forma eficaz, sem agredir a pele.
Além disso, as micelas também são responsáveis por manter a hidratação da pele durante o processo de limpeza, já que não removem os lipídios naturais protetores da pele, evitando ressecamento e irritações.
Por serem suaves e eficazes, as fórmulas de limpeza com micelas são indicadas para todos os tipos de pele, inclusive as sensíveis, pois não contêm ingredientes agressivos que possam causar irritações.
Portanto, as micelas desempenham um papel fundamental na rotina de cuidados com a pele, garantindo uma limpeza profunda, delicada e eficaz, sem comprometer a integridade da barreira cutânea. É importante escolher produtos de qualidade que contenham micelas em sua composição para obter os melhores resultados na remoção de impurezas e na manutenção da saúde da pele.
Formação da micela: entenda o processo de organização molecular das moléculas de sabão.
A formação da micela é um processo fundamental para entender a ação do sabão. As moléculas de sabão são compostas por uma parte hidrofílica, que é atraída pela água, e uma parte hidrofóbica, que repele a água. Quando o sabão é adicionado à água, as moléculas se organizam em estruturas chamadas micelas.
As micelas são formadas quando as moléculas de sabão se orientam de forma que as partes hidrofílicas fiquem voltadas para fora da estrutura, em contato com a água, e as partes hidrofóbicas fiquem voltadas para o interior da micela, longe da água. Esse arranjo molecular é crucial para a capacidade do sabão de remover sujeira e gordura, pois as moléculas de sabão se ligam às partículas de sujeira e as envolvem dentro da micela.
Assim, as micelas funcionam como pequenas estruturas de limpeza, onde as moléculas de sabão se organizam de forma a solubilizar a gordura e a sujeira, facilitando sua remoção da superfície a ser limpa. É por isso que o sabão é tão eficaz na limpeza de superfícies sujas, pois as micelas agem como agentes emulsificantes, permitindo a remoção das impurezas pela água.
Entender esse processo molecular nos ajuda a compreender por que o sabão é tão eficaz na limpeza e na remoção de impurezas.
O que é micela: conceito e características fundamentais para entender a sua estrutura.
As micelas são estruturas formadas por moléculas anfifílicas em soluções aquosas. Essas moléculas possuem uma parte hidrofílica, que interage com a água, e uma parte hidrofóbica, que se agrupa no interior da micela, afastando-se da água.
Uma das características fundamentais das micelas é a capacidade de se organizarem em estruturas esféricas ou cilíndricas, com a parte hidrofílica voltada para o exterior e a parte hidrofóbica no interior. Isso ocorre devido à tendência das moléculas anfifílicas de minimizarem a interação com a água, formando assim uma estrutura estável.
Além disso, as micelas possuem propriedades de solubilização, ou seja, são capazes de “aprisionar” moléculas hidrofóbicas em seu interior, facilitando sua dispersão em meio aquoso. Essa característica é fundamental para diversas funções biológicas, como a digestão de gorduras no organismo.
Para a formação de micelas, é necessário um certo limite de concentração das moléculas anfifílicas na solução. Acima desse limite, as moléculas se organizam em micelas, permitindo a formação de estruturas estáveis e funcionais.
Essas estruturas desempenham um papel fundamental em processos biológicos e químicos, proporcionando solubilização de substâncias lipofílicas e facilitando diversas reações no meio aquoso.
Caracterização de micelas: propriedades físico-químicas que as definem e sua estrutura molecular.
As micelas são estruturas formadas por moléculas surfactantes em solução aquosa, que se organizam de maneira a reduzir a energia livre do sistema. Essas estruturas apresentam propriedades físico-químicas que as definem e são essenciais para sua formação e função.
Uma das principais propriedades das micelas é a capacidade de se auto-organizarem em solução, formando estruturas esféricas, cilíndricas ou lamelares, dependendo da natureza do surfactante e das condições do meio. Além disso, as micelas são capazes de solubilizar compostos hidrofóbicos em seu núcleo, proporcionando estabilidade a essas moléculas em meio aquoso.
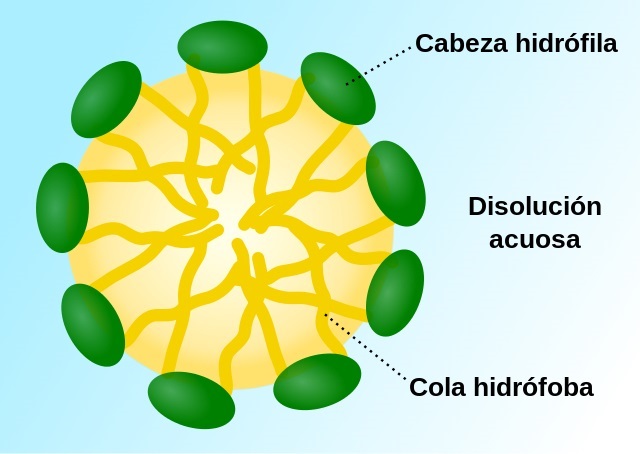
A estrutura molecular das micelas é caracterizada pela formação de uma camada superficial composta pelas cabeças hidrofílicas dos surfactantes, que interagem com a água, e um núcleo formado pelas caudas hidrofóbicas, que se repelem da água. Essa organização molecular é fundamental para a estabilidade e funcionalidade das micelas.
Sua estrutura molecular é essencial para sua formação e função, permitindo a solubilização de compostos hidrofóbicos em meio aquoso e a redução da tensão superficial.
Micelas: estrutura, função e formação

As micelas são estruturas esféricas estáveis formadas por centenas de moléculas anfipáticas, isto é, moléculas caracterizadas por uma região polar (hidrofílica) e não polar (hidrofóbica). Assim como as moléculas que as compõem, as micelas têm um centro fortemente hidrofóbico e sua superfície é “coberta” por grupos polares hidrofílicos.
Eles resultam, na maioria dos casos, da mistura de um grupo de moléculas anfipáticas com água, por isso é uma maneira de “estabilizar” as regiões hidrofóbicas de muitas moléculas juntas, fato que é motivado pelo efeito hidrofóbico e organizado pelas forças de van der Waals.
Tanto os detergentes quanto os sabões, assim como certos lipídios celulares, podem formar micelas, que têm relevância funcional, pelo menos em animais, do ponto de vista da absorção de gordura e do transporte de substâncias solúveis em gordura.
Os fosfolipídios, uma das classes lipídicas mais abundantes e importantes para células vivas, sob certas condições, podem formar, além de lipossomos e bicamadas, estruturas micelares.
As micelas também podem se formar em um meio apolar e, neste caso, são chamadas de “micelas reversas”, uma vez que as regiões polares das moléculas anfipáticas que as formam “se escondem” no centro hidrofílico enquanto as porções apolares estão em contato direto com o meio. que os contém.
Estrutura
As micelas são constituídas por moléculas anfipáticas ou, em outras palavras, moléculas que possuem uma região hidrofílica (relacionada à água, polar) e outra região hidrofóbica (repelente à água, apolar).
Essas moléculas incluem ácidos graxos, moléculas de qualquer detergente e fosfolipídios nas membranas celulares, por exemplo.
No contexto celular, uma micela é comumente composta de ácidos graxos (de comprimento variável), cujos grupos carboxila polares são expostos em direção à superfície do agregado, enquanto as cadeias de hidrocarbonetos “se escondem” em um centro hidrofóbico, e adotam uma estrutura mais ou menos esférica.
Os fosfolipídios, que são outras moléculas anfipáticas de grande importância para as células, geralmente não conseguem formar micelas, uma vez que as duas cadeias de ácidos graxos que compõem suas “caudas hidrofóbicas” são grandes e dificultam a possibilidade de qualquer forma de embalagem. esférico.
Em vez disso, quando essas moléculas estão em um meio aquoso, elas “se assentam” em bicamadas (semelhantes a um sanduíche); isto é, em estruturas mais planas, onde cada uma das “superfícies” expostas ao meio é composta pelas cabeças polares dos grupos ligados ao glicerol e o “preenchimento” do sanduíche consiste em caudas hidrofóbicas (os ácidos graxos esterificados para os outros dois carbonos do esqueleto de glicerol).
A única maneira de um fosfolípido participar da formação de uma micela é quando uma de suas duas cadeias de ácidos graxos é removida por hidrólise.
Organização
Em uma micela, como mencionado, o “centro” sequestra as porções apolares das moléculas que as compõem e as isola da água.
A região central de uma micela, então, consiste em um ambiente altamente desordenado, com características semelhantes a fluidos, no qual a medição do raio é entre 10 e 30% menor que a das cadeias totalmente estendidas de moléculas não anfipáticas. associado ao complexo molecular.
Da mesma forma, a superfície de uma micela não é homogênea, mas “áspera” e heterogênea, dos quais alguns estudos de ressonância magnética nuclear indicam que apenas um terço é coberto pelas porções polares dos monômeros constituintes.
Função
As micelas têm funções muito significativas, tanto na natureza quanto na indústria e na pesquisa.
Em relação às suas funções na natureza, esses agregados moleculares são particularmente importantes para a absorção intestinal de gorduras (monoglicerídeos e ácidos graxos), uma vez que micelas de diferentes tamanhos e composições podem ser formadas a partir das moléculas gordurosas ingeridas com os alimentos e transportadas para os dentro das células do revestimento intestinal, possibilitando sua absorção.
As micelas também funcionam no transporte de colesterol (outra classe de lipídios celulares) adquirida com a dieta e de algumas vitaminas chamadas “lipossolúveis”, razão pela qual também são exploradas farmacologicamente para o transporte e administração de medicamentos com características apolares.
Os detergentes e sabões usados diariamente para a higiene pessoal ou para a limpeza de diferentes tipos de superfícies são compostos de moléculas lipídicas capazes de formar micelas quando estão em uma solução aquosa.
Essas micelas se comportam como pequenas esferas em um rolamento, dando às soluções com sabão a consistência escorregadia e as propriedades lubrificantes. A ação da maioria dos detergentes depende consideravelmente de sua capacidade de produzir micelas.
Na investigação e estudo das proteínas da membrana, por exemplo, detergentes são usados para “purificar” os lisados celulares dos lipídios que formam as bicamadas características das membranas, bem como para separar as proteínas integrais da membrana dos componentes hidrofóbicos. disto.
Treinamento
Para entender a formação de estruturas micelares, especialmente em detergentes, é necessário levar em conta um conceito um tanto abstrato: a concentração micelar crítica ou CMC.
A concentração micelar crítica é a concentração de moléculas anfipáticas nas quais as micelas começam a se formar. É um valor de referência acima do qual um aumento na concentração dessas moléculas terminará apenas com um aumento no número de micelas e abaixo do qual estas são preferencialmente organizadas em camadas na superfície do meio aquoso que as contém. .
Assim, a formação de micelas é uma conseqüência direta da “anfifilicidade” dos surfactantes e depende muito das características estruturais destes, especialmente da relação de forma e tamanho entre o grupo polar e apolar.
Nesse sentido, a formação de micelas é favorecida quando a área da seção transversal do grupo polar é muito maior que a do grupo apolar, como ocorre com os ácidos graxos livres, com lisofosfolípides e com detergentes como o dodecil sulfato de sódio ( SDS).
Dois outros parâmetros dos quais depende a formação de micelas são:
– A temperatura também foi definida como temperatura micelar crítica (CMT, da temperatura micelar crítica em inglês ), que é a temperatura acima da qual a formação micelar é favorecida
– Força iônica: relevante principalmente para detergentes ou surfactantes do tipo iônico (cujo grupo polar possui carga)
Referências
- Hassan, PA, Verma, G. e Ganguly, R. (2011). 1 Materiais macios À Propriedades e aplicações. Materiais Funcionais: Preparação, Processamento e Aplicações, 1.
- Lodish, H., Berk, A., Kaiser, CA, Krieger, M., Scott, MP, Bretscher, A., … e Matsudaira, P. (2008). Biologia celular molecular. Macmillan.
- Luckey, M. (2014). Biologia estrutural de membranas: com fundamentos bioquímicos e biofísicos. Cambridge University Press.
- Nelson, DL, & Cox, MM (2009). Princípios de Bioquímica de Lehninger (pp. 71-85). Nova York: WH Freeman.
- Tanford, C. (1972). Micelle forma e tamanho. O Journal of Physical Chemistry, 76 (21), 3020-3024.
- Zhang, Y., Cao, Y., Luo, S., Mukerabigwi, JF e Liu, M. (2016). Nanopartículas como sistemas de administração de medicamentos de terapia combinada para câncer. In Nanobiomaterials in Cancer Therapy (pp. 253-280). Publicação de William Andrew.