O modelo atômico atual é a representação mais atualizada e aceita pela comunidade científica sobre a estrutura e composição dos átomos. Este modelo é baseado em postulados fundamentais propostos por diversos cientistas ao longo da história, como Niels Bohr, Erwin Schrödinger, Werner Heisenberg, entre outros.
Os átomos são compostos por um núcleo central, formado por prótons e nêutrons, ao redor do qual giram elétrons em órbitas definidas. A interação entre prótons e elétrons é responsável pelas propriedades químicas dos elementos químicos.
Os cientistas influentes que contribuíram para o desenvolvimento do modelo atômico atual realizaram experimentos e formulações matemáticas que permitiram compreender mais profundamente a natureza dos átomos. Através de suas descobertas, foi possível avançar no conhecimento sobre a estrutura atômica e suas aplicações em diversas áreas da ciência.
Principais características do modelo atômico atual: o que você precisa saber.
O modelo atômico atual é baseado em diversas teorias desenvolvidas ao longo da história da ciência. Suas principais características incluem a ideia de que o átomo é a menor unidade da matéria, composto por um núcleo central contendo prótons e nêutrons, ao redor do qual giram elétrons em órbitas definidas.
De acordo com o modelo atual, os elétrons não se movem em órbitas fixas, mas sim em regiões de alta probabilidade de se encontrar, chamadas de orbitais. Além disso, o átomo é eletricamente neutro, pois o número de prótons no núcleo é igual ao número de elétrons ao redor.
Os postulados do modelo atômico atual foram desenvolvidos por diversos cientistas ao longo do tempo, incluindo Niels Bohr, Erwin Schrödinger e Werner Heisenberg. Cada um contribuiu com ideias importantes para a construção desse modelo, que é fundamental para a compreensão da estrutura da matéria.
É importante conhecer suas principais características e postulados para entender melhor o mundo ao nosso redor.
Conheça os principais modelos atômicos utilizados atualmente na ciência da física moderna.
O Modelo atômico atual é baseado em diversos postulados e teorias propostas por cientistas ao longo da história. Atualmente, os principais modelos atômicos utilizados na ciência da física moderna são o Modelo Atômico de Bohr e o Modelo Atômico Quântico.
O Modelo Atômico de Bohr, proposto por Niels Bohr em 1913, postula que os elétrons se movem em órbitas ao redor do núcleo do átomo em níveis de energia quantizados. Cada órbita corresponde a um determinado nível de energia, e os elétrons podem pular de uma órbita para outra absorvendo ou emitindo energia. Este modelo foi fundamental para o entendimento da estrutura atômica e a explicação do espectro atômico.
O Modelo Atômico Quântico, desenvolvido a partir da teoria quântica, considera que os elétrons não se movem em órbitas fixas, mas sim em regiões de alta probabilidade de encontrar-se ao redor do núcleo. Essas regiões são chamadas de orbitais, e cada orbital pode conter até dois elétrons com spins opostos. Este modelo é mais complexo que o de Bohr, mas é capaz de explicar com maior precisão as propriedades dos átomos e das moléculas.
Alguns dos cientistas mais influentes na construção do Modelo Atômico atual são além de Niels Bohr, Max Planck, Albert Einstein, Werner Heisenberg, Erwin Schrödinger e Wolfgang Pauli. Cada um deles contribuiu com suas teorias e experimentos para o desenvolvimento da física moderna e a compreensão da estrutura atômica.
Autor do modelo atômico atual: qual cientista é o responsável por essa teoria?
O modelo atômico atual, que é a base da nossa compreensão da estrutura dos átomos, foi proposto pelo cientista Ernest Rutherford no início do século XX. Rutherford é conhecido por sua contribuição para a física nuclear e por ter feito importantes descobertas sobre a estrutura do átomo.
Qual é o modelo atômico mais aceito na atualidade?
O modelo atômico mais aceito na atualidade é o Modelo Atômico de Schrödinger, também conhecido como Mecânica Quântica. Este modelo foi desenvolvido a partir dos estudos do físico austríaco Erwin Schrödinger na década de 1920.
Este modelo é baseado em postulados fundamentais, como a dualidade onda-partícula da matéria, a existência de orbitais atômicos tridimensionais e a impossibilidade de determinar com precisão a posição e a velocidade de um elétron simultaneamente, de acordo com o Princípio da Incerteza de Heisenberg.
Os cientistas influentes no desenvolvimento e aceitação deste modelo incluem além de Schrödinger, nomes como Niels Bohr, Werner Heisenberg e Max Planck, que contribuíram significativamente para a compreensão da estrutura atômica e para a consolidação da mecânica quântica como base da física moderna.
Modelo atômico atual: características, postulados e cientistas influentes

O modelo atômico atual é aquele baseado na mecânica quântica, particularmente na equação de Schrödinger, no princípio da exclusão de Pauli e em uma propriedade do elétron chamada rotação ou rotação.
É o modelo de maior aceitação e uso no estudo da estrutura de átomos, moléculas e na reatividade química dos elementos, devido à precisão de suas previsões e à relativa simplicidade.
Esse modelo é a evolução de vários modelos atômicos anteriores, como o modelo de Rutherford e o modelo de Bohr – Sommerfeld, considerados modelos clássicos ou semi-clássicos.
Atualmente, existem teoricamente modelos mais completos que o modelo quântico mecânico de Schrödinger, como o modelo de Dirac-Jordan, que incorpora relatividade especial e é baseado na equação da onda de Dirac. Nesta equação, o spin, propriedade dos elétrons mencionados no início, aparece naturalmente.
Existem também modelos baseados na teoria quântica de campos, aplicados em física de alta energia. Esses modelos são excelentes para prever a criação e aniquilação de partículas fundamentais, o objetivo deste campo da física.
Vale ressaltar que as teorias mais sofisticadas convergem para os mesmos resultados que as da equação de Schrödinger, principalmente para átomos leves.
Características do modelo atômico atual
Na visão do átomo atual, baseado na mecânica quântica não relativista, não há espaço para o conceito de órbitas eletrônicas no estilo de sistemas planetários.
No entanto, a imagem mais difundida do átomo ainda é a de um núcleo central positivo e alguns pontos de carga elétrica negativa (os elétrons), girando em órbitas perfeitamente definidas ao redor do núcleo central. Mas, apesar de suas raízes, ele não corresponde mais ao modelo atômico atual.
A Figura 2 mostra a imagem antiga e a imagem atual de um átomo de hélio em seu estado de energia mais baixo (nível n = 1 e l = 0).
A imagem clássica é útil para ver que o núcleo contém dois prótons e dois nêutrons. Garantindo a neutralidade do átomo, existem dois elétrons ocupando o mesmo nível de energia.
O resto é uma imagem distante da realidade , pois a escala do núcleo nem mesmo corresponde à do átomo: o núcleo é 1/100000 vezes o tamanho do átomo, mas é aí que a massa atômica está concentrada.
Dualidade onda – partícula
A mecânica clássica afirma que toda partícula material tem uma onda associada, chamada função de onda . Essa é a famosa dualidade de onda-partícula de Louis De Broglie.
No modelo atômico atual, o comportamento do elétron na escala dos átomos é predominantemente ondulatório, enquanto no nível macroscópico, como os elétrons que se movem nos tubos de raios catódicos das antigas televisões, predomina o comportamento corpuscular.
Por outro lado, com os fótons, é o contrário, na maioria dos fenômenos ópticos (no nível macroscópico) eles têm um comportamento fundamentalmente ondulatório. E quando eles interagem com átomos da matéria , eles têm um comportamento de partículas.
Devido a isso, os elétrons ao redor do núcleo estão espalhados em zonas chamadas orbitais atômicos , cuja forma e extensão dependerão do nível de energia dos elétrons e do momento angular.
Tanto a energia quanto o momento angular do elétron ao redor do núcleo têm certos valores permitidos; portanto, eles são quantizados .
A equação de onda de Schrödinger prevê quais valores de energia e momento angular são permitidos, bem como a função de onda associada a cada nível e momento de energia.
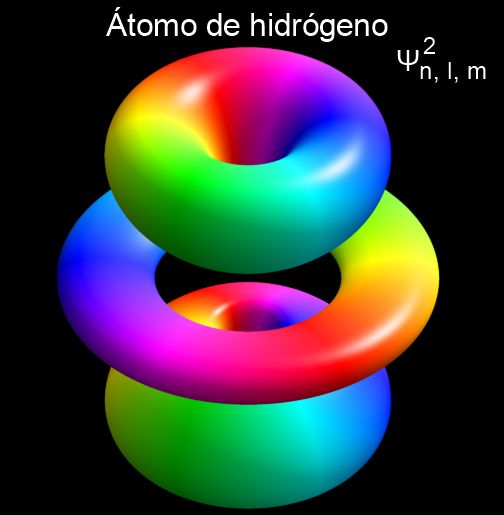
O quadrado matemático da função de onda determina os orbitais, ou seja, as áreas ao redor do núcleo onde os elétrons podem ser encontrados com maior probabilidade.
Tamanho do átomo
Para obter uma imagem em escala do modelo atômico atual, imagine que um átomo tenha um diâmetro como o de um campo de futebol. O núcleo seria como uma formiga no centro do campo, mas surpreendentemente com 99,9% da massa atômica.
Por outro lado, os elétrons seriam como jogadores fantasmas difusos em todo o campo, com maior probabilidade de serem encontrados no meio-campo.
Existem alguns alinhamentos ou maneiras permitidas de ocupar o campo, que dependem da energia dos jogadores (os elétrons) e da quantidade de “rotação” ou rotação ao redor do centro.
Postulados do modelo atômico atual
1.- O elétron é caracterizado por sua massa m, por seus giros s e por ser a partícula portadora de carga negativa elementar (-e).
2.- Os elétrons têm um comportamento duplo, simultâneo de partículas de onda, mas dependendo de sua energia e da escala do fenômeno, um pode ser mais preponderante que o outro.
3.- Os elétrons circundam o núcleo atômico positivo, de forma a garantir a neutralidade elétrica do átomo. Portanto, o número de elétrons é igual ao número de prótons; Este é o número atômico , que fornece as características químicas e físicas de cada elemento.
4.- A interação entre elétrons e núcleo é modelada por meio do potencial eletrostático V ( r ) de Coulomb, ao qual o termo de energia potencial é incorporado no operador hamiltoniano.
5.- O termo energia cinética no operador hamiltoniano é um operador construído a partir do operador de momento linear, sendo o mesmo:
p = – i ∂ / ∂ r
Onde ħ é a constante de Planck dividida por 2π.
6.- O operador hamiltoniano H = ( p⋅p) / 2m – e V ( r ) atua na função de onda do elétron Ψ ( r ).
7.- Como as soluções estacionárias da função de onda eletrônica são buscadas, é utilizada a equação de Schrödinger independente do tempo:
H Ψ ( r ) = E Ψ ( r )
Onde E representa a energia total do elétron.
8.- Em átomos com vários elétrons, a interação entre eles não é levada em consideração.
9.- Quando se trata de átomos de muitos elétrons, os orbitais dos elétrons mais externos são modelados pelo potencial do núcleo rastreado pelos elétrons mais internos, conhecido como potencial de Debye.
10.- A equação (7) tem uma solução para alguns valores de energia discretos, de modo que os famosos quanta de Planck surgem naturalmente das soluções da equação de Schrödinger.
11.- Para cada valor discreto de E existe uma função de onda. Mas algumas soluções são degeneradas, dependendo do valor do momento angular L.
12.- A função de onda é o produto de uma função radial, a função azimute e a função polar.
13.- Esta função de onda determina as regiões permitidas para o elétron. O quadrado da função de onda é a densidade de probabilidade de encontrar o elétron em uma determinada posição, vista do centro do núcleo atômico.
14.- O spin não aparece na equação de Schrödinger, mas é incorporado ao modelo atômico usando o princípio de Pauli:
O elétron é um férmion com dois estados possíveis de rotação + ½ e -½.
Portanto, o mesmo estado caracterizado pelos números quânticos n, l, m da equação de Schrödinger, pode ser ocupado no máximo por 2 elétrons com rotações opostas. Dessa maneira, a rotação se torna o quarto número quântico.
Cientistas influentes no atual modelo atômico
Parece incrível, mas a maioria dos físicos que contribuíram para o atual modelo atômico aparece na mesma foto. Eles se conheceram nas famosas conferências patrocinadas por Ernest Solvay, químico e industrial de origem belga, que se tornou famoso no mundo da ciência.
Eles começaram a ser realizados a partir de 1911 e reuniram os maiores cientistas do momento, dentre eles praticamente todos aqueles que deram sua contribuição ao atual modelo atômico.
A mais famosa dessas conferências foi realizada em Bruxelas em 1927 e esta fotografia histórica foi tirada lá:
- Peter Debye
- Irving Langmuir
- Martin Knudsen
- Auguste Piccard
- Max Planck
- William Lawrence Bragg
- Émile Henriot
- Paul Ehrenfest
- Marie Curie
- Hendrik Anthony Kramers
- Édouard Herzen
- Hendrik Antoon Lorentz
- Théophile de Donder
- Paul Adrien Maurice Dirac
- Albert Einstein
- Erwin Schrödinger
- Arthur Holly Compton
- Jules-Émile Verschaffelt
- Paul Langevin
- Louis-Victor de Broglie
- Charles-Eugène Guye
- Wolfgang Pauli
- Werner Heisenberg
- Max nascido
- Charles Thomson Rees Wilson
- Ralph Howard Fowler
- Léon Brillouin
- Niels Bohr
- Owen Williams Richardson
Artigos de interesse
Modelo atômico de Schrödinger .
Modelo atômico de Broglie .
Modelo atômico de Chadwick .
Modelo atômico de Heisenberg .
Modelo atômico de Perrin .
Modelo atômico Thomson .
Modelo atômico de Dalton .
Modelo atômico de Dirac Jordan .
Modelo atômico de Demócrito .
Modelo atômico de Bohr .
Referências
- Alonso – Finn. Fundamentos quânticos e estatísticos. Addison Wesley.
- Bauer, W. 2011. Física para Engenharia e Ciências. Volume 1. Mc Graw Hill.
- Eisberg e Resnick. Física quântica. Limusa – Wiley.
- Wikipedia. Teoria atômica. Recuperado de: es.wikipedia.com
- Zapata F. Modelo quântico-mecânico do átomo. Recuperado de: lifeder.com