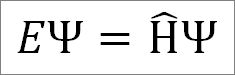O modelo atômico de Schrödinger é uma teoria quântica que descreve o comportamento dos elétrons em um átomo. Ele foi proposto pelo físico austríaco Erwin Schrödinger em 1926, como uma extensão do modelo atômico de Bohr.
Este modelo considera que os elétrons se comportam como ondas de probabilidade ao redor do núcleo do átomo, em vez de órbitas definidas. Os postulados principais do modelo de Schrödinger incluem a equação de Schrödinger, que descreve a evolução temporal de um sistema quântico, e o princípio da incerteza, que afirma que é impossível determinar com precisão a posição e o momento de um elétron simultaneamente.
Com o modelo atômico de Schrödinger, foi possível compreender de forma mais completa e precisa o comportamento dos elétrons nos átomos, e suas interações com o núcleo e com outras partículas subatômicas. Este modelo é fundamental para a compreensão da estrutura atômica e de diversos fenômenos quânticos observados na natureza.
Fundamentos do modelo atômico atual: quais são os postulados essenciais para compreendê-lo?
O Modelo Atômico de Schrödinger é um dos mais importantes para a compreensão da estrutura dos átomos. Ele foi proposto pelo físico austríaco Erwin Schrödinger em 1926 e é baseado na mecânica quântica. Para entender esse modelo, é essencial compreender seus postulados fundamentais.
Um dos postulados essenciais do modelo atômico de Schrödinger é a ideia de que os elétrons em torno do núcleo atômico não se comportam como partículas pontuais, mas sim como ondas de matéria. Isso significa que a posição e a energia de um elétron em um átomo não podem ser determinadas com precisão, mas sim descritas por meio de uma função de onda.
Outro postulado importante é a equação de Schrödinger, que descreve a evolução temporal da função de onda de um sistema quântico. Essa equação é fundamental para determinar as propriedades dos elétrons em um átomo, como a distribuição de probabilidade de encontrar um elétron em determinada região do espaço.
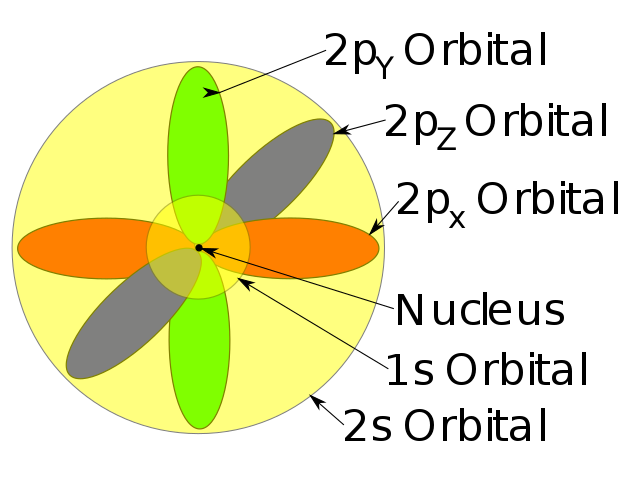
Além disso, o modelo atômico de Schrödinger considera a ideia de que os elétrons em um átomo ocupam diferentes níveis de energia, representados por orbitais atômicos. Cada orbital possui uma forma específica e pode conter até dois elétrons com spins opostos.
Em resumo, os postulados essenciais do modelo atômico de Schrödinger incluem a natureza ondulatória dos elétrons, a equação de Schrödinger para descrever a evolução temporal da função de onda e a existência de orbitais atômicos que representam os diferentes níveis de energia dos elétrons em um átomo.
Características essenciais do modelo atômico em destaque.
O modelo atômico de Schrödinger é baseado na teoria da mecânica quântica e apresenta características essenciais que o distinguem de outros modelos atômicos. Uma das principais características é a consideração dos elétrons como ondas de probabilidade ao redor do núcleo, em vez de partículas com órbitas definidas. Isso significa que a posição exata de um elétron não pode ser determinada com precisão, mas sim a probabilidade de sua presença em determinadas regiões do átomo.
Outro aspecto importante do modelo de Schrödinger são os orbitais atômicos, que representam as regiões do espaço onde a probabilidade de encontrar um elétron é maior. Cada orbital possui uma forma específica e pode conter até dois elétrons com spins opostos, de acordo com o princípio de exclusão de Pauli.
Além disso, o modelo de Schrödinger introduz os números quânticos, que descrevem as propriedades dos elétrons em um átomo. Os números quânticos incluem o número principal, o número azimutal, o número magnético e o spin, e são essenciais para descrever os orbitais e prever o comportamento dos elétrons em um átomo.
Em resumo, o modelo atômico de Schrödinger apresenta características únicas, como a descrição dos elétrons como ondas de probabilidade, a presença de orbitais atômicos com formas específicas e a introdução dos números quânticos para descrever as propriedades dos elétrons. Essas características são fundamentais para a compreensão da estrutura atômica e do comportamento dos elétrons nos átomos.
Entendendo a teoria de Schrödinger: o que você precisa saber sobre ela.
A teoria de Schrödinger é fundamental para compreender o funcionamento dos átomos e suas partículas constituintes. Desenvolvida pelo físico austríaco Erwin Schrödinger, a teoria quântica proposta por ele revolucionou a física e a química no século XX.
O Modelo atômico de Schrödinger é baseado em equações matemáticas que descrevem o comportamento das partículas subatômicas, como elétrons, em torno do núcleo do átomo. Diferentemente do modelo de Bohr, que descrevia os elétrons em órbitas circulares ao redor do núcleo, o modelo de Schrödinger considera os elétrons como ondas de probabilidade, distribuídas em regiões chamadas orbitais.
Os postulados da teoria de Schrödinger incluem a ideia de que os elétrons se comportam tanto como partículas quanto como ondas, podendo estar em vários estados ao mesmo tempo. Além disso, a teoria considera a existência de níveis de energia quantizados, ou seja, os elétrons só podem ocupar determinadas regiões em torno do núcleo, chamadas de níveis de energia.
Uma das principais características do Modelo atômico de Schrödinger é a capacidade de prever com precisão a distribuição eletrônica nos átomos, possibilitando entender propriedades como o tamanho, a forma e a reatividade dos elementos químicos. Essa abordagem probabilística permitiu avanços significativos na compreensão da estrutura atômica e na elaboração de modelos mais complexos.
Em resumo, a teoria de Schrödinger é essencial para a compreensão do comportamento dos elétrons nos átomos, fornecendo uma descrição mais completa e precisa da estrutura atômica. Seu Modelo atômico representa um marco na história da física quântica e continua a ser uma ferramenta fundamental para os cientistas que estudam a matéria em nível subatômico.
As ideias de Schrödinger em relação à superposição quântica e ao gato de Schrödinger.
O físico austríaco Erwin Schrödinger foi um dos pioneiros na formulação do Modelo Atômico Quântico, que revolucionou a física no início do século XX. Uma de suas contribuições mais famosas foi a equação de Schrödinger, que descreve o comportamento dos sistemas quânticos de forma mais precisa do que a mecânica quântica anterior.
Uma das ideias mais intrigantes de Schrödinger é a superposição quântica, que desafia nossa intuição clássica sobre a realidade. De acordo com a superposição, um sistema quântico pode existir em múltiplos estados simultaneamente, até que seja observado e seu estado seja “colapsado” para um único resultado. Isso levou Schrödinger a propor um experimento mental famoso, conhecido como o “gato de Schrödinger”. Neste experimento, um gato é colocado em uma caixa selada junto com um dispositivo quântico que pode matar o gato com base em um evento aleatório. Até que a caixa seja aberta e o gato seja observado, ele estaria em uma superposição de estar vivo e morto ao mesmo tempo.
O Modelo Atômico de Schrödinger é baseado em alguns postulados-chave, como a descrição de um sistema quântico por uma função de onda, que evolui de acordo com a equação de Schrödinger. Esse modelo permite prever com precisão as propriedades dos átomos e moléculas, levando a avanços significativos na química quântica e em outras áreas da ciência.
Em resumo, as ideias de Schrödinger em relação à superposição quântica e ao gato de Schrödinger desafiaram as concepções tradicionais de realidade e abriram novos horizontes para a compreensão do mundo quântico. Seu Modelo Atômico trouxe uma nova abordagem para o estudo dos sistemas quânticos, proporcionando uma base sólida para a física moderna.
Modelo atômico de Schrödinger: características, postulados
O modelo atómico Schrodinger foi desenvolvido por Erwin Schrödinger em 1926. Esta proposta é conhecido como o quantum – modelo mecânico do átomo, e descreve o comportamento do tipo onda do electrão.
Para isso, o proeminente físico austríaco baseou-se na hipótese de Broglie, que afirmou que cada partícula em movimento está associada a uma onda e pode se comportar como tal.
Schrödinger sugeriu que o movimento dos elétrons no átomo correspondia à dualidade onda-partícula e, conseqüentemente, os elétrons podiam se mover ao redor do núcleo como ondas estacionárias.
Schrödinger, que recebeu o Prêmio Nobel em 1933 por suas contribuições à teoria atômica, desenvolveu a equação homônima para calcular a probabilidade de um elétron estar em uma posição específica.
Características do modelo atômico de Schrödinger
-Descreva o movimento dos elétrons como ondas estacionárias.
-Os elétrons se movem constantemente, ou seja, eles não têm uma posição fixa ou definida dentro do átomo.
-Este modelo não prevê a localização do elétron, nem descreve a rota que ele percorre dentro do átomo. Estabeleça apenas uma zona de probabilidade para localizar o elétron.
-Estas áreas de probabilidade são chamadas de orbitais atômicos. Os orbitais descrevem um movimento de translação ao redor do núcleo do átomo.
– Esses orbitais atômicos têm diferentes níveis e subníveis de energia e podem ser definidos entre nuvens de elétrons.
-O modelo não contempla a estabilidade do núcleo, refere-se apenas à explicação da mecânica quântica associada ao movimento dos elétrons dentro do átomo.
Experiência
O modelo atômico de Schrödinger é baseado na hipótese de Broglie e nos modelos atômicos anteriores de Bohr e Sommerfeld.
Para fazer isso, Schrödinger confiou no experimento de Young e, com base em suas próprias observações, desenvolveu a expressão matemática que leva seu nome.
A seguir, os fundamentos científicos desse modelo atômico:
O experimento de Young: a primeira demonstração da dualidade onda-partícula
A hipótese de Broglie sobre a onda e a natureza corpuscular da matéria pode ser demonstrada pelo Experimento de Young, também conhecido como experimento de dupla fenda.
O cientista inglês Thomas Young lançou as bases do modelo atômico de Schrödinger quando, em 1801, conduziu o experimento para verificar a natureza das ondas da luz.
Durante sua experimentação, Young dividiu a emissão de um feixe de luz através de um pequeno buraco através de uma câmara de observação. Essa divisão é alcançada usando um cartão de 0,2 mm, localizado paralelo ao feixe.
O desenho do experimento foi feito de modo que o feixe de luz fosse mais largo que o cartão, portanto, ao colocar o cartão horizontalmente, o feixe foi dividido em duas partes aproximadamente iguais. A saída dos feixes de luz foi direcionada por um espelho.
Os dois raios de luz atingiram uma parede em um quarto escuro. Havia evidências do padrão de interferência entre as duas ondas, o que mostrou que a luz podia se comportar tanto quanto uma partícula como uma onda.
Um século depois, Albert Einsten reforçou a idéia através dos princípios da mecânica quântica.
Equação de Schrödinger
Schrödinger desenvolveu dois modelos matemáticos, diferenciando o que acontece dependendo se o estado quântico muda com o tempo ou não.
Para a análise atômica, Schrödinger publicou no final de 1926 a equação de Schrödinger independente do tempo, que se baseia no fato de que as funções das ondas se comportam como ondas estacionárias.
Isso implica que a onda não se move, seus nós, ou seja, seus pontos de equilíbrio, servem como um pivô para o restante da estrutura se mover em torno deles, descrevendo uma certa frequência e amplitude.
Schrödinger definiu as ondas que descrevem os elétrons como estados estacionários ou orbitais e, por sua vez, estão associadas a diferentes níveis de energia.
A equação de Schrödinger independente do tempo é a seguinte:
Onde:
E : proporcionalidade constante.
Ψ : função de onda do sistema quântico.
Η : operador hamiltoniano.
A equação de Schrödinger independente do tempo é usada quando o observável que representa a energia total do sistema, conhecido como operador Hamiltoniano, não depende do tempo. No entanto, a função que descreve o movimento total das ondas sempre dependerá do tempo.
A equação de Schrödinger indica que, se existe uma função de onda funcional, e o operador hamiltoniano atua sobre ela, a constante de proporcionalidade E representa a energia total do sistema quântico em um de seus estados estacionários.
Aplicado ao modelo atômico de Schrödinger, se o elétron se move em um espaço definido, existem valores discretos de energia e, se o elétron se move livremente no espaço, há intervalos contínuos de energia.
Do ponto de vista matemático, existem várias soluções para a equação de Schrödinger, cada solução implica um valor diferente para a constante de proporcionalidade E.
De acordo com o princípio da incerteza de Heisenberg, não é possível estimar a posição ou energia de um elétron. Consequentemente, os cientistas reconhecem que a estimativa da localização do elétron no átomo é imprecisa.
Postulados
Os postulados do modelo atômico de Schrödinger são os seguintes:
-Os elétrons se comportam como ondas estacionárias que são distribuídas no espaço de acordo com a função de função onda.
-Os elétrons se movem dentro do átomo na descrição dos orbitais. São áreas em que a probabilidade de encontrar um elétron é consideravelmente maior. A probabilidade referida é proporcional ao quadrado da função de onda Ψ 2 .
A configuração eletrônica do modelo atômico de Schrödinguer explica as propriedades periódicas dos átomos e as ligações que eles formam.
No entanto, o modelo atômico de Schrödinger não contempla a rotação de elétrons, nem considera variações no comportamento dos elétrons rápidos devido a efeitos relativísticos.
Artigos de interesse
Modelo atômico de Broglie .
Modelo atômico de Chadwick .
Modelo atômico de Heisenberg .
Modelo atômico Perrin .
Modelo atômico de Thomson .
Modelo atômico de Dalton .
Modelo atômico de Dirac Jordan .
Modelo atômico de Demócrito .
Modelo atômico de Bohr .
Referências
- O modelo atômico de Schrodinger (2015) é obtido a partir de: quimicas.net
- O modelo mecânico quântico do átomo Recuperado de: es.khanacademy.org
- A equação da onda de Schrödinger (sf). Universidade Jaime I. Castellón, Espanha. Recuperado de: uji.es
- Teoria atômica moderna: modelos (2007). © ABCTE. Recuperado de: abcte.org
- Modelo atômico de Schrodinger (sf). Recuperado de: erwinschrodingerbiography.weebly.com
- Wikipedia, A Enciclopédia Livre (2018). Equação de Schrödinger. Recuperado de: en.wikipedia.org
- Wikipedia, A Enciclopédia Livre (2017). O experimento de Young. Recuperado de: en.wikipedia.org