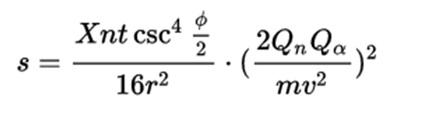O experimento de Rutherford foi uma importante experiência realizada em 1909 por Ernest Rutherford, que contribuiu significativamente para o entendimento da estrutura do átomo. Neste experimento, Rutherford bombardeou uma fina folha de ouro com partículas alfa e observou que algumas delas eram desviadas em ângulos inesperados. Isso levou à conclusão de que o átomo possui um núcleo central denso e positivamente carregado, ao redor do qual os elétrons orbitam. Esta descoberta revolucionou a teoria atômica e abriu caminho para a compreensão mais profunda da estrutura do átomo.
As descobertas de Rutherford em seu experimento de dispersão de partículas alfa.
No início do século XX, o cientista Ernest Rutherford realizou um experimento que mudou nossa compreensão da estrutura do átomo. Utilizando partículas alfa como projéteis, Rutherford bombardeou uma fina folha de ouro e observou sua dispersão. O experimento de dispersão de partículas alfa revelou que a maioria das partículas passava diretamente pela folha de ouro, mas algumas sofriam desvios significativos e outras até mesmo refletiam de volta.
Essas observações levaram Rutherford a concluir que o átomo não era uma esfera maciça e homogênea, como se acreditava na época, mas sim um núcleo pequeno e denso cercado por uma nuvem de elétrons. Os desvios e reflexões das partículas alfa indicavam a presença de uma carga positiva concentrada no núcleo. Esta descoberta revolucionária mudou a teoria atômica e deu origem ao modelo atômico de Rutherford, também conhecido como modelo planetário.
Em resumo, o experimento de dispersão de partículas alfa de Rutherford demonstrou a existência de um núcleo atômico carregado positivamente e revelou a verdadeira estrutura do átomo. Suas descobertas tiveram um impacto significativo no campo da física e pavimentaram o caminho para novas teorias e descobertas no estudo da matéria.
Explicação do átomo segundo o modelo de Rutherford: o que é e como funciona.
Explicação do átomo segundo o modelo de Rutherford: O modelo atômico proposto por Ernest Rutherford em 1911 revolucionou a compreensão da estrutura do átomo. Segundo sua teoria, o átomo é formado por um núcleo central, onde se concentra a maior parte da massa, composto por prótons e nêutrons. Ao redor do núcleo, os elétrons orbitam em diferentes níveis de energia, formando uma espécie de “nuvem eletrônica”.
O que é e como funciona: No experimento de Rutherford, realizado com partículas alfa, foi possível observar que a maioria das partículas passava direto pelo átomo, enquanto algumas sofriam desvios significativos. Isso levou à conclusão de que o átomo possui um núcleo denso e carregado positivamente, capaz de repelir as partículas alfa carregadas positivamente. Essa descoberta foi fundamental para entender a estrutura do átomo e confirmar a existência do núcleo atômico.
O modelo de Rutherford foi um grande avanço na compreensão da estrutura atômica e abriu caminho para novas descobertas na área da física nuclear. Apesar de ter sido posteriormente aprimorado com a teoria do orbital atômico de Niels Bohr, o modelo de Rutherford continua sendo uma peça fundamental no estudo da matéria e das interações fundamentais.
Principais características do modelo de Rutherford: descubra as principais características desse modelo atômico.
O modelo atômico de Rutherford foi proposto pelo físico Ernest Rutherford em 1911, após seus experimentos com a dispersão de partículas alfa por uma fina folha de ouro. Esse experimento revelou algumas das principais características desse modelo atômico.
Uma das principais características do modelo de Rutherford é a existência de um núcleo atômico denso e carregado positivamente, que concentra praticamente toda a massa do átomo. As partículas alfa que foram dispersadas durante o experimento indicaram que a maior parte do átomo é composta por espaço vazio, com elétrons girando em órbita ao redor do núcleo.
Outra característica importante do modelo de Rutherford é a ideia de que os elétrons estão em movimento constante ao redor do núcleo, criando assim a estabilidade do átomo. Essa concepção revolucionou a compreensão da estrutura atômica, substituindo o modelo anterior de Thomson, que considerava o átomo como uma esfera uniforme de carga positiva com elétrons dispersos.
Portanto, as principais características do modelo de Rutherford incluem a presença de um núcleo carregado positivamente, a distribuição dos elétrons em órbita ao redor do núcleo e a estabilidade do átomo devido ao movimento dos elétrons. Essas descobertas foram fundamentais para o desenvolvimento da física moderna e continuam sendo estudadas e aprimoradas até os dias atuais.
Principais descobertas de Rutherford na criação de seu modelo atômico revolucionário.
Ernest Rutherford foi um dos cientistas mais importantes do século XX, principalmente por suas descobertas revolucionárias no campo da física nuclear. Seu experimento com a dispersão de partículas alfa em uma folha de ouro levou a algumas conclusões fundamentais que mudaram nossa compreensão da estrutura atômica.
Uma das principais descobertas de Rutherford foi a existência de um núcleo atômico denso e carregado positivamente. Ao observar que a maioria das partículas alfa passava diretamente pela folha de ouro, mas algumas eram desviadas em ângulos muito grandes, ele concluiu que a maior parte da massa do átomo estava concentrada em um espaço muito pequeno. Isso contradizia o modelo atômico de Thomson, que sugeria que os átomos eram uma esfera de carga positiva com elétrons dispersos.
Outra descoberta importante de Rutherford foi a proposição de que os elétrons orbitavam em torno do núcleo em órbitas definidas. Ele sugeriu que os elétrons giravam em torno do núcleo sem perder energia, evitando assim o colapso do átomo devido à força eletrostática entre as cargas opostas.
Essas descobertas levaram à criação do modelo atômico de Rutherford, que desempenhou um papel crucial no desenvolvimento da física nuclear. Seu experimento mostrou a complexidade e a estrutura interna dos átomos, abrindo caminho para novas teorias e descobertas no campo da física quântica.
O experimento de Rutherford e seus protótipos
O experimento Rutherford permitido um grupo de cientistas descobriu que cada átomo tem um núcleo positivamente carregado.
Ernest Rutherford , era físico e químico da Nova Zelândia. Ele se concentrou no estudo de partículas radioativas e conduziu várias investigações que lhe permitiram ganhar o Prêmio Nobel de Química em 1908.

Sob a direção de Rutherford, Hans Geiger e Ernest Marsden, ajudaram a criar o modelo atômico, nos laboratórios da Universidade de Manchester.
Uma das primeiras teorias atômicas existentes é a formulada por Thomson , o descobridor do elétron. Ele acreditava que os átomos eram esferas com uma carga positiva e que elétrons estavam distribuídos nela.
A teoria de Thomson dizia que, se uma partícula alfa colidisse com um átomo, ela passaria através do átomo. Isso seria afetado pelo campo elétrico do átomo de acordo com este modelo.
Nesse momento, prótons e nêutrons não haviam sido descobertos. Thomson não pôde provar sua existência e seu modelo não foi aceito pela comunidade científica.
Para demonstrar a existência da teoria de Thomson, Rutherford, Geiger e Marsdendise conduziram um experimento no qual bombardearam partículas alfa, feitas com núcleos de gás hélio, contra uma folha de metal.
Se o modelo Thomson funcionar, as partículas devem passar através da folha de metal praticamente sem qualquer desvio.
Desenvolvimento de experimentos em Rutherford
Primeiro protótipo
O primeiro protótipo do experimento, realizado em 1908, foi explicado por Geiger em um artigo intitulado On the Dispersion of Particles by Matter .
Eles construíram um tubo de vidro com quase dois metros de comprimento, em uma extremidade havia uma fonte de rádio e na extremidade oposta uma tela fosforescente foi colocada. No meio do tubo, um tipo de funil foi colocado para que as partículas alfa passassem por ele.
O processo que se seguiu foi passar as partículas alfa pela fenda para projetar o feixe de luz na tela fosforescente.
Ao bombear todo o ar no tubo, a imagem obtida era nítida e correspondia à abertura no meio do tubo. Quando a quantidade de ar no tubo foi reduzida, a imagem ficou mais difusa.
Então, para ver que caminho as partículas seguiam se colidissem com alguma coisa ou passassem por ela, como sustentava a teoria de Thomson, uma folha de ouro foi inserida no sulco.
Isso mostrou que o ar e os materiais sólidos causaram uma dispersão das partículas que foram refletidas na tela fosforescente com imagens mais difusas.
O problema com este primeiro protótipo é que ele apenas mostrou o resultado da dispersão, mas não o caminho que as partículas alfa seguiram.
Segundo protótipo
Geiger e Marsden publicam um artigo em 1909 no qual eles explicaram um experimento para demonstrar o movimento de partículas alfa.
Em uma reflexão difusa das partículas alfa, é explicado que o experimento visa descobrir que as partículas se movem em ângulos superiores a 90 graus.
Eles criaram um segundo protótipo para o experimento, onde um vaso de vidro em forma cônica foi criado. Eles montaram uma placa de chumbo, de modo que as partículas alfa colidissem com ela e, para ver sua dispersão, uma placa fluorescente foi colocada atrás.
O problema com a configuração deste dispositivo é que as partículas evitavam a placa de chumbo, quicando nas moléculas de ar.
Eles testaram a colocação de uma folha de metal e viram na tela fluorescente que havia mais acertos das partículas.
Foi demonstrado que metais com maior massa atômica refletiam mais partículas, mas Geiger e Masden queriam saber o número exato de partículas. Mas o experimento com rádio e materiais radioativos não pôde ser exato.
Terceiro protótipo
O artigo A dispersão de partículas α por matéria de 1910 explica o terceiro experimento que Geiger projetou. Aqui ele já se concentrou em medir o ângulo de dispersão das partículas, dependendo do material em que elas entraram em contato.
Dessa vez, o tubo estava estanque e o mercúrio bombeava o radônio 222 para a tela fluorescente. Com a ajuda do microscópio , os flashes que apareceram na tela fluorescente foram contados.
Os ângulos que se seguiram às partículas foram calculados e chegou-se à conclusão de que os ângulos de deflexão aumentam com a maior massa atômica do material e também é proporcional à massa atômica da substância.
No entanto, o ângulo de deflexão mais provável diminui com a velocidade e a probabilidade de desviar mais de 90º é insignificante.
Com os resultados obtidos neste protótipo, Rutherford calculou matematicamente o padrão de dispersão.
Através de uma equação matemática, foi calculado como a folha deve dispersar as partículas, assumindo que o átomo tenha a carga elétrica positiva em seu centro. Embora este último tenha sido considerado apenas uma hipótese.
A equação desenvolvida ficou assim:
Onde, s = o número de partículas alfa que caem na área da unidade com um ângulo de deflexão Φ
- r = distância do ponto de incidência dos raios alfa no material de dispersão
- X = número total de partículas que caem no material de dispersão
- n = número de átomos em um volume unitário do material
- t = espessura da folha
- Qn = carga positiva do núcleo atômico
- Qα = carga positiva de partículas alfa
- m = massa de uma partícula alfa
- v = a velocidade da partícula alfa
Protótipo final
Com o modelo da equação de Rutherford, foi feita uma tentativa de demonstrar o que estava sendo postulado e que os átomos tinham um núcleo com carga positiva.
A equação projetada previu que o número de cintilações por minuto (s) a serem observadas em um determinado ângulo (Φ) deve ser proporcional a:
- csc 4 Φ / 2
- espessura da folha t
- magnitude da carga central Qn
- 1 / (mv 2 ) 2
Para demonstrar essas quatro hipóteses, são criados quatro experimentos, explicados pelo artigo As leis da deflexão de partículas α por grandes ângulos de 1913.
Para testar o efeito proporcional ao csc 4 Φ / 2, eles construíram um cilindro em cima de uma plataforma giratória, em uma coluna.
A coluna bombeando o ar e o microscópio coberto com uma tela fluorescente permitiram observar as partículas que se desviavam até 150º, com as quais foi demonstrada a hipótese de Rutherford.
Para testar a hipótese da espessura da folha, eles montaram um disco com 6 furos cobertos com folhas de espessura variada. Observou-se que o número de flashes era proporcional à espessura.
Eles reutilizaram o disco do experimento anterior para medir o padrão de dispersão, assumindo que a carga do núcleo era proporcional ao peso atômico, e mediram se a dispersão era proporcional ao peso atômico ao quadrado.
Com os flashes obtidos, divididos pelo equivalente ao ar e depois divididos pela raiz quadrada do peso atômico, eles descobriram que as proporções eram semelhantes
E, finalmente, com o mesmo disco do experimento, eles estavam colocando mais discos de mica para retardar as partículas e, com um intervalo de erro aceitável, mostraram que o número de cintilações era proporcional a 1 / v 4 , como Rutherford previra. modelo.
Através dos experimentos, eles provaram que todas as hipóteses de Rutherford foram cumpridas para que o Modelo Atômico de Rutherford fosse determinado. Neste modelo, finalmente publicado em 1917, postula-se que os átomos tenham um núcleo central com carga positiva.
Se o núcleo central do átomo é aquele com carga positiva, o restante do átomo ficará vazio com os elétrons orbitando em torno dele.
Com esse modelo, foi mostrado que os átomos têm uma carga neutra e que a carga positiva encontrada no núcleo é compensada pelo mesmo número de elétrons que orbitam em torno dele.
Se removermos elétrons do átomo, eles ficarão com uma carga positiva. Os átomos são estáveis, já que a força centrífuga é igual à força elétrica, mantendo os elétrons no lugar
Referências
- CUÉLLAR FERNÁNDEZ, Luigi; GALLEGO BADILLO, Romulus; PÉREZ MIRANDA, Royman. O modelo atômico de E. Rutherford. Ensino de Ciências , 2008, vol. 26)
- BOHR, Niels. The Rutherford Memorial Lecture 1958 Reminiscências do Fundador da Ciência Nuclear e de alguns desenvolvimentos baseados em seu trabalho. Anais da Sociedade Física , 1961.
- JUSTI, Rosaria; Gilbert, John. História e filosofia da ciência através de modelos: alguns desafios no caso do “átomo”. International Journal of Science Education , 2000, vol. 22
- COHEN-TANNOUDJI, Claude, et al. Interações átomo-fóton: processos e aplicações básicas . Nova York: Wiley, 1992.
- AGUILERA, Damarys, et al. Modelos conceituais de estudantes universitários sobre estrutura atômica com base nos experimentos de Thomson, Rutherford e Bohr / Modelos conceituais de estudantes universitários sobre estrutura atômica com base em experimentos de Thomson, Rutherford e Bohr. Journal of Science Education , 2000, vol. 1, não 2.
- DE LA LLATA LOYOLA, Maria Dolores. química inorgânica . Editorial Progreso, 2001.
- TORRES, Amalia Williart. Experiência histórica: descoberta do núcleo atômico: a experiência de Rutherford. 100cias UNED , 2003, no 6, p. 107-111.