A entalpia é uma medida da quantidade de energia contida num corpo (sistema) que tem um volume, é submetido à pressão e é intercambiável com o seu ambiente. É representado pela letra H. A unidade física associada a ele é julho (J = kgm2 / s2).
Matematicamente, pode ser expresso da seguinte forma:
H = U + PV
Onde:
H = Entalpia
U = energia interna do sistema
P = Pressão
V = Volume
Se U, P e V são funções de estado, H também será. Isso ocorre porque, a qualquer momento, podem ocorrer condições finais e iniciais da variável a ser estudada no sistema.
Qual é a entalpia do treinamento?
É o calor absorvido ou liberado por um sistema quando, 1 mole de um produto de uma substância, é produzido a partir de seus elementos em seu estado normal de agregação; sólido, líquido, gás, solução ou em seu estado alotrópico mais estável.
O estado alotrópico mais estável do carbono é a grafite, além de estar em condições normais de pressão de 1 atmosfera e temperatura de 25 ° C.
É denotado como ΔH ° f. De esta maneira:
ΔH ° f = H final – H inicial
Δ: letra grega que simboliza a mudança ou variação na energia de um estado final e um estado inicial. O subscrito f significa formação do composto e o sobrescrito ou condições padrão.
Exemplo
Considerando a reação de formação de água líquida
H2 (g) + ½ O2 (g) H2O (l) ΔH ° f = -285,84 kJ / mol
Reagentes : Hidrogênio e oxigênio, seu estado natural é gasoso.
Produto : 1 mol de água líquida.
Deve-se notar que as entalpias de formação de acordo com a definição são para 1 mol do composto produzido, portanto a reação deve ser ajustada, se possível, com coeficientes fracionários, como visto no exemplo anterior.
Reações exotérmicas e endotérmicas
Em um processo químico, a entalpia de formação pode ser positiva ΔHof> 0 se a reação for endotérmica, ou seja, absorve calor do meio ou negativa ΔHof <0 se a reação é exotérmica com emissão de calor do sistema.
Reação exotérmica
Os reagentes têm mais energia que produtos.
ΔH ° f <0
Reação endotérmica
Os reagentes têm menos energia que os produtos.
ΔH ° f> 0
Para escrever corretamente uma equação química, ela deve ser equilibrada molarmente. Para cumprir a “Lei sobre conservação de matéria”, ela também deve conter informações sobre o estado físico dos reagentes e produtos, conhecido como estado de agregação.
Também deve ser levado em consideração que as substâncias puras têm uma entalpia de formação de zero a condições padrão e em sua forma mais estável.
Em um sistema químico em que existem reagentes e produtos, a entalpia de reação deve ser igual à entalpia de formação em condições padrão.
ΔH ° rxn = ΔH ° f
Dado o exposto, temos que:
ΔH ° rxn = prodnprodutos Produtos Hproduativos H Reactivos
Dada a seguinte reação simulada
aA + bB cC
Onde a, b, c são os coeficientes da equação química balanceada.
A expressão para a entalpia da reação é:
Δ H ° rxn = c Δ H ° f C (um Δ H ° F a + b Δ H ° f B)
Supondo que: a = 2 mol, b = 1 mol ec = 2 mol.
AH ° f (A) = 300 KJ / mol, AH ° f (B) = -100 KJ / mol, AH ° f (C) = -30 KJ. Calcular Δ H ° rxn
Δ H ° rxn = 2mol (-30KJ / mol) – (2mol (300KJ / mol + 1mol (-100KJ / mol) = -60KJ – (600KJ – 100KJ) = -560KJ
Δ H ° rxn = -560KJ.
Corresponde então a uma reação exotérmica.
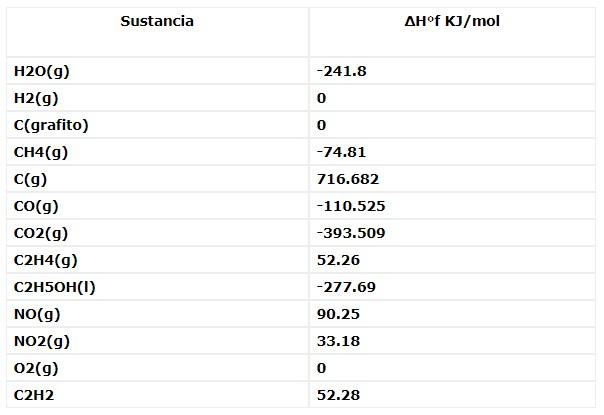
Valores de entalpia da formação de alguns compostos químicos orgânicos e inorgânicos a 25 ° C e 1 atm de pressão
Exercícios para calcular entalpia
Exercício 1
Encontre a entalpia da reação de NO2 (g) de acordo com a seguinte reação:
2NO (g) + O2 (g) 2NO2 (g)
Usando a equação para a entalpia de reação, você tem:
ΔH ° rxn = prodnprodutos Produtos Hproduativos H Reactivos
ΔH ° rxn = 2mol (ΔH ° f NO2) – (2mol ΔH ° f NO + 1mol ΔH ° f O2)
Na tabela da seção anterior, podemos ver que a entalpia de formação de oxigênio é 0 KJ / mol, porque o oxigênio é um composto puro.
ΔH ° rxn = 2mol (33,18KJ / mol) – (2mol 90,25 KJ / mol + 1mol 0)
ΔH ° rxn = -114,14 KJ
Outra maneira de calcular a entalpia da reação em um sistema químico é através da LEI DE HESS, proposta pelo químico suíço Germain Henri Hess em 1840.
A lei diz: “A energia absorvida ou emitida em um processo químico no qual os reagentes são convertidos em produtos é a mesma se for realizada em um estágio ou em vários”.
Exercício 2
A adição de hidrogênio ao acetileno para formar etano pode ser realizada em uma etapa:
C2H2 (g) + 2H2O (g) H3CCH3 (g) Δ H ° f = – 311,42 kJ / mol
Ou também pode ocorrer em duas etapas:
C2H2 (g) + H2 (g) H2C = CH2 (g) ΔH ° f = – 174,47 KJ / mol
H2C = CH 2 (g) + H2O (g) H3CCH3 (g) Δ H ° f = – 136,95 kJ / mol
Adicionando algebricamente as duas equações que temos:
C2H2 (g) + H2 (g) H2C = CH2 (g) ΔH ° f = – 174,47 KJ / mol
H2C = CH 2 (g) + H2O (g) H3CCH3 (g) Δ H ° f = – 136,95 kJ / mol
C2H2 (g) + 2H2 (g) H3CCH3 (g) ΔH ° rxn = 311,42 KJ / mol
Exercício 3
(Retirado de quimitube.com. Exercício 26. Termodinâmica da Lei de Hess)
Calcule a entalpia de oxidação do etanol, para fornecer ácido acético e água como produtos, sabendo que na combustão de 10 gramas de etanol são liberados 300 KJ de energia e na combustão de 10 gramas de ácido acético são liberados 140 KJ de energia.
Como você pode ver na declaração do problema, apenas os dados numéricos são exibidos, mas as reações químicas não aparecem. Portanto, é necessário escrevê-los.
CH 3 CH 2 OH (l) + 3O 2 (g) 2CO 2 (g) + 3 H 2 O (l) ÔH 1 = -1380 kJ / mol.
O valor da entalpia negativa é escrito porque o problema diz que há perda de energia. Considere também que existem 10 gramas de etanol, portanto você deve calcular a energia para cada mole de etanol. Para isso, é feito o seguinte:
Peso molar de etanol (soma dos pesos atômicos), valor igual a 46 g / mol.
ΔH1 = -300 KJ (46 g) etanol = – 1380 KJ / mol
10 g de etanol 1mol de etanol
O mesmo é feito para o ácido acético:
CH 3 COOH (l) + 2O 2 (g) 2CO 2 (g) + 2H 2 O (l) AH 2 = -840 kJ / mol
Δ H2 = -140 KJ (60 g de ácido acético) = – 840 KJ / mol
10 g de ácido acético 1 mol de ácido acético.
Nas reações anteriores são descritas as combustões de etanol e ácido acético, por isso é necessário escrever a fórmula do problema que é a oxidação do etanol em ácido acético com a produção de água.
Esta é a reação que pede o problema. Já está equilibrado.
CH 3 CH 2 OH (l) + O 2 (g) CH 3 COOH (l) + H 2 O (l) ÔH 3 =?
Aplicação da lei de Hess
Para fazer isso, multiplicamos as equações termodinâmicas por coeficiente numérico para torná-las algébricas e para organizar corretamente cada equação. Isso é feito quando um ou mais reagentes não estão no lado correspondente na equação.
A primeira equação permanece a mesma porque o etanol está do lado dos reagentes, conforme indicado pela equação do problema.
A segunda equação é necessária para multiplicá-lo pelo coeficiente -1, de modo que o ácido acético que é um reagente possa se tornar o produto
CH 3 CH 2 OH (l) + 3O 2 (g) 2CO 2 (g) + 3H2O (l) ÔH 1 = -1380 kJ / mol.
– CH 3 COOH (l) – 2O 2 (g) – 2CO 2 (g) – 2H 2 O (l) AH 2 = – (-840 kJ / mol)
CH 3 CH 3 OH + 3O 2 -2O 2 – CH 3 COOH 2CO 2 + 3H 2 O -2CO dois
-2H2O
Eles são adicionados algebricamente e este é o resultado: a equação solicitada no problema.
CH 3 CH 3 OH (l) + O 2 (g) CH 3 COOH (l) + H 2 O (l)
Determine a entalpia da reação.
Da mesma forma que cada reação foi multiplicada pelo coeficiente numérico, o valor das entalpias também deve ser multiplicado
ΔH3 = 1x ΔH1 -1xΔH2 = 1x (-1380) -1x (-840)
ΔH3 = -1380 + 840 = – 540 KJ / mol
ΔH3 = – 540 KJ / mol.
No exercício anterior, o etanol tem duas reações, combustão e oxidação.
Em qualquer reação de combustão, há formação de CO2 e H2O, enquanto na oxidação de um álcool primário, como o etanol, há formação de ácido acético
Referências
- Cedrón, Juan Carlos, Victoria Landa, Juana Robles (2011). Química Geral Material didático. Lima: Pontifícia Universidade Católica do Peru.
- Química Libretexts Termoquímica Retirado de hem.libretexts.org.
- Levine, I. Físico-Química. vol.2.