Existem vários gases menos conhecidos que não recebem tanta atenção quanto o oxigênio, o nitrogênio ou mesmo o dióxido de carbono. Um desses gases menos conhecidos é o criptônio, um gás nobre que faz parte da mesma família do hélio e do neon. Apesar de não ser tão comum, o criptônio possui algumas aplicações interessantes, como em lâmpadas de néon e em lasers de gás. Neste artigo, vamos explorar mais sobre o criptônio e outras curiosidades sobre os gases menos conhecidos.
Lista dos 7 gases nobres encontrados na tabela periódica dos elementos químicos.
Os gases nobres são um grupo de elementos químicos da tabela periódica que possuem propriedades químicas e físicas muito estáveis. Existem 7 gases nobres: hélio, neônio, argônio, criptônio, xenônio, radônio e oganesson.
Entre esses gases nobres, o oganesson é o menos conhecido. Descoberto em 2002, ele é um elemento extremamente raro na natureza e é produzido artificialmente em laboratórios. O oganesson é um gás nobre extremamente instável e altamente radioativo, o que o torna difícil de estudar e compreender completamente.
Apesar de ser o menos conhecido, o oganesson é um elemento fascinante para os cientistas, que continuam a explorar suas propriedades e possíveis aplicações na ciência e na tecnologia.
Quais são os diferentes tipos de gás que existem?
Existem vários tipos de gás que podem ser encontrados na natureza e em ambientes industriais. Os principais tipos de gás incluem o gás natural, o gás oxigênio, o gás carbônico, o gás hélio e o gás nitrogênio. Cada um desses gases possui propriedades únicas e é utilizado para diferentes fins.
Qual é o gás menos conhecido?
Entre os diferentes tipos de gás, um dos menos conhecidos é o gás xenônio. O xenônio é um gás nobre, incolor, inodoro e insípido. Ele é encontrado em pequenas quantidades na atmosfera terrestre e é frequentemente utilizado em lâmpadas de flash, equipamentos de análise de gases e em aplicações médicas.
Apesar de ser menos conhecido do que outros gases mais comuns, o xenônio possui propriedades interessantes que o tornam útil em diversas aplicações. Sua capacidade de emitir luz quando submetido a uma descarga elétrica, por exemplo, o torna ideal para uso em lâmpadas de flash de alta intensidade.
Em resumo, os diferentes tipos de gás oferecem uma variedade de usos e aplicações, sendo o xenônio um dos menos conhecidos, mas nem por isso menos importante.
O gás Neônio: entenda suas características e aplicações na indústria e tecnologia.
O gás Neônio é um dos menos conhecidos, mas possui diversas características interessantes que o tornam útil em diferentes aplicações na indústria e tecnologia. Com um ponto de ebulição de -246,1°C e um ponto de fusão de -248,6°C, o Neônio é um gás nobre de cor avermelhada quando submetido a uma descarga elétrica.
Uma das principais características do Neônio é sua capacidade de emitir luz brilhante quando submetido a uma corrente elétrica. Por esse motivo, o gás é amplamente utilizado em lâmpadas de neon para publicidade e sinalização. Além disso, o Neônio também é utilizado em laseres de alta potência, em dispositivos de iluminação e em telas de televisão.
Na indústria, o Neônio é utilizado em processos de soldagem a gás para proteger o material de soldagem da oxidação. Além disso, o gás é utilizado em análises químicas e em equipamentos de ressonância magnética. Sua estabilidade e inércia química também fazem com que seja um excelente gás para preencher lâmpadas de descarga.
Apesar de não ser tão conhecido quanto outros gases nobres, o Neônio desempenha um papel fundamental em diversas aplicações industriais e tecnológicas. Sua capacidade de emitir luz brilhante e sua estabilidade química o tornam um recurso valioso em diferentes setores.
A formação dos gases nobres: de onde vem esse grupo tão especial de elementos.
Os gases nobres são um grupo especial de elementos que possuem características únicas. Eles são conhecidos por serem extremamente estáveis e não reativos, o que os torna muito diferentes dos outros elementos da tabela periódica. Mas de onde vem essa característica tão especial?
Os gases nobres são formados principalmente através de processos de fusão nuclear nas estrelas. Durante esses processos, elementos mais leves se fundem para formar elementos mais pesados, incluindo os gases nobres. Os gases nobres são produzidos em quantidades muito pequenas em comparação com outros elementos, o que os torna ainda mais especiais.
Além disso, os gases nobres são encontrados na atmosfera terrestre em pequenas quantidades. Eles são liberados durante processos geológicos, como a atividade vulcânica, e também são produzidos artificialmente em laboratórios. O hélio, por exemplo, é o gás menos conhecido e é frequentemente encontrado em reservatórios naturais de gás.
Em resumo, os gases nobres são elementos únicos que são formados principalmente em estrelas através de processos de fusão nuclear. Eles são extremamente estáveis e não reativos, o que os torna muito especiais e diferentes dos outros elementos da tabela periódica.
Qual é o gás menos conhecido?
Qual é o gás menos conhecido? A resposta dependerá da experiência geral que a pessoa tiver com os gases; no entanto, ao fazer pesquisas, ela conhecerá o gás, juntamente com suas propriedades e usos, para que esse gás deixe de ser desconhecido.
Tentando responder à pergunta de outra perspectiva, pode-se dizer que o gás menos conhecido seria aquele que sabe menos, o mais enigmático, o “novo”, o recém-chegado que ninguém ainda tem a alegria de conhecer.

Na química, novos compostos e moléculas são sintetizados todos os dias, suas propriedades, sua espectroscopia são obtidas e, na pior das hipóteses, quando não há dados experimentais, são feitos cálculos computacionais usando métodos quânticos para obter conhecimento desses materiais.
No entanto, um gás se destaca entre esses novos compostos desconhecidos, um gás relativamente recentemente descoberto, do qual ainda não se sabe muito. Esse gás é o oganesson.
Oganesson (Og) é um elemento transuran que ocupa a posição 118 na tabela periódica. É o elemento mais pesado, com o maior número atômico e é um dos gases nobres.
Ununonoctium velho, o gás menos conhecido?
Anteriormente, os elementos transurânicos (que continuam a urânio) de número atômico igual ou superior a 112 não tinham nomes e eram nomeados, segundo a IUPAC, por esses números em latim.
Assim, o elemento do número atômico 112 foi chamado de unúnio e seu símbolo era uub, o de z = 113 foi chamado de unúnio (uut), o de 114 ununúncio (uuq) e assim por diante.
No caso do elemento que correspondia ao grupo de gases nobres, cujo número atômico era 118, era conhecido pelo nome ununoctium e seu símbolo era uuo.
Note-se que nenhum desses elementos é encontrado na natureza. Eles devem ser sintetizados em laboratório usando reatores nucleares.
À medida que a tecnologia e a ciência progrediram, esses elementos pesados foram sintetizados e caracterizados pelo fato de a IUPAC (União Internacional de Química Pura e Aplicada) nomear oficialmente os elementos descobertos.
Assim, o ununbio se tornou o copernicium em homenagem a Nicholas Copernicus com o símbolo Cn, o ununtercium se tornou o nihonio desde que o elemento foi descoberto no Japão (cujo nome em japonês é Nihon).
Em novembro de 2016, a União Internacional de Química Pura e Aplicada (IUPAC) aprovou o nome de oganesson para o elemento 118 (IUPAC, 2016).
Origem do Nome
Pesquisadores do Joint Nuclear Research Institute, em Dubna (Rússia) e do Lawrence Livermore National Laboratory (LLNL), Califórnia, criaram o elemento 118, oganesson, em 2002.
A reação foi uma fusão do elemento 20 com o elemento 98: cálcio-48 com californio-249.
Íons de cálcio formados em um feixe, em um ciclotrão (um acelerador de partículas) e disparados em uma camada alvo de óxido de califórnio depositado em papel de titânio.
O bombardeio durou 2300 horas, acumulando uma dose total de 2,5 x 1019 íons de cálcio.
Em março de 2002, foram produzidos dois átomos de oganesson-294, que existiam por 2,55 ms e 3,16 ms.
Outras experiências e análises confirmaram posteriormente esse resultado e a descoberta foi verificada pela União Internacional de Química Pura e Aplicada (IUPAC) em 2015.
O relatório declarou: “A afirmação da colaboração de Dubna-Livermore 2006 para a descoberta do elemento com o número atômico Z = 118 é reconhecida como válida”.
Como resultado de sua posição na tabela periódica de oganesson, espera-se que seja classificado como um gás nobre (Tabela periódica de Chemicool, 2016).
O nome oganesson homenageia Yuri Oganessian “por suas contribuições pioneiras à investigação de elementos transactinídeos”, disseram autoridades da IUPAC, referindo-se a elementos com números atômicos de 104 a 120.
“Suas muitas realizações incluem a descoberta de elementos super-pesados e avanços significativos na física nuclear de núcleos super-pesados, incluindo evidências experimentais da” ilha da estabilidade “, uma idéia que sugere que os elementos super-pesados podem se tornar estáveis em algum momento no tempo. sua existência (Sharp, 2016).
Propriedades
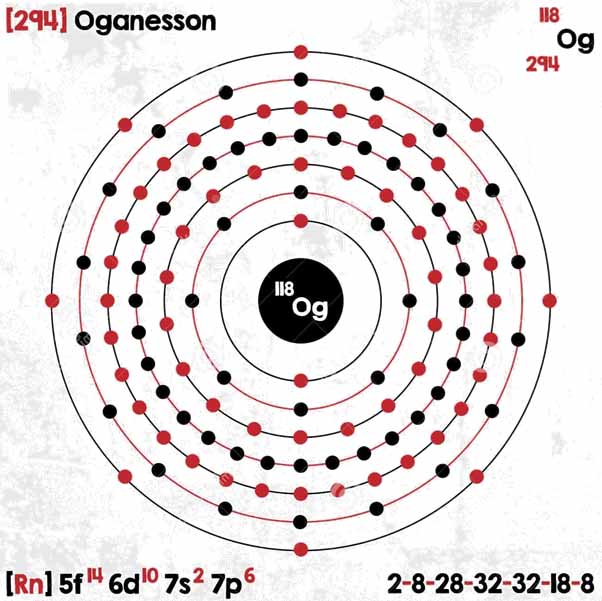
Oganesson tem um isótopo conhecido, 294Og, com uma meia-vida de aproximadamente 0,89 milissegundos. Por decaimento alfa, torna-se 290Lv (fígado-290). Sendo seu número atômico Z = 118, pertence ao décimo oitavo grupo e ao sétimo período da tabela periódica, no grupo de gases nobres logo abaixo do rádon.
O peso atômico dos elementos transurânicos artificiais é baseado no isótopo de maior duração. No caso do oganesson, isso seria 294 g / mol.
Esses pesos atômicos devem ser considerados provisórios, pois um novo isótopo com meia-vida mais longa pode ocorrer no futuro (Mark Winter [Universidade de Sheffield e WebElements Ltd, Reino Unido], 2017).
As propriedades físicas ou químicas do elemento não podem ser determinadas diretamente, uma vez que apenas alguns átomos de oganesão foram produzidos, mas é provável que o gás seja um gás à temperatura ambiente. Espera-se que a química de Oganesson, como o radônio, reflita suas propriedades metalóides antecipadas (Schrobilgen, 2016).
Algumas propriedades do oganesson foram calculadas descobrindo que ele tem uma densidade entre 4,9 e 5,1 g / ml, uma entalpia de fusão de 23,5 kJ / mol e uma entalpia de vaporização de 19,4 kJ / mol. Sua configuração eletrônica é [Rn] 5f14 6d10 7s2 7p6, sendo considerada um elemento central super pesado (Gagnon., SF).
Um fato interessante é que, embora se espere que o composto seja um gás, foram encontrados dados teóricos que prevêem que o composto pode ser um sólido à temperatura ambiente. Sendo o oganesson um elemento do grupo 18, seria um paradoxo ter um “gás sólido nobre” (Royal Society of Chemistry, 2016).
Espera-se que a química do oganesson seja semelhante ao radônio e ao xenônio. Assim, seria radioativo e seria considerado um elemento perigoso (Mark Winter [Universidade de Sheffield e WebElements Ltd, Reino Unido], 2017).
Como só foi possível sintetizar pouquíssimas quantidades do elemento e sua meia-vida é tão curta, ainda não há uso prático para o Oganesson e ele só tem interesse em pesquisa.
Referências
- Tabela periódica de Chemicool. (16 de junho de 2016). Fatos dos elementos Oganesson / Ununoctium. Recuperado do chemicool.
- , S. (SF). É Elementar O Elemento Oganesson. Recuperado de education.jlab.org.
- (8 de junho de 2016). A IUPAC está nomeando os quatro novos elementos NIHONIUM, MOSCOVIUM, TENNESSINE E OGANESSON. Recuperado de iupac.org.
- Mark Winter [Universidade de Sheffield e WebElements Ltd, Reino Unido]. (9 de maio de 2017). Oganesson: reações de elementos. Recuperado de elementos da web.
- Mark Winter [Universidade de Sheffield e WebElements Ltd, Reino Unido]. (9 de maio de 2017). Oganesson: o essencial. Recuperado de elementos da web.
- Sociedade Real de Química. (2016). Oganesson Recuperado do rsc.org.
- Schrobilgen, GJ (2016, 12 de dezembro). Oganesson (Og). Recuperado de britannica.com.
- Sharp, T. (2016, 1 de dezembro). Fatos sobre Oganesson (elemento 118). Recuperado de livescience.com.