O sulfato de alumínio (Al2(SO4)3) é um composto químico amplamente utilizado em diversas aplicações industriais e tratamentos de água. Sua estrutura molecular consiste em dois átomos de alumínio ligados a três íons de sulfato. Este composto é comumente utilizado como coagulante em processos de tratamento de água, ajudando a remover impurezas e partículas em suspensão. No entanto, o sulfato de alumínio também é conhecido por sua toxicidade em altas concentrações, podendo causar irritação na pele, olhos e vias respiratórias. Portanto, é importante manusear e utilizar este composto com cuidado e seguindo as devidas precauções de segurança.
Possíveis efeitos do sulfato de alumínio na saúde humana e no meio ambiente.
O sulfato de alumínio (Al2(SO4)3) é um composto químico amplamente utilizado em diversas aplicações, como no tratamento de água, na indústria de papel e na fabricação de produtos cosméticos. No entanto, é importante estar ciente dos possíveis efeitos que esse composto pode ter na saúde humana e no meio ambiente.
Em relação à saúde humana, a exposição ao sulfato de alumínio pode causar irritação na pele e nos olhos, bem como problemas respiratórios se inalado. Além disso, estudos indicam que a exposição prolongada a altas concentrações de alumínio pode estar relacionada a doenças neurodegenerativas, como Alzheimer. Portanto, é essencial tomar precauções ao lidar com esse composto e garantir a sua utilização segura.
No meio ambiente, o sulfato de alumínio pode ter um impacto negativo, principalmente em corpos d’água. Quando utilizado no tratamento de água, resíduos de alumínio podem ser liberados no ambiente, afetando a vida aquática e causando desequilíbrios nos ecossistemas. Além disso, o uso excessivo de sulfato de alumínio pode contribuir para a acidificação do solo e da água, prejudicando a biodiversidade.
Em suma, é fundamental estar ciente dos possíveis efeitos do sulfato de alumínio na saúde humana e no meio ambiente, adotando medidas adequadas para minimizar os riscos associados a sua utilização. A conscientização sobre os impactos desse composto e a busca por alternativas mais seguras são essenciais para preservar a saúde e o equilíbrio ambiental.
Aplicações e usos do sulfato de alumínio na indústria e tratamento de água.
O sulfato de alumínio (Al2(SO4)3) é um composto químico amplamente utilizado na indústria e no tratamento de água devido às suas propriedades únicas. Sua estrutura molecular consiste em dois átomos de alumínio ligados a três grupos de sulfato.
Uma das principais aplicações do sulfato de alumínio na indústria é como coagulante em processos de tratamento de água e efluentes. Ele é adicionado à água para ajudar na remoção de partículas em suspensão, como argila, matéria orgânica e microorganismos. O sulfato de alumínio forma flocos que aglutinam as impurezas, facilitando sua remoção por filtração ou decantação.
Além disso, o sulfato de alumínio é utilizado na indústria de papel e celulose como agente clarificante, ajudando a melhorar a qualidade do papel produzido. Ele também é empregado na fabricação de produtos químicos, como pigmentos, corantes e produtos farmacêuticos.
No tratamento de água, o sulfato de alumínio desempenha um papel fundamental na purificação da água potável. Ele auxilia na remoção de impurezas, como metais pesados, matéria orgânica e microorganismos, garantindo a qualidade da água consumida pela população.
Embora o sulfato de alumínio seja amplamente utilizado, é importante ressaltar que seu uso em excesso pode causar problemas de toxicidade. O consumo de água contaminada com altas concentrações de sulfato de alumínio pode levar a problemas de saúde, como danos ao sistema nervoso e gastrointestinal.
Em resumo, o sulfato de alumínio é um composto químico versátil com diversas aplicações na indústria e no tratamento de água. Seu uso adequado e controlado é fundamental para garantir a eficácia de processos de purificação de água e evitar riscos à saúde humana.
Os motivos para evitar o uso do sulfato de alumínio na água potável.
O sulfato de alumínio (Al2 (SO4) 3) é um composto químico amplamente utilizado como coagulante no tratamento de água potável. Sua estrutura molecular consiste em dois átomos de alumínio ligados a três grupos de sulfato. Este composto é eficaz na remoção de partículas em suspensão na água, tornando-a mais limpa e segura para o consumo humano.
No entanto, apesar de sua eficácia no tratamento da água, o sulfato de alumínio apresenta potenciais riscos à saúde humana. Estudos têm demonstrado que a presença de alumínio na água potável pode estar relacionada a problemas de saúde, como doenças neurodegenerativas e distúrbios gastrointestinal. Além disso, o consumo prolongado de água contendo altas concentrações de alumínio pode levar a danos no fígado e nos rins.
Por esse motivo, é recomendável evitar o uso de sulfato de alumínio na água potável sempre que possível. Existem alternativas mais seguras e menos tóxicas para o tratamento da água, como o uso de coagulantes orgânicos ou processos de filtração avançada. É importante priorizar a saúde e o bem-estar da população, garantindo o acesso a água potável de qualidade, livre de substâncias prejudiciais à saúde.
Em resumo, o uso do sulfato de alumínio na água potável deve ser evitado devido aos potenciais riscos à saúde humana associados à presença de alumínio na água. É fundamental buscar alternativas mais seguras e eficazes para o tratamento da água, visando garantir a qualidade e a segurança do abastecimento de água potável para a população.
Al2SO43: entenda qual é a composição desse composto químico de alumínio e enxofre.
O Sulfato de alumínio (Al2(SO4)3) é um composto químico formado por dois átomos de alumínio e três grupos de sulfato. Sua composição molecular é representada pela fórmula Al2(SO4)3. Esse composto apresenta uma estrutura cristalina e é geralmente encontrado na forma de pó branco ou cristais incolores.
O Sulfato de alumínio é amplamente utilizado em processos de tratamento de água, sendo empregado como coagulante para remover impurezas e partículas em suspensão. Além disso, é utilizado na indústria de papel e celulose, na fabricação de produtos químicos e na produção de pigmentos.
Apesar de sua importância em diversos setores, o Sulfato de alumínio pode ser tóxico em altas concentrações. O contato prolongado ou a inalação de seus vapores podem causar irritações na pele, olhos e vias respiratórias. Por isso, é importante manuseá-lo com cuidado e seguir as orientações de segurança adequadas.
Sulfato de alumínio (Al2 (SO4) 3): estrutura, usos, toxicidade
O sulfato de alumínio é um sal inorgânico de alumínio de fórmula geral Al 2 (SO 4 ) 3, normalmente visto como um brilhantes cristais sólidos brancos. A cor do composto será influenciada por sua concentração de ferro e qualquer outra impureza. Existem dois tipos principais de sulfato de alumínio: A e B.
A imagem abaixo mostra cristais brancos de sulfato de alumínio hidratado. Pode-se notar a ausência de coloração marrom, indicativa de íons de ferro na rede cristalina.

O sulfato de alumínio é um sal muito solúvel em água e, na natureza, é raro encontrá-lo em sua forma anidra. Geralmente ele é hidratado sob a forma de octadeca-hidrato de sulfato de alumínio [Al 2 (SO 4 ) 3 .18H 2 O] ou hexadecahidratado [Al 2 (SO 4 ) 3 .16H 2 O].
Também pode formar sais duplos com potássio e amônio, compostos conhecidos como alums. Em parte, isso pode ser devido à afinidade da água dentro dos hidratos para reter outros íons além do alumínio.
O sulfato de alumínio pode ser decomposto pela ação da água no hidróxido de alumínio e no ácido sulfúrico . Esta propriedade permitiu seu uso como um acidificador do solo.
Também é um composto tóxico, principalmente por contato com a poeira. No entanto, possui um número infinito de usos e aplicações que vão desde a purificação da água através do método de coagulação, passando pelo uso em várias indústrias, até o uso para fins terapêuticos.
Estrutura
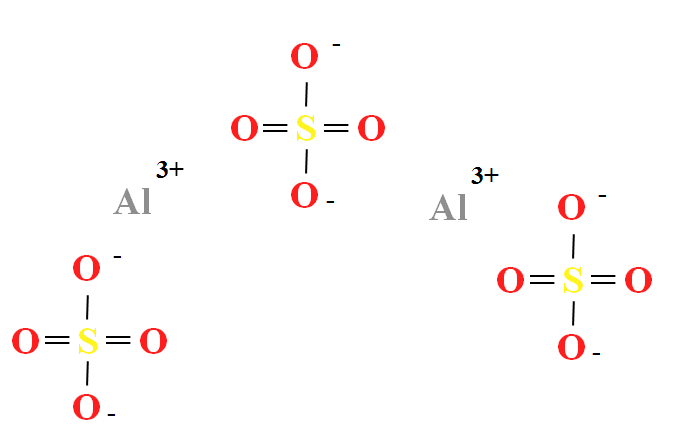
O sulfato de alumínio tem uma razão de dois cátions Al 3+ para cada três ânions SO 4 2- (imagem superior), o que pode ser observado diretamente em sua fórmula química Al 2 (SO 4 ) 3 .
Note-se que o Al 3+ são acinzentado, enquanto SO 4 2- estão amarelo (por um átomo de enxofre) e vermelho (por átomos de oxigénio).
A estrutura ilustrada corresponde à forma anidra de Al 2 (SO 4 ) 3 , uma vez que nenhuma molécula de água interage com íons. Em seus hidratos, no entanto, a água pode ser atraída pelos centros positivos de Al 3+ ou pelos tetraedros negativos de SO 4 2- pelas ligações de hidrogênio (HOH-O-SO 3 2- ).
Al 2 (SO 4 ) 3 ∙ 18H 2 O, por exemplo, contendo 18 moléculas de água na estrutura do sólido. Alguns deles podem estar em contato direto com Al 3+ ou SO 4 2- . Em outras palavras: o sulfato de alumínio pode ter água de coordenação interna ou externa.
Além disso, sua estrutura pode abrigar outros cátions, como Fe 3+ , Na + , K + , etc. Mas, para isso, é necessária a presença de mais ânions SO 4 2- . Para que? Neutralizar o aumento de cargas positivas devido a impurezas metálicas.
O sulfato de alumínio pode ter muitas estruturas, embora seus hidratos tendam a adotar o sistema cristalino monoclínico.
Propriedades físicas e químicas
Aparência
Ele vem como um sólido com cristais brancos brilhantes, grânulos ou pó.
Peso molecular
342,31 g / mol (anidro).
Cheiro
É inodoro
Sabor
Gosto doce adstringente médio.
Ponto de fusão
Forma anidra a 770 ° C (forma octadeca-hidratada a 86,5 ° C)
Solubilidade em água
31,2 g / 100 ml a 0 ° C; 36,4 g / 100 ml a 20 ° C e 89 g / 100 ml a 100 ° C.
Densidade
De 2,67 a 2,71 g / cm 3 .
Solubilidade
Ligeiramente solúvel em álcool etílico.
Pressão de vapor
Essencialmente zero.
Estabilidade
Estável no ar.
Decomposição
Quando aquecido, aproximadamente ao seu ponto de fusão, pode ser decomposto emitindo especialmente óxido de enxofre, um gás tóxico.
Corrosividade
As soluções de sulfato de alumínio são corrosivas para o alumínio. O composto também pode corroer metais na presença de umidade.
pKa
3.3 a 3.6. E seu pH é 2,9 ou mais em uma solução aquosa a 5%.
Para que serve (usos)
Coagulação ou floculação de água
– Quando misturado com água (potável, servida ou residual), o sulfato de alumínio causa hidróxido de alumínio, que forma complexos com os compostos e partículas em solução, acelerando a sedimentação, que na ausência de tratamento com sulfato de alumínio Levaria muito tempo.
-Sulfato de alumínio também é usado na limpeza da água da piscina, tornando-os mais atraentes para o uso.
-Com o uso de sulfato de alumínio, é obtida água sem turbidez e cor, aumentando sua capacidade de beber, facilitando a limpeza da água. Infelizmente, este método de purificação pode levar a uma concentração ligeiramente aumentada de alumínio na água.
-O alumínio é um metal muito tóxico que se acumula na pele, cérebro e pulmões, causando distúrbios graves. Além disso, não se sabe qual o papel que desempenha nos seres vivos .
-A União Europeia exige que o limite máximo permitido de alumínio na água não exceda 0,2 mg / l. Enquanto isso, a Agência de Proteção Ambiental dos EUA exige que o limite máximo de contaminação da água com alumínio não exceda 0,05-0,2 mg / l.
-O tratamento da água utilizada ou servida com sulfato de alumínio permite a eliminação ou redução de fósforo, economicamente.
Use como mordente de tintas e na fabricação de papel
-O sulfato de alumínio tem sido usado como mordente de corantes ou tintas, ajudando a fixar-se no material a ser tingido. Sua ação de fixação é devida ao Al (OH) 3 , cuja consistência gelatinosa colabora com a adsorção de corantes nos têxteis.
-Embora tenha sido utilizado desde aproximadamente 2000 aC, para os fins descritos, apenas os corantes orgânicos requerem mordentes. Os corantes sintéticos, por outro lado, não requerem mordentes para cumprir sua função.
– Foi deslocado da fabricação de papel, mas ainda é usado na produção de celulose. Ele remove suas impurezas, além de ter sido usado para prender materiais, neutralizar cargas e calibrar resina.
Usos industriais
-É utilizado na indústria da construção, a fim de acelerar a fixação do concreto. Além disso, é usado na construção de impermeabilizações.
-Na indústria de sabão e graxa, é usado na produção de glicerina.
-É usado na indústria de petróleo na produção de catalisadores sintéticos que eles usam durante a operação.
-É utilizado na indústria farmacêutica como adstringente na preparação de medicamentos e cosméticos.
-Está envolvido na preparação de corantes como o carmim. Também é usado como corante na fabricação de borrachas sintéticas de estireno butadieno.
-Na indústria de transformação de açúcar, é usado como um purificador de melaço de cana.
-É utilizado na fabricação de desodorantes. Porque Porque causa um estreitamento dos ductos das glândulas sudoríparas, limitando assim o acúmulo de suor, um meio necessário para o crescimento das bactérias que causam o mau cheiro.
-É utilizado no curtimento de couro, processo necessário para o seu uso. Além disso, é utilizado na fabricação de fertilizantes.
-É utilizado como aditivo na preparação de tintas, adesivos e selantes, além de produtos de limpeza e manutenção de móveis.
Utilizações medicinais e terapêuticas
O sulfato de alumínio é um adjuvante imunológico. Portanto, cumpre a função de processar os antígenos de forma que, quando liberados em seu local de ação, produzam maior produção de anticorpos contra os antígenos que foram inoculados.
-O adjuvante Freund e BCG, bem como os outros adjuvantes, incluindo endógenos como interleucinas, são inespecíficos para os antígenos, permitindo um aumento no raio da ação imune.Isso permitiu o desenvolvimento de vacinas contra inúmeras doenças.
-A ação coagulante do sulfato de alumínio permitiu a eliminação de inúmeros vírus na água tratada, entre outros: Q beta, MS2, T4 e P1. Os resultados indicam que o tratamento da água com sulfato de alumínio causa a inativação de tais vírus.
-O sulfato de alumínio é usado como um bastão ou pó no tratamento de pequenas feridas superficiais ou abrasões causadas pelo barbear.
-É usado na fabricação de acetato de alumínio, um composto usado no tratamento de algumas condições do ouvido. Também foi utilizado, sem sucesso significativo, para aliviar as conseqüências das picadas de formigas.
– Soluções de sulfato de alumínio são utilizadas, na concentração de 5% a 10%, no tratamento local de úlceras que permitem o controle de suas secreções.
-A ação adstringente do sulfato de alumínio contrai as camadas superficiais da pele, coagulando proteínas e curando feridas.
Outros usos
-Sulfato de alumínio ajuda no controle do crescimento excessivo de algas em lagoas, lagos e correntes de água. Também é utilizado na eliminação de moluscos, entre outros a lesma espanhola.
-Jardineiros aplicam este composto para acidificar solos alcalinos. Em contato com a água, o sulfato de alumínio é decomposto em hidróxido de alumínio e ácido sulfúrico diluído. Então, o hidróxido de alumínio precipita, permanecendo o ácido sulfúrico em solução.
-A acidificação dos solos devido ao ácido sulfúrico é visualizada de maneira muito criativa, devido à existência de uma planta chamada Hortênsia, cujas flores ficam azuis na presença de um solo ácido; isto é, são sensíveis e respondem a mudanças no pH.
-O sulfato de alumínio está envolvido no desenvolvimento de uma espuma para combater e controlar o fogo. Como Reage com o bicarbonato de sódio, produzindo a liberação de CO 2 .Esse gás bloqueia o acesso de O 2 ao local de combustão do material; e conseqüentemente o cessar-fogo que estava se desenvolvendo.
Produção de sulfato de alumínio
O sulfato de alumínio é sintetizado pela reação de um composto rico em alumínio, como a bauxita mineral, com ácido sulfúrico a temperaturas elevadas. A seguinte equação química representa a reação:
Al 2 O 3 + H 2 SO 4 -> Al 2 (SO 4 ) 3 + 3 H 2 O
O sulfato de alumínio também pode ser formado por uma reação de neutralização entre o hidróxido de alumínio e o ácido sulfúrico, de acordo com a seguinte reação:
2 Al (OH) 3 + 3 H 2 SO 4 + 12 H 2 O —> Al 2 (SO 4 ) 3 .18H 2 O
O ácido sulfúrico reage com o alumínio para formar sulfato de amônio e a liberação de moléculas de hidrogênio na forma de gás. A reação é esquematizada da seguinte forma:
2 Al + 3 H 2 SO 4 ———– Al 2 (SO 4 ) 3 + 3 H 2
Tipos
O sulfato de alumínio é classificado em dois tipos: tipo A e tipo B. No sulfato de alumínio tipo A, os sólidos são brancos e têm uma concentração de ferro inferior a 0,5%.
No sulfato de alumínio tipo B, os sólidos são marrons e têm uma concentração de ferro menor que 1,5%.
Existem indústrias que produzem sulfato de alumínio que possuem critérios diferentes para classificação.Assim, uma indústria reporta para a preparação do sulfato de alumínio tipo A uma concentração máxima de 0,1% de ferro como óxido férrico. Enquanto que para o tipo B, eles indicam uma concentração máxima de ferro de 0,35%.
Toxicidade
-O sulfato de alumínio é um composto que exerce sua ação tóxica através do contato com a poeira, causando irritação na pele e, nos casos em que o contato é frequente, dermatite.
– Nos olhos, causa uma forte irritação, causando até lesões permanentes.
-Sua inalação causa irritação no nariz e na garganta, o que pode causar tosse e garganta.
-Sua ingestão causa irritação gástrica, náusea e vômito.
-Existem efeitos tóxicos que, embora não sejam diretamente causados pelo sulfato de alumínio, são indiretamente devidos ao seu uso. É o caso de certos efeitos tóxicos do alumínio, causados pelo uso de sulfato de alumínio na purificação da água.
-Os pacientes que são dialisados cronicamente usando sais preparados em água purificada, através do uso de sulfato de alumínio, apresentam distúrbios de saúde muito graves. Entre esses distúrbios, temos anemia, demência em diálise e aumento de doenças ósseas.
Referências
- Wikipedia (2018). Sulfato de alumínio Retirado de: en.wikipedia.org
- Aris Industrial Solução de sulfato de alumínio tipo A e B. Retirado de: aris.com.pe
- Christopher Boyd (9 de junho de 2014). Principais usos industriais do sulfato de alumínio. Retirado de: chemservice.com
- PubChem (2018). Sulfato de Alumínio Anidro. Retirado de: pubchem.ncbi.nlm.nih.gov
- Andesia Chemicals. (20 de agosto de 2009). Folha de segurança de sulfato de alumínio. [PDF]. Retirado de: andesia.com
- Livro químico (2017). Sulfato de Alumínio Retirado de: chemicalbook.com