O sulfato de ferro (FeSO4) é um composto químico formado pela combinação de íons de ferro (Fe2+) e íons sulfato (SO4 2-). Possui uma estrutura cristalina e é frequentemente utilizado em diversas aplicações industriais e na agricultura. Suas propriedades incluem ser um sólido cristalino de coloração verde ou azul, solúvel em água e apresentar propriedades oxidantes e redutoras.
A síntese do sulfato de ferro pode ser realizada através da reação entre óxido de ferro(III) e ácido sulfúrico, ou pela oxidação do ferro metálico em ácido sulfúrico. Este composto é amplamente utilizado na indústria de pigmentos, na produção de fertilizantes, na fabricação de produtos químicos e na medicina, sendo um composto versátil e de grande importância para diversos setores.
Composição química do sulfato de ferro: o que é e como é formado.
A composição química do sulfato de ferro, representado pela fórmula FeSO4, é composta por ferro (Fe), enxofre (S) e oxigênio (O). Este composto é formado pela reação entre o ácido sulfúrico (H2SO4) e o metal ferroso (Fe), resultando no sulfato de ferro.
O sulfato de ferro é um composto inorgânico que possui diversas aplicações industriais, como na fabricação de fertilizantes, na indústria química e na medicina. Sua estrutura cristalina é composta por íons de ferro (Fe2+) e íons sulfato (SO42-), que se organizam em uma rede cristalina.
Entre as propriedades do sulfato de ferro, destacam-se sua coloração esverdeada, sua solubilidade em água e sua capacidade de reagir com outras substâncias químicas. Além disso, o sulfato de ferro é um composto tóxico se ingerido em grandes quantidades, portanto deve ser manuseado com cuidado.
A síntese do sulfato de ferro pode ser realizada em laboratório, por meio da reação entre o ácido sulfúrico e o metal ferroso, seguindo as proporções corretas para a formação do composto desejado. Este processo requer conhecimento em química e cuidados com a manipulação de substâncias químicas.
Características fundamentais do ferro: principais propriedades e usos na indústria e na natureza.
O ferro é um elemento químico de grande importância na indústria e na natureza. Sua principal característica é a sua alta resistência mecânica, o que o torna um material muito utilizado na construção civil e na fabricação de máquinas e equipamentos. Além disso, o ferro é um metal maleável e dúctil, o que facilita sua transformação em diferentes formas e estruturas.
Na natureza, o ferro é encontrado principalmente sob a forma de minérios, como a hematita e a magnetita. Esses minérios são amplamente explorados na indústria siderúrgica, onde o ferro é extraído e purificado para a produção de aço, um dos materiais mais utilizados em todo o mundo.
Além disso, o ferro também desempenha um papel fundamental em processos biológicos, sendo essencial para a formação de hemoglobina, a proteína responsável pelo transporte de oxigênio no sangue.
Sulfato de ferro (FeSO4): estrutura, propriedades, síntese.
O sulfato de ferro é um composto químico formado pela combinação do ferro com o ácido sulfúrico. Sua estrutura molecular é representada pela fórmula FeSO4, e apresenta-se na forma de um sólido cristalino de cor esverdeada.
Entre as principais propriedades do sulfato de ferro, destacam-se sua solubilidade em água e sua capacidade de oxidar outras substâncias. Essas características fazem com que o sulfato de ferro seja amplamente utilizado na indústria química, na agricultura e no tratamento de águas e efluentes.
A síntese do sulfato de ferro pode ser realizada a partir da reação entre o ferro metálico e o ácido sulfúrico, ou através da oxidação do sulfeto de ferro. Esse processo de produção permite a obtenção de sulfato de ferro em diferentes concentrações e formas, de acordo com as necessidades específicas de cada aplicação.
Processo de fabricação do sulfato de ferro: descubra como é produzido este composto químico.
O sulfato de ferro (FeSO4) é um composto químico amplamente utilizado em diversas aplicações industriais e agrícolas. Ele é produzido por meio de um processo de síntese que envolve a reação entre o ácido sulfúrico (H2SO4) e o ferro metálico (Fe).
Para fabricar o sulfato de ferro, primeiro é necessário dissolver o ferro metálico em ácido sulfúrico concentrado. Essa reação gera calor e libera gás hidrogênio (H2). O resultado é a formação do sulfato de ferro e água.
O processo de fabricação do sulfato de ferro pode ser realizado em escala industrial, utilizando equipamentos específicos para garantir a segurança e eficiência da reação química. Após a formação do composto, ele pode ser separado e purificado por meio de técnicas de cristalização e filtração.
O sulfato de ferro é conhecido por suas propriedades oxidantes e redutoras, sendo utilizado em aplicações como fertilizantes, tratamento de água e em processos industriais. Além disso, ele também é empregado na medicina, especialmente como suplemento de ferro para o tratamento de anemias.
Qual é a presença de óxidos de nitrogênio no sulfato ferroso?
Os óxidos de nitrogênio podem estar presentes no sulfato ferroso devido à sua interação com o ambiente. Esses compostos podem ser formados durante a síntese do sulfato ferroso ou através da interação do composto com agentes oxidantes presentes no ar ou na água.
Os óxidos de nitrogênio, como o dióxido de nitrogênio (NO2), podem reagir com o sulfato ferroso, formando nitrito de ferro e liberando óxido nítrico. Essa reação pode ocorrer em condições específicas de pH e temperatura, resultando na presença de óxidos de nitrogênio no composto.
É importante ressaltar que a presença de óxidos de nitrogênio no sulfato ferroso pode afetar suas propriedades e aplicação em diferentes processos industriais. Portanto, é essencial controlar as condições de síntese e armazenamento do composto para evitar a formação indesejada desses compostos.
Sulfato de ferro (FeSO4): estrutura, propriedades, síntese
O sulfato de ferro é um sal inorgânico que tem a fórmula química de FeSO 4 . Consiste em um sólido cristalino de cor variável, obtido industrialmente como produto secundário do processamento de aço.
É encontrado na natureza sob diferentes formas, sendo o mais comum o sulfato ferroso hepta-hidratado, FeSO 4 · 7H 2 O (“vitriol verde”, presente no mineral melenterita). Este hidrato é facilmente distinguido pela cor azul esverdeado de seus cristais (imagem inferior). Outros hidratos geralmente têm FeSO 4 · xH 2 O, onde x varia de 1 a 7.

O sulfato ferroso hepta-hidratado perde moléculas de água por aquecimento e pode ser transformado em outras formas de sulfato ferroso; assim, quando aquecido a 57 ° C, perde três moléculas de água e é transformado em sulfato ferroso tetra-hidratado. Quantos no total você pode perder? Sete moléculas de água, ou seja, muita água.
O sulfato ferroso é usado no tratamento e prevenção da anemia por deficiência de ferro. No entanto, pode ter efeitos tóxicos, por isso é preciso ter cuidado com a dose.
Por outro lado, esse sal de ferro tem vários usos e aplicações que incluem a coloração de material têxtil e couro; agente redutor químico; dosímetro de radiação; agente conservante de madeira. Também é usado na prevenção da clorose nas plantas e nos processos de gravura e litografia.
FeSO 4 pode ser oxidado no ar para ferro sulfato de (III), Fe 2 (SO 4 ) 3 , a uma taxa que pode ser aumentada pela temperatura, luz ou a elevação do pH.
Muitas das propriedades físicas e químicas do sulfato ferroso, como a solubilidade em água, o ponto de fusão, o tipo de cristais que forma e a densidade, dependem do número de moléculas de água incorporadas nos cristais; isto é, dos seus hidratos.
Estrutura de sulfato de ferro
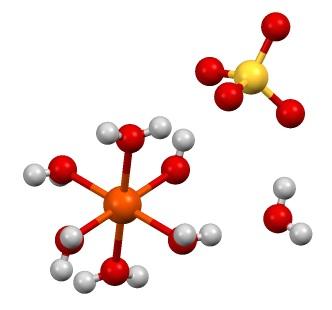
A fórmula química FeSO 4 enfatiza que este sal é composto de íons Fe 2+ e SO 4 2- na proporção de 1: 1. Ambos os íons interagem por forças eletrostáticas de tal maneira que são organizados em um sistema cristalino ortorrômbico; que, logicamente, corresponde ao sal anidro.
Na imagem acima, por outro lado, é mostrada a estrutura do FeSO 4 · 7H 2 O. A esfera laranja representa o cátion Fe 2+ , que, como pode ser visto, coordena com seis moléculas de água para formar um octaedro. A carga de Fe 2+ atrai o ânion SO 4 2- , e isso, por sua vez, se observado, forma uma ponte de hidrogênio com a sétima molécula de água.
A sétima molécula de água (a que está distante do octaedro) também forma outra ponte de hidrogênio com outra molécula de água pertencente a um octaedro vizinho. O resultado dessas interações é que o cristal passa de ortorrômbico para monoclínico.
Como os cristais de FeSO 4 anidro vai hidratar os aniões SO 4 2- ambiente a Fe 2+ são substituídas por moléculas de H 2 O. Tais substituições perturbam electrões d ferro, forçando-os a passar através de diferentes níveis de energias; responsáveis pelas alterações de coloração entre branco e verde azulado.
Acidez
Alguns aniões SO 4 2- pode ser meio ácido do produto protonado. Consequentemente, dentro dos cristais de FeSO 4 ? 7H 2 O pode haver moléculas de H 2 SO 4 , se o pH é muito ácido; e, portanto, tocar esses belos cristais nessas condições pode causar queimaduras graves.
Propriedades físicas e químicas
Nomes
Sulfato ferroso ou sulfato de ferro (II)
Fórmula molecular
– Sulfato ferroso anidro (FeSO 4 )
– Sulfato ferroso hepta-hidratado (FeSO 4 .7H 2 O)
Peso molecular
Varia com o grau de hidratação do sulfato. Por exemplo, o sulfato de ferro hepta-hidratado tem um peso molecular de 278,02 g / mol; enquanto o anidro tem um peso molecular de 151,91 g / mol.
Aparência física
Também varia com o grau de hidratação. Por exemplo, a forma anidra tem cristais ortorrômbicos brancos; enquanto na forma hepta-hidra, os cristais são azul esverdeados monoclinicos.
Cheiro
WC
Densidade
O sulfato ferroso anidro é a forma de sal mais densa (3,65 g / cm 3 ). A forma hepta-hidratada, por outro lado, é a menos densa (1.895 g / cm 3 ).
Ponto de fusão
Da mesma forma, isso varia dependendo do grau de hidratação. A forma anidra tem um ponto de fusão de 680 ° C (1.856 ° F, 973 K) e a forma hepta-hidratada, 60-64 ° C (140-147 ° F, 333-337 K).
Solubilidade em água
– Forma monohidratada: 44,69 g / 100 ml de água (77 ºC)
– Formar hepta-hidratado 51,35 g / 100 ml de água (54 ºC).
Solubilidade em álcool
Insolúvel
Pressão de vapor
1,95 kPa (forma hepta-hidratada)
Índice de refração
1.591 (monohidrato) e 1.471 (hepta-hidrato).
Estabilidade
No ar, ele pode oxidar rapidamente e é coberto com uma cor marrom-amarela, o que indica a presença do cátion Fe 3+ . A taxa de oxidação é aumentada pela adição de álcalis ou pela exposição à luz.
Decomposição
Quando aquecido até a decomposição, emite vapores tóxicos de dióxido de enxofre e trióxido de enxofre, deixando como resíduo um óxido de ferro avermelhado.
Reacções
É um agente redutor que atua no ácido nítrico, reduzindo-o ao monóxido de nitrogênio. Também reduz o cloro em cloreto e as formas tóxicas de cromo presentes no cimento em cromo (III), de menor toxicidade.
Síntese
De lã de aço
O sulfato ferroso é produzido pela reação do aço (Fe) com ácido sulfúrico. No método descrito, segue-se o seguinte procedimento: o aço é utilizado na forma de lã de aço, que é previamente desengordurada com acetona.
Em seguida, a lã de aço é colocada em um copo de vidro e completamente revestida com 30-40% de ácido sulfúrico, permitindo a digestão ácida por várias horas; até a lã de aço desaparecer. Você pode adicionar mais lã de aço e repetir o procedimento várias vezes.
Os cristais verdes que podem ter se formado são redissolvidos usando água acidificada a pH 1-2 com ácido sulfúrico. Esta solução é filtrada em papel de filtro e o pH é ajustado pela adição de carbonato de sódio. A solução é armazenada, para evitar o contato com o oxigênio, favorecendo a oxidação do Fe 2+ ao Fe 3+
Posteriormente, o filtrado é evaporado a uma temperatura entre 80-90 ° C. O procedimento é realizado em cápsulas Pietri colocadas em uma placa de aquecimento. Em seguida, os cristais verdes formados são coletados, que podem ser levados a um dessecador para concluir sua desidratação.
Da pirita
O sulfato ferroso também é produzido pela oxidação da pirita (FeS 2 ).
2 FeS 2 + 7 S 2 + 2H 2 O => 2 FeSO 4 + 2 H 2 SO 4
Riscos
A inalação de FeSO 4 causa irritação no nariz, garganta e pulmões. Se você tiver contato físico com este sal, pode causar irritação na pele e nos olhos; Além disso, o contato prolongado com este último pode causar manchas acastanhadas e lesões oculares.
A ingestão repetida pode causar náusea, vômito, dor de estômago, constipação e movimentos intestinais irregulares.
Entre os sinais de intoxicação com sulfato ferroso, estão os seguintes: fezes pretas ou com sangue; pele e unhas azuladas; alterações no volume de urina excretada; desmaio boca ou olhos secos; dor no peito; vírgula dificuldade respiratória.
Além disso, podem ocorrer batimentos cardíacos rápidos e irregulares, aumento da sede e fome, palidez incomum e encurtamento da respiração.
A alteração da coagulação é uma indicação de envenenamento com sulfato ferroso, com prolongamento dos tempos de trombina, protrombina e tromboplastina parcial.
Estudos sobre o efeito do sulfato ferroso nos músculos isolados do coração de coelhos permitiram observar que ele produzia uma redução na tensão máxima desenvolvida pelos músculos cardíacos estudados, bem como a velocidade máxima de desenvolvimento da tensão.
Usos
Na agricultura
-É utilizado como pesticida para controlar a pitada de trigo e a decomposição de árvores frutíferas.
-É utilizado no tratamento da clorose, uma doença caracterizada pelo amarelecimento das folhas, causada pela alcalinidade do solo.
O sulfato ferroso controla a alcalinidade, diminuindo o pH dos solos.
– Elimina o musgo e condiciona o gramado.
Como reagente e na indústria
Dentro dos usos do FeSO 4 como reagente e na indústria, existem os seguintes:
Reagente analítico
– Matéria-prima para obtenção de ferrita e óxido de ferro magnético
-Ingrediente para a elaboração do pigmento azul inorgânico
– Ácido nítrico, reagente redutor de cloro e cromo
-Na fabricação de outros sulfatos
-É utilizado em banhos de galvanoplastia com ferro
– Conservante de madeira
-Em gravuras de alumínio
– Análise qualitativa de nitratos (teste amarelo marrom por oxidação de Fe 2+ )
-Catalisador de polimerização
-É utilizado como precursor da síntese de outros ferros
-É utilizado industrialmente como fixador de corante
-Na fabricação de corante de ferro
-Mordida na coloração de lã
-Para dar à madeira de bordo uma cor prateada
– Catalisador de ferro na reação de Fenton
Em medicina e para fortificação de alimentos
É utilizado no tratamento da anemia por deficiência de ferro, usando uma dose de 150 a 300 mg de sulfato ferroso, três vezes ao dia, o que produz um aumento notável na concentração de hemoglobina em uma semana de tratamento.
Também foi recomendado para uso em mulheres grávidas como um complemento à sua dieta. O sulfato ferroso tem sido usado como adstringente na cicatrização de feridas em bovinos.
Outros
É utilizado no tratamento de águas residuais por floculação e também para a remoção de fosfato dessas águas. O sulfato ferroso hepta-hidratado é usado para identificar os tipos de fungos.
Referências
- CR Scientific. (sf). Preparação de laboratório de sulfato ferroso. Recuperado de: crscientific.com
- Werner H. Baur. (1964). Sobre a química cristalina dos hidratos de sal. III A determinação da estrutura cristalina de FeSO 4 7H 2 O (melanterite). Cryst Act. doi.org/10.1107/S0365110X64003000
- PubChem (2019). Sulfato ferroso hepta-hidratado. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Marks Lynn (19 de dezembro de 2014). O que é o sulfato ferroso (Feosol)? Toda Saúde Recuperado de: everydayhealth.com
- Wikipedia (2019). Sulfato de ferro (II). Recuperado de: en.wikipedia.org