O sulfato de sódio é um composto químico com a fórmula Na2SO4, sendo um sal inorgânico comumente encontrado na forma de cristais brancos e solúvel em água. Suas propriedades incluem a capacidade de atuar como agente redutor, oxidante e secante, sendo amplamente utilizado em diversas aplicações industriais e domésticas. Sua estrutura consiste em íons de sódio e sulfato ligados por ligações iônicas. Entre suas aplicações mais comuns estão a fabricação de detergentes, produtos de limpeza, vidros, tintas, entre outros.
Fórmula química do sulfato de sódio: como é composta essa substância?
O sulfato de sódio é um composto químico inorgânico cuja fórmula química é Na2SO4. Ele é formado por um átomo de sódio (Na) e um íon sulfato (SO4), que consiste em um átomo de enxofre (S) ligado a quatro átomos de oxigênio (O).
A estrutura do sulfato de sódio é cristalina e apresenta uma forma de cristal octaédrica. Ele é altamente solúvel em água e sua solução aquosa é neutra. Além disso, o sulfato de sódio é um sal incolor e inodoro, que pode ser encontrado na forma de pó ou cristais.
As propriedades do sulfato de sódio incluem sua capacidade de atuar como agente redutor em algumas reações químicas, bem como sua utilização na indústria de detergentes como agente antiaglomerante. Além disso, ele também é utilizado na fabricação de vidro, papel e produtos químicos.
Sua estrutura cristalina e solubilidade em água o tornam um componente versátil em diferentes processos químicos.
Fórmula química do sulfito de sódio: qual é e como é composta?
O sulfato de sódio é um composto químico com a fórmula Na2SO4. Ele é composto por dois átomos de sódio, um átomo de enxofre e quatro átomos de oxigênio. Este sal inorgânico é amplamente utilizado em diversas aplicações industriais e domésticas devido às suas propriedades úteis.
Uma fórmula química relacionada é a do sulfito de sódio, que é representada por Na2SO3. Esta substância é composta por dois átomos de sódio, um átomo de enxofre e três átomos de oxigênio. O sulfito de sódio é utilizado em diversas indústrias, como a alimentícia, a de papel e celulose, e a de tratamento de água, devido às suas propriedades redutoras e conservantes.
Em termos de estrutura, o sulfato de sódio e o sulfito de sódio apresentam diferenças significativas, principalmente devido à presença de um átomo adicional de oxigênio no sulfato. Essa diferença na composição química resulta em propriedades distintas para cada um desses compostos.
As aplicações do sulfato de sódio incluem a fabricação de detergentes, produtos de limpeza, vidro e papel. Já o sulfito de sódio é usado como agente redutor em processos de branqueamento de papel, conservante em alimentos e tratamento de água para remoção de cloro.
Aplicações do sulfato: conheça os diversos usos desse composto químico na indústria e agricultura.
O sulfato de sódio é um composto químico com diversas aplicações na indústria e agricultura. Conhecido pela fórmula Na2SO4, é utilizado em uma variedade de processos de fabricação e como fertilizante nas plantações.
Na indústria, o sulfato de sódio é utilizado na fabricação de papel, vidro, detergentes e produtos químicos. Ele atua como agente espessante, agente de secagem e agente redutor de temperatura em diversos processos industriais. Além disso, é utilizado na produção de produtos farmacêuticos e cosméticos.
Já na agricultura, o sulfato de sódio é utilizado como fertilizante para fornecer enxofre e sódio às plantas. Esses nutrientes são essenciais para o crescimento saudável das culturas e ajudam a melhorar a qualidade do solo. O composto químico também é utilizado na correção do pH do solo e na prevenção de deficiências nutricionais nas plantações.
Além disso, o sulfato de sódio é utilizado na indústria alimentícia como aditivo para melhorar a textura e a estabilidade de alimentos processados. Ele também é utilizado na fabricação de produtos de limpeza, como sabões e detergentes, devido às suas propriedades de limpeza e espuma.
Seu uso é fundamental para o funcionamento de diversos setores da economia e para o crescimento saudável das plantações.
Descubra a função do composto Na2SO4 e suas aplicações na indústria e na química.
O Sulfato de sódio, cuja fórmula química é Na2SO4, é um composto inorgânico amplamente utilizado na indústria e na química. Uma de suas principais aplicações na indústria é como agente redutor na fabricação de papel, onde ajuda a remover as impurezas da celulose. Além disso, o Sulfato de sódio é utilizado na fabricação de detergentes, pois auxilia na remoção de gorduras e sujeiras.
Na química, o Sulfato de sódio é empregado como agente dessicante, ou seja, para absorver a umidade de substâncias e ambientes. Sua estrutura cristalina permite que ele seja eficaz na remoção de água, sendo utilizado em laboratórios e em processos industriais que requerem a ausência de umidade.
Além disso, o Sulfato de sódio também é utilizado na indústria de vidro, na fabricação de corantes e pigmentos, e na produção de produtos químicos diversos. Suas propriedades químicas permitem que ele atue como catalisador em diversas reações, facilitando a obtenção de determinados compostos.
Sulfato de sódio: fórmula, propriedades, estrutura, aplicações
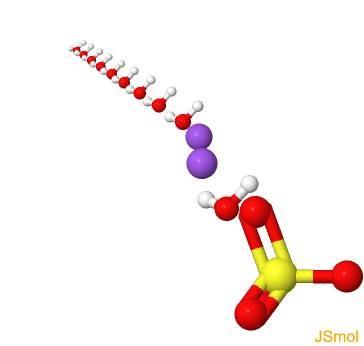
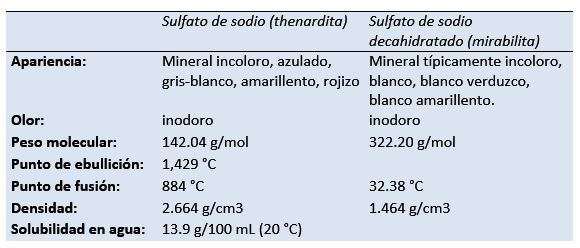
O sulfato de sódio (sal dissódico de ácido sulfúrico, tetraoxidosulfato dissódico, sulfato de sódio, Glauber de sal, thenardite, mirabilite) é o composto inorgânico com a fórmula Na 2 SO 4 e hidratos de carbono relacionados. Todas as formas são sólidos brancos que são altamente solúveis em água.
É considerado um dos principais produtos químicos comercializados. Sua produção mundial (quase exclusivamente na forma de deca-hidrato) é de aproximadamente 6 milhões de toneladas por ano.
Thenardita é o mineral anidro de sulfato de sódio produzido em ambientes áridos de evaporito, em cavernas secas, em antigas operações de mineração como eflorescência e depósito em torno de fumarolas.
Foi descrito pela primeira vez em 1825 em Salinas Espartinas (Ciempozuelos, Madri, Espanha) e foi nomeado thenardita em homenagem ao químico francês Louis Jacques Thénard (1777-1826).
O químico e farmacêutico holandês / alemão Johann Rudolf Glauber (1604-1670) descobriu, nas águas de uma nascente austríaca, o decahidrato de sulfato de sódio (mais tarde conhecido como sal de Glauber). Ele o chamou de sal mirabilis (sal milagroso), devido às suas propriedades medicinais.
Entre 1650 e 1660, Glauber começou a fabricar sulfato de sódio a partir de sal comum (NaCl) e ácido sulfúrico concentrado. Este processo é considerado como o início da indústria química.
Seus cristais foram utilizados como laxante até o século XX.
No século XVIII, a reação do sal Glauber com potássio (carbonato de potássio) começou a ser utilizada na produção industrial de carbonato de sódio (carbonato de sódio).
Atualmente, é utilizado principalmente na fabricação de detergentes e no processo Kraft para a produção de celulose (o método dominante na produção de papel).
Depósitos minerais de sulfato de sódio são encontrados nos Estados Unidos, Canadá, Espanha, Itália, Turquia, Romênia, México, Botsuana, China, Egito, Mongólia e África do Sul.
Os principais produtores são a China (províncias de Jiangsu e Sichuan), seguida pela Espanha, onde está localizado o maior depósito de glauberita do mundo (em Cerezo de Río Tirón, Burgos).
A produção mundial total de sulfato de sódio natural é estimada em cerca de 8 milhões de toneladas e a obtida como subproduto de outros processos industriais entre 2 e 4 milhões de toneladas.
Na Espanha, de acordo com informações publicadas no Inventário Nacional de Recursos de Sulfato de Sódio e outros dados atualizados, os estoques de minerais de sulfato de sódio são estimados na ordem de 730 Mt listados como “reservas” e 300 Mt mais listados como “outros recursos” .
Na União Européia, a Espanha é atualmente o único país com fazendas de minério de sulfato de sódio (principalmente de tenardita, glauberita e mirabilita).
Atualmente, há uma diminuição geral na demanda por sulfato de sódio no setor têxtil.
Nos últimos anos, outros setores, como detergentes, experimentam algum crescimento, em certas regiões, devido ao baixo preço como matéria-prima.
Os principais mercados em expansão de detergentes com sulfato de sódio estão na Ásia, América Central e do Sul.
Fórmulas
Estrutura 2D
Estrutura 3D
Caracteristicas
Propriedades físicas e químicas
O sulfato de sódio pertence ao grupo reativo de compostos de sódio e também ao grupo de sulfatos, sulfatos de hidrogênio e dissulfatos.
Inflamabilidade
É uma substância à prova de fogo. Não há risco de explosão de seus pós.
Reatividade
O sulfato de sódio é muito solúvel em água e higroscópico. É muito estável, sendo não reativo para a maioria dos agentes oxidantes ou redutores em temperaturas normais. Em altas temperaturas, pode ser convertido em sulfeto de sódio por redução carbotérmica.
Substâncias quimicamente não reativas são consideradas não reativas sob condições ambientais típicas (embora possam reagir em circunstâncias relativamente extremas ou em catálise). Eles são resistentes à oxidação e redução (exceto em condições extremas).
Reações químicas perigosas
Quando o alumínio derrete junto com o sulfato de sódio ou potássio, ocorre uma violenta explosão.
Toxicidade
As substâncias quimicamente não reativas são consideradas não tóxicas (embora as substâncias gasosas nesse grupo possam atuar como asfixiantes).
Embora o sulfato de sódio seja geralmente considerado não tóxico, ele deve ser manuseado com cuidado. O pó pode causar asma ou irritação ocular temporária. Esse risco pode ser evitado usando proteção para os olhos e uma máscara de papel.
Usos
Suas principais aplicações são na fabricação de:
- detergentes em pó
- pasta de papel
- têxteis
- vidro
- síntese enzimática (produção de vinho).
- alimentação humana e animal.
- Produtos farmacêuticos
- química básica em geral.
- processos de aço
- Detergente em pó
O sulfato de sódio é um material muito barato. Seu maior uso é como enchimento em detergentes em pó para uso doméstico, consumindo aprox. 50% da produção mundial. Os novos detergentes compactos ou líquidos não incluem sulfato de sódio, portanto esse uso está diminuindo.
Outro uso de sulfato de sódio que está diminuindo em importância, especialmente nos EUA e Canadá, está em processo Kraft para a fabricação de celulose de madeira. Os avanços na eficiência térmica do processo reduziram drasticamente a necessidade de sulfato de sódio.
A indústria do vidro fornece outra aplicação importante para o sulfato de sódio. É a segunda maior aplicação da Europa. O sulfato de sódio é usado para ajudar a remover pequenas bolhas de ar do vidro fundido.
No Japão, a maior aplicação de sulfato de sódio é na fabricação de têxteis. O sulfato de sódio ajuda os corantes a penetrar uniformemente nas fibras e não corroa os recipientes de aço inoxidável usados no tingimento (diferentemente do cloreto de sódio, que é o método alternativo).
O sulfato de sódio é especialmente adequado para armazenar calor solar de baixa qualidade (para liberação subsequente em aplicações de aquecimento) devido à sua alta capacidade de armazenamento de calor durante sua mudança de fase de sólido para líquido, que ocorre a 32 ° C .
Para aplicações de resfriamento, uma mistura com sal comum de cloreto de sódio (NaCl) reduz o ponto de fusão para 18 ° C.
Em laboratório, o sulfato de sódio anidro é amplamente utilizado como um agente de secagem inerte, para remover vestígios de água de soluções orgânicas. Sua ação é mais lenta que a do sulfato de magnésio, mas pode ser usada com uma grande variedade de materiais, pois quimicamente é bastante inerte.
O decahidrato de sulfato de sódio (sal de Glauber) foi historicamente usado como laxante. É eficaz para a eliminação de certos medicamentos, como o paracetamol (acetaminofeno) do organismo, após uma overdose.
Outras aplicações para o sulfato de sódio incluem seu uso como aditivo na fabricação de purificadores de carpete, como aditivo na alimentação animal e na fabricação de amido.
Efeitos clínicos
Devido às suas aplicações terapêuticas, o sulfato de sódio pertence à categoria de laxantes salinos e catárticos utilizados no tratamento da constipação.
Catárticos salinos são sais que retêm líquidos no intestino devido à ação osmótica do sal não absorvido, resultando em um aumento indireto do peristaltismo.
Os catárticos salinos são pouco absorvidos pelo trato gastrointestinal; portanto, a toxicidade sistêmica é improvável, a menos que quantidades maciças tenham sido ingeridas. No entanto, grandes exposições podem causar desidratação e anormalidades eletrolíticas secundárias aos efeitos osmóticos do composto.
O abuso laxante crônico pode ocorrer em pacientes com distúrbios alimentares, síndrome de Munchausen ou distúrbios factícios. Normalmente, os pacientes apresentam náusea, vômito e diarréia associados a cólicas abdominais. Efeitos graves podem incluir desidratação, hipotensão, hipernatremia e anormalidades eletrolíticas.
Segurança e riscos
Declarações de perigo do Sistema Globalmente Harmonizado de Classificação e Rotulagem de Produtos Químicos (GHS).
O Sistema Globalmente Harmonizado de Classificação e Rotulagem de Produtos Químicos (GHS) é um sistema acordado internacionalmente, criado pelas Nações Unidas projetado para substituir os vários padrões de classificação e rotulagem usados em diferentes países através do uso de critérios consistentes em todo o mundo (United States United, 2015).
As classes de perigo (e seu capítulo correspondente no GHS), os padrões de classificação e rotulagem e as recomendações para sulfato de sódio são as seguintes (Agência Europeia de Produtos Químicos, 2017; Nações Unidas, 2015; PubChem, 2017):
Classes de perigo do GHS
H315: Provoca irritação cutânea [Aviso Corrosão / irritação cutânea – Categoria 2].
H317: Pode causar uma reação alérgica na pele [Sensibilização à Advertência, Pele – Categoria 1].
H319: Provoca irritação ocular grave [Aviso Lesões oculares graves / irritação ocular – Categoria 2A].
H412: Nocivo para os organismos aquáticos com efeitos nocivos duradouros [Perigoso para o ambiente aquático, risco a longo prazo – categoria 3].
(PubChem, 2017)
Códigos de recomendação de precaução
P261, P264, P272, P273, P280, P302 + P352, P305 + P351 + P338, P321, P332 + P313, P333 + P313, P337 + P313, P362, P363 e P501.
Referências
- ChemIDplus (2017) Estrutura 3D de 7757-82-6 – Sulfato de sódio anidro [imagem]. Recuperado de: chem.nlm.nih.gov.
- ChemIDplus (2017) Estrutura 3D de 7727-73-3 – Sulfato de sódio [USP] [imagem]. Recuperado de: chem.nlm.nih.gov.
- Dyet, D. (2007) Sulfato de sódio de Thenardita perto de Sodaville Mineral County Nevada [imagem] Recuperado de: en.wikipedia.org.
- Agência Europeia dos Produtos Químicos (ECHA), (2017). Resumo da classificação e rotulagem. Classificação harmonizada – anexo VI do Regulamento (CE) n.o 1272/2008 (Regulamento CRE). Sulfato de sódio.
- Grumetisho (2012) Mirabilita [imagem] Recuperado de: es.wikipedia.org.
- Banco de Dados de Substâncias Perigosas (HSDB). TOXNET (2017). Sulfato de sódio. Bethesda, MD, EU: Biblioteca Nacional de Medicina. Recuperado de: toxnet.nlm.nih.gov.
- Instituto Geológico e Mineiro de Espanha (IGME) (2016). GLAUBERITA-THENARDITA (SULFATO DE SÓDIO NATURAL) 2014. Panorama da mineração. Recuperado de: igme.es.
- Instituto Nacional de Segurança do Trabalho (INSHT). (2010). Fichas de dados internacionais de segurança química. Sulfato de sódio Ministério do Emprego e Segurança. Madrid ES Recuperado de: insht.es.
- Langbein Rise (2008) Mil de celulose kraft contínua [imagem] Recuperado de: wikimedia.org.
- Nações Unidas (2015). Sistema globalmente harmonizado de classificação e rotulagem de produtos químicos (GHS) sexta edição revisada. Nova York, UE: publicação das Nações Unidas. Recuperado de: unece.org.
- Centro Nacional de Informação Biotecnológica. PubChem Compound Database (2016) sulfato de sódio – PubChem Structure [imagem] Bethesda, MD, EU: National Library of Medicine. Recuperado de: pubchem.ncbi.nlm.nih.gov.
- Centro Nacional de Informação Biotecnológica. PubChem Compound Database (2016) sulfato de sódio – PubChem Structure [imagem] Bethesda, MD, EU: National Library of Medicine.
- Centro Nacional de Informação Biotecnológica. Banco de dados composto PubChem. (2017). Sulfato de sódio desidratado. Bethesda, MD, EU: Biblioteca Nacional de Medicina. Recuperado de: pubchem.ncbi.nlm.nih.gov.
- Centro Nacional de Informação Biotecnológica. Banco de dados composto PubChem. (2017). Sulfato de sódio. Bethesda, MD, EU: Biblioteca Nacional de Medicina. Recuperado de: pubchem.ncbi.nlm.nih.gov.
- Walkerma (2005) Sulfato de sódio [imagem] Recuperado de: wikimedia.org.
- Wikipedia (2017) Processo Kraft. Recuperado em: wikipedia.org.
- Wikipedia (2017) Mirabilita. Recuperado em: wikipedia.org.
- Wikipedia (2017) Mirabilita. Recuperado em: wikipedia.org.
- Wikipedia (2017) Sulfato de sódio. Recuperado em: wikipedia.org.
- Wikipedia (2017) Solução de desidratação de sódio. Recuperado de: https://it.wikipedia.org.
- Wikipedia (2017) Sulfato de sódio. Recuperado em: wikipedia.org.
- Wikipedia (2017) Thenardita. Recuperado em: wikipedia.org.
- Wikipedia (2017) Thenardite. Recuperado em: .wikipedia.org.