A tabela periódica dos elementos é uma ferramenta fundamental na química que organiza os elementos químicos de acordo com suas propriedades e características. Criada por Dmitri Mendeleev em 1869, a tabela periódica tem evoluído ao longo dos anos, com a descoberta de novos elementos e a revisão de suas propriedades. A estrutura da tabela é baseada no número atômico dos elementos e suas configurações eletrônicas, permitindo uma fácil identificação e compreensão das relações entre eles. Atualmente, a tabela periódica conta com 118 elementos, desde o hidrogênio até o oganesson, cada um com suas próprias características e propriedades únicas.
Origem e evolução da tabela periódica ao longo da história da química.
A Tabela Periódica dos Elementos é uma das ferramentas mais importantes e fundamentais da química. Ela organiza os elementos químicos de acordo com suas propriedades e facilita a compreensão da relação entre eles. A origem da Tabela Periódica remonta ao século XIX, quando os químicos começaram a perceber padrões nas propriedades dos elementos.
Um dos primeiros a tentar organizar os elementos de forma sistemática foi o químico russo Dmitri Mendeleev. Em 1869, Mendeleev criou a primeira versão da Tabela Periódica, colocando os elementos em ordem crescente de massa atômica e deixando espaços vazios para elementos ainda não descobertos. Ele também organizou os elementos em colunas e linhas de acordo com suas propriedades químicas, o que permitia prever as propriedades de elementos desconhecidos.
A Tabela Periódica evoluiu ao longo do tempo, à medida que novos elementos foram descobertos e a compreensão da estrutura atômica avançou. Atualmente, a Tabela Periódica moderna é organizada de acordo com o número atômico, que representa o número de prótons no núcleo de um átomo. Os elementos estão dispostos em ordem crescente de número atômico e organizados em grupos e períodos, de acordo com suas propriedades químicas.
A estrutura da Tabela Periódica é composta por grupos e períodos. Os grupos são as colunas verticais da Tabela, que contêm elementos com propriedades químicas semelhantes. Os períodos são as linhas horizontais da Tabela, que indicam o número de camadas eletrônicas dos átomos dos elementos.
Atualmente, a Tabela Periódica contém 118 elementos, dos quais 92 são naturais e os demais são sintéticos. Cada elemento é representado por um símbolo químico e possui propriedades únicas que o distinguem dos demais. Alguns dos elementos mais conhecidos são o hidrogênio, o oxigênio, o carbono e o ferro.
Em resumo, a Tabela Periódica dos Elementos é uma ferramenta essencial para a química, que tem sua origem na tentativa de organizar os elementos de acordo com suas propriedades. Ao longo da história, a Tabela Periódica evoluiu e se tornou uma referência fundamental para os químicos e cientistas em geral.
Descubra a lista completa dos 118 elementos presentes na tabela periódica.
A tabela periódica dos elementos é uma ferramenta essencial da química, que organiza todos os elementos químicos conhecidos de acordo com suas propriedades e comportamentos. Ela foi desenvolvida ao longo dos anos por diversos cientistas e tem sido aprimorada constantemente.
A tabela periódica é dividida em linhas horizontais chamadas de períodos e em colunas verticais chamadas de grupos. Cada elemento é representado por um símbolo químico único, como por exemplo, H para o hidrogênio, O para o oxigênio e Au para o ouro.
Atualmente, a tabela periódica conta com 118 elementos, desde o hidrogênio até o oganesson. Cada elemento possui características próprias que os distinguem dos demais, como o número atômico, massa atômica e configuração eletrônica.
Os elementos são classificados em metais, não metais e metaloides, de acordo com suas propriedades físicas e químicas. Alguns elementos são essenciais para a vida, como o carbono, o oxigênio e o hidrogênio, enquanto outros são extremamente tóxicos, como o mercúrio e o chumbo.
Portanto, a tabela periódica dos elementos é uma ferramenta fundamental para a compreensão da química e do mundo que nos cerca. É importante estudar e conhecer os 118 elementos presentes na tabela periódica, pois eles são a base de toda a matéria existente no universo.
O pioneiro da organização da tabela periódica: quem foi o responsável por isso?
O pioneiro da organização da tabela periódica foi o químico russo Dmitri Ivanovich Mendeleev. Em 1869, Mendeleev criou a primeira versão da tabela periódica dos elementos, que organizava os elementos conhecidos até então de acordo com suas propriedades químicas e suas massas atômicas.
Mendeleev percebeu que ao organizar os elementos em ordem crescente de massa atômica, padrões começaram a surgir. Ele deixou espaços vazios na tabela para elementos que ainda não tinham sido descobertos, prevendo suas propriedades com base nas propriedades dos elementos vizinhos.
Essa genialidade de Mendeleev permitiu prever a existência de elementos como o germânio e o escândio, que foram descobertos mais tarde e confirmaram a precisão de sua tabela periódica. A tabela de Mendeleev foi fundamental para o desenvolvimento da química moderna e ainda é a base para a tabela periódica que utilizamos atualmente.
Passo a passo para elaborar um resumo sobre a tabela periódica.
Para elaborar um resumo sobre a tabela periódica, é importante seguir alguns passos simples. Primeiramente, é essencial compreender a história por trás da criação da tabela periódica dos elementos. Em seguida, é necessário entender a estrutura da tabela, como os elementos estão organizados de acordo com suas propriedades químicas.
Depois de compreender a história e a estrutura da tabela periódica, o próximo passo é analisar os diferentes elementos que a compõem. É importante destacar as principais características de cada elemento, como número atômico, massa atômica e configuração eletrônica.
Além disso, é fundamental mencionar a importância da tabela periódica na química moderna, pois ela é uma ferramenta essencial para os cientistas entenderem as relações entre os diferentes elementos e preverem seu comportamento em reações químicas.
Portanto, ao elaborar um resumo sobre a tabela periódica, é essencial abordar a história, estrutura e elementos de forma clara e concisa, destacando a importância deste recurso na química.
Tabela periódica dos elementos: história, estrutura, elementos
A tabela periódica dos elementos é uma ferramenta que permite consultar as propriedades químicas dos 118 elementos conhecidos até agora. É essencial ao fazer cálculos estequiométricos , prever as propriedades físicas de um elemento, classificá-los e encontrar propriedades periódicas entre todos eles.
Os átomos se tornam mais pesados à medida que seus núcleos adicionam prótons e nêutrons, que também devem ser acompanhados por novos elétrons; caso contrário, a eletroneutralidade não seria possível. Assim, alguns átomos são muito leves, como o hidrogênio, e outros, super pesados, como o oganeson.
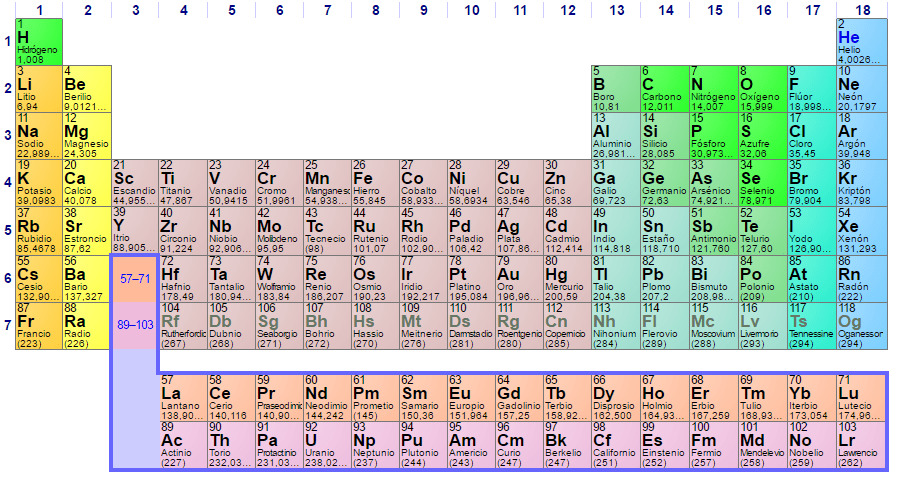
Quem deve esse coração à química ? Para o cientista Dmitri Mendeléyev , que em 1869 (quase 150 anos atrás) publicou, após uma década de estudos e experimentos teóricos, a primeira tabela periódica na tentativa de organizar os 62 elementos conhecidos na época.
Para fazer isso, Mendeleev contou com propriedades químicas, enquanto Lothar Meyer publicou em paralelo outra tabela periódica que foi organizada de acordo com as propriedades físicas dos elementos.
Inicialmente, a tabela continha “espaços vazios”, cujos elementos não eram conhecidos há anos. No entanto, Mendeleev foi capaz de prever com precisão apreciável várias de suas propriedades. Alguns desses elementos foram: germânio (que ele chamou de eka-silício) e gálio (eka-alumínio).
As primeiras tabelas periódicas ordenaram os elementos de acordo com suas massas atômicas. Esse arranjo mostrou alguma periodicidade (repetição e similaridade) nas propriedades químicas dos elementos; no entanto, os elementos de transição não correspondiam a essa ordem, nem os gases nobres.
Por esse motivo, foi necessário ordenar os elementos considerando o número atômico (número de prótons), em vez da massa atômica. A partir daqui, juntamente com o trabalho árduo e as contribuições de muitos autores, a tabela periódica de Mendeleev foi aperfeiçoada e concluída.
Histórico da tabela periódica
Elementos
O uso de elementos como base para descrever o ambiente (mais precisamente, a natureza) tem sido utilizado desde a antiguidade.No entanto, naquela época, era feita referência a eles como as fases e os estados da matéria, e não da maneira como é referida a partir da Idade Média .
Os gregos antigos tinham uma crença de que o planeta que habitamos consistiu em quatro elementos-chave: f epois, você Erra, uma gua e ira.

Por outro lado, na China antiga, o número de elementos era cinco e, diferentemente dos gregos, estes excluíam o ar e incluíam metal e madeira.

A primeira descoberta científica foi feita em 1669 pelo alemão Henning Brand, que descobriu a partida; a partir dessa data, todos os itens subsequentes foram registrados.

Vale esclarecer que alguns elementos como ouro e cobre já eram conhecidos antes da partida; a diferença é que eles nunca foram registrados.
Simbologia
Os alquimistas (ancestrais dos químicos atuais) nomearam os elementos em relação às constelações, seus descobridores e os lugares onde foram descobertos.
Em 1808, Dalton propôs uma série de desenhos (símbolos) para representar os elementos. Então, esse sistema de notação foi substituído pelo de Jhon Berzelius (usado até hoje), dado que o modelo de Dalton se tornou complicado à medida que novos elementos apareceram.
Evolução do esquema
As primeiras tentativas de criar um mapa que organizou a informação de elementos químicos ocorreram no século XIX com as tríades de Döbereiner (1817).

Ao longo dos anos, novos elementos foram encontrados, dando origem a novos modelos organizacionais até atingir o atualmente utilizado.
Parafuso telúrico de Chancourtois (1862)
Alexandré-Émile Béguyer de Chancourtois projetou uma hélice de papel mostrando uma carta em espiral (parafuso telúrico).
Neste sistema, os elementos são ordenados em ordem crescente em relação aos seus pesos atômicos. Elementos semelhantes são alinhados verticalmente.
Oitavas de Newlands (1865)
Continuando com o trabalho de Döbereiner, o britânico John Alexander Queen Newlands ordenou os elementos químicos em ordem crescente em relação aos pesos atômicos, observando que todos os sete elementos tinham semelhanças em suas propriedades (o hidrogênio não está incluído).
Quadro de Mendeléyv (1869)
Mendeléyv ordenou os elementos químicos em ordem crescente em relação ao peso atômico, colocando na mesma coluna aqueles cujas propriedades eram semelhantes. De buracos Jo em seu modelo de tabela periódica proporcionando o aparecimento de novos elementos no futuro (e prever as propriedades que deve ser).
Os gases nobres não estão listados na tabela de Mendeléyv, pois ainda não haviam sido descobertos. Além disso, Mendeléiv não considerou o hidrogênio.
Tabela periódica de Moseley (tabela periódica atual) – 1913
Henry Gwyn Jeffreys Moseley propôs ordenar os elementos químicos da tabela periódica de acordo com seu número atômico; isto é, dependendo do número de prótons.
Moseley enunciou a “Lei Periódica” em 1913: “Quando os elementos são ordenados por seus números atômicos, suas propriedades físicas e químicas mostram tendências periódicas”.
Assim, cada linha ou período horizontal mostra um tipo de relacionamento e cada coluna ou grupo mostra outro.
Como é organizado? (Estrutura e organização)

Pode-se observar que o bolo da tabela periódica possui várias cores. Cada cor associa elementos com propriedades químicas semelhantes. Existem colunas laranja, amarelas, azuis, roxas; quadrados verdes e uma maçã verde na diagonal.
Observe que os quadrados nas colunas do meio são acinzentadas, portanto todos esses elementos devem ter algo em comum, ou seja, são metais de transição com orbitais meio cheios.
Da mesma forma, os elementos dos quadrados roxos, embora passem de substâncias gasosas, de um líquido avermelhado e até de sólidos roxos pretos (iodo) e prata acinzentada (astatina), são suas propriedades químicas que os tornam congêneres. Essas propriedades são governadas pelas estruturas eletrônicas de seus átomos.
A organização e estrutura da tabela periódica não é arbitrária, mas obedece a uma série de propriedades periódicas e padrões de valores determinados para os elementos. Por exemplo, se o caractere metálico diminuir da esquerda para a direita na tabela, um elemento metálico não poderá ser esperado no canto superior direito.
Períodos
Os elementos são organizados em linhas ou períodos, dependendo do nível de energia de seus orbitais. Antes do período 4, quando os elementos se seguiam em ordem crescente da massa atômica, verificou-se que para cada oito deles as propriedades químicas eram repetidas (lei das oitavas, por John Newlands).
Os metais de transição se infiltraram com outros elementos não metálicos, como enxofre e fósforo. Por esse motivo, a entrada da física quântica e a das configurações eletrônicas para a compreensão das tabelas periódicas modernas foram vitais.
Os orbitais de uma camada de energia são preenchidos com elétrons (e os núcleos de prótons e nêutrons), à medida que viaja por um período. Essa camada de energia anda de mãos dadas com o tamanho ou raio atômico; portanto, os elementos dos períodos superiores são menores que os encontrados abaixo.
H e Ele se encontram no primeiro nível de energia (período); a primeira linha de quadrados cinza, no quarto período; e a linha de quadrados laranja, no sexto período. Observe que, embora o último pareça estar no suposto nono período, na verdade pertence ao sexto, logo após a caixa amarela de Ba.
Grupos
Passando por um período, a massa, o número de prótons e elétrons aumentam. Na mesma coluna ou grupo, embora a massa e os prótons variem, o número de elétrons na camada de valência é o mesmo.
Por exemplo, na primeira coluna ou grupo, H possui um único elétron no orbital 1s 1 , assim como Li (2s 1 ), sódio (3s 1 ), potássio (4s 1 ) e assim por diante. (7s 1 ). Esse número 1 indica que esses elementos mal possuem um elétron de valência e, portanto, pertencem ao grupo 1 (AI). Cada elemento está em períodos diferentes.
Sem contar o hidrogênio, com um quadrado verde, os elementos abaixo dele são quadrados laranja e são chamados de metais alcalinos. Mais uma caixa certa em qualquer período, é o grupo ou coluna 2; isto é, seus elementos têm dois elétrons de valência.
Porém, ao avançar um passo à direita, sem o conhecimento dos orbitais d, é atingido o grupo boro (B) ou o grupo 13 (IIIA); em vez do grupo 3 (IIIB) ou escândio (Sc). Considerando o preenchimento dos orbitais d, começam a ser percorridos os períodos dos quadrados cinzentos: os metais de transição.
Números de prótons versus elétrons de valência
Ao estudar a tabela periódica, pode surgir uma confusão entre o número atômico Z ou o número total de prótons no núcleo e a quantidade de elétrons de valência. Por exemplo, o carbono tem um Z = 6, ou seja, possui seis prótons e, portanto, seis elétrons (caso contrário, não poderia ser um átomo com carga neutra).
Mas, desses seis elétrons, quatro são de Valência . Por esse motivo, sua configuração eletrônica é [He] 2s 2 2p 2 . [I] representa as duas 1s electrões dois do invólucro fechado e, teoricamente, não participar na formação de ligações químicas .
Além disso, como o carbono possui quatro elétrons de valência, “convenientemente” ele está localizado no grupo 14 (IVA) da tabela periódica.
Elementos abaixo do carbono (Si, Ge, Sn, Pb e Fl) têm números atômicos mais altos (e massas atômicas); mas todos têm em comum os quatro elétrons de valência. Isso é fundamental para entender por que um elemento pertence a um grupo e não a outro.
Elementos da tabela periódica
Bloco S
Como acabamos de explicar, os grupos 1 e 2 são caracterizados por possuir um ou dois elétrons nos orbitais s. Esses orbitais são de geometria esférica e, à medida que desce através de qualquer um desses grupos, os elementos adquirem camadas que aumentam o tamanho de seus átomos.
Ao apresentar fortes tendências em suas propriedades químicas e formas de reação, esses elementos são organizados como o bloco s. Portanto, metais alcalinos e metais alcalino-terrosos pertencem a este bloco. A configuração eletrônica dos elementos deste bloco é ns (1s, 2s, etc.).
Embora o elemento hélio esteja no canto superior direito da tabela, sua configuração eletrônica é 1s 2 e, portanto, pertence a este bloco.
Bloco P
Diferentemente do bloco s, os elementos desse bloco têm orbitais completamente preenchidos, enquanto seus orbitais p continuam a se encher de elétrons. As configurações eletrônicas dos elementos pertencentes a esse bloco são do tipo ns 2 np 1-6 (os orbitais p podem ter um ou até seis elétrons para preencher).
Então, onde está na tabela periódica esse bloco? À direita: as caixas verdes, roxas e azuis; isto é, elementos não metálicos e metais pesados, como o bismuto (Bi) e o chumbo (Pb).
Começando com o boro, com a configuração eletrônica ns 2 np 1 , o carbono à direita adiciona outro elétron: 2s 2 2p 2 . A seguir, as configurações eletrônicas dos outros elementos do período 2 do bloco p são: 2s 2 2p 3 (nitrogênio), 2s 2 2p 4 (oxigênio), 2s 2 2p 5 (flúor) e 2s 2 2p 6 (neon).
Se diminuir para os períodos mais baixos, ele terá o nível de energia 3: 3s 2 3p 1-6 e assim por diante até o final do bloco p.
Observe que o mais importante desse bloco é que, a partir do período 4, seus elementos preencheram completamente os orbitais (caixas azuis à direita). Em resumo: o bloco s está à esquerda da tabela periódica e o bloco p, à direita.
Elementos representativos
Quais são os elementos representativos? São aqueles que, por um lado, perdem elétrons com facilidade ou, por outro, ganham para completar o byte de Valência. Em outras palavras: eles são os elementos dos blocos s e p.
Seus grupos foram distinguidos dos outros por uma letra A no final. Assim, havia oito grupos: do IA ao VIIIA. Atualmente, porém, o sistema de numeração usado nas tabelas periódicas modernas é o árabe, de 1 a 18, incluindo metais de transição.
Por esse motivo, o grupo boro pode ser o IIIA, ou 13 (3 + 10); o grupo carbono, IVA ou 14; e o dos gases nobres, o último à direita da tabela, VIIIA ou 18.
Metais de transição
Metais de transição são todos elementos de quadrados acinzentados. Durante seus períodos, seus orbitais d são preenchidos, que são cinco e, portanto, podem ter dez elétrons. Como eles devem ter dez elétrons para preencher esses orbitais, então deve haver dez grupos ou colunas.
Cada um desses grupos no antigo sistema de numeração foi designado com algarismos romanos e uma letra B no final. O primeiro grupo, o de escândio, foi o IIIB (3), o de ferro, cobalto e níquel VIIIB por ter reatividades muito semelhantes (8, 9 e 10) e o de zinco IIB (12).
Como pode ser visto, é muito mais fácil reconhecer grupos por números arábicos do que usando números romanos.
Metais de transição internos
A partir do período 6 da tabela periódica, os orbitais f começam a estar disponíveis energeticamente. Estes devem ser preenchidos primeiro que os orbitais d; e, portanto, seus elementos geralmente são separados para não alongar demais a tabela.
Os dois últimos períodos, laranja e cinza, são os metais de transição internos, também chamados de lantanídeos (terras raras) e actinídeos. Existem sete orbitais f, que precisam de quatorze elétrons para serem preenchidos e, portanto, devem haver quatorze grupos.
Se esses grupos forem adicionados à tabela periódica, haverá 32 no total (18 + 14) e haverá uma versão “alongada”:
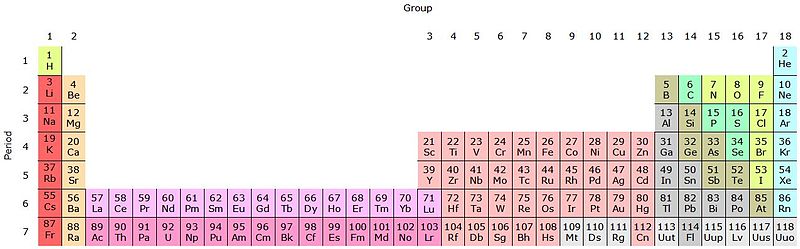
A linha rosa claro corresponde aos lantanóides, enquanto a linha rosa escura os actinóides. Lantânio, La com Z = 57, actínio, Ac com Z = 89, e todo o bloco f pertencem ao mesmo grupo de escândio. Porque Porque o escândio tem um orbital nd 1 , que está presente no restante dos lantanóides e actinóides.
La e Ac têm configurações de valência 5d 1 6s 2 e 6d 1 7s 2 . À medida que você se move para a direita pelas duas linhas, os orbitais 4f e 5f começam a se encher. Uma vez cheio, você chega aos elementos Lutécio, Lu e Laurenius, Lr.
Metais e não metais
Deixando para trás o bolo da tabela periódica, é mais conveniente recorrer ao da imagem superior, mesmo em sua forma alongada. No momento, a grande maioria dos elementos mencionados são metais.
À temperatura ambiente, todos os metais são substâncias sólidas (exceto mercúrio, líquido) de cor cinza prata (com exceção de cobre e ouro). Eles também são geralmente duros e brilhantes; embora os do bloco s sejam macios e frágeis. Esses elementos são caracterizados por sua facilidade de perda de elétrons e formação de cátions M + .
No caso dos lantanóides, eles perdem os três elétrons 5d 1 6s 2 para se tornarem cátions M 3+ trivalentes (como La 3+ ). Enquanto isso, o cério é capaz de perder quatro elétrons (Ce 4+ ).
Por outro lado, elementos não metálicos compõem a menor parte da tabela periódica. São gases ou sólidos com átomos ligados covalentemente (como enxofre e fósforo). Todos estão localizados no bloco p; mais precisamente, na parte superior, pois a descida para os períodos inferiores aumenta o caráter metálico (Bi, Pb, Po).
Além disso, os não-metais, em vez de perder elétrons, os conquistam. Assim, eles formam ânions X – com cargas negativas diferentes: -1 para os halogênios (grupo 17) e -2 para os calcógenos (grupo 16, o de oxigênio).
Famílias metálicas
Dentro dos metais, há uma classificação interna para diferenciá-los um do outro:
-Os metais do grupo 1 são alcalinos
-Grupo 2, metais alcalino-terrosos (Sr. Becambara)
Família do grupo 3 (IIIB) do escândio. Essa família é composta de escândio, chefe do grupo, ítrio Y, lantânio, actínio e todos os lantanóides e actinóides.
Grupo 4 (IVB), família de titânio: Ti, Zr (zircônio), Hf (háfnio) e Rf (rutherfordium). Quantos elétrons de valência eles possuem? A resposta está no seu grupo.
Grupo 5 (VB), família vanádio. Grupo 6 (VIB), família de cromo. E assim por diante até a família de zinco, grupo 12 (IIB).
Metalóides
O caractere metálico aumenta da direita para a esquerda e de cima para baixo. Mas qual é a fronteira entre esses dois tipos de elementos químicos? Essa borda é composta por elementos conhecidos como metalóides, que possuem características de metais e não metais.
Os metalóides podem ser vistos na tabela periódica na “escada” que começa com boro e termina no elemento radioativo astático. Esses elementos são:
-B: boro
-Silício: Sim
-Ge: germânio
-Como: arsênico
-Sb: antimônio
-Te: Telúrio
-At: astático
Cada um desses sete elementos exibe propriedades intermediárias, que variam de acordo com o ambiente químico ou a temperatura. Uma dessas propriedades é a semicondução, ou seja, os metalóides são semicondutores.
Gás
Em condições terrestres, os elementos gasosos são os metais não leves, como nitrogênio, oxigênio e flúor. Além disso, cloro, hidrogênio e gases nobres se enquadram nessa classificação. De todos eles, os mais emblemáticos são os gases nobres, devido à baixa tendência a reagir e se comportar como átomos livres.
Estes últimos estão no grupo 18 da tabela periódica e são:
-Hélio, ele
-Neon, Ne
-Argon, Ar
-krypton, Kr
-Xenon, Xe
-Radon, Rn
-E o mais recente de tudo, o gás nobre sintético oganesón, Og.
Todos os gases nobres têm em comum a configuração de valência ns 2 np 6 ; isto é, eles têm o octeto de Valência completo.
Estados de agregação dos elementos a outras temperaturas
Os elementos estão no estado sólido, líquido ou gasoso, dependendo da temperatura e da força de suas interações. Se a temperatura da Terra arrefecesse para cerca de zero absoluto (0K), todos os elementos congelariam; exceto o hélio, que condensaria.
A essa temperatura extrema, o restante dos gases estaria na forma de gelo.
No outro extremo, se a temperatura fosse de aproximadamente 6000K, “todos” os elementos estariam em um estado gasoso. Sob essas condições, nuvens de ouro, prata, chumbo e outros metais poderiam ser literalmente observados.
Usos e aplicações
A tabela periódica sozinha sempre foi e será uma ferramenta para consultar símbolos, massas atômicas, estruturas e outras propriedades dos elementos. É muito útil ao realizar cálculos estequiométricos, que são a ordem do dia em muitas tarefas dentro e fora do laboratório.
Não apenas isso, mas também a tabela periódica permite comparar os elementos do mesmo grupo ou período. Assim, pode-se prever como certos compostos dos elementos serão.
Previsão das fórmulas de óxidos
Por exemplo, para óxidos de metais alcalinos, porque eles têm apenas um elétron de valência e, portanto, uma valência de +1, é esperado que a fórmula de seus óxidos seja do tipo M 2 O. Isso é verificado com o óxido hidrogénio, água, H 2 O. também com o óxido de sódio, Na 2 O, e de potássio, K 2 O.
Para os outros grupos, seus óxidos devem ter uma fórmula geral M 2 O n , onde n é igual ao número do grupo (se o elemento for do bloco p, n-10 é calculado). Assim, o carbono, pertencente ao grupo 14, forma CO 2 (C 2 O 4/2 ); de enxofre, o grupo 16, SO 3 (S 2 O 6 /2); e nitrogênio, do grupo 15, N 2 O 5 .
No entanto, isso não se aplica aos metais de transição. Isso ocorre porque , embora o ferro pertença ao grupo 8, ele não pode perder 8 elétrons, mas 2 ou 3. Portanto, em vez de memorizar as fórmulas, é mais importante prestar atenção às valências de cada elemento.
Valores dos elementos
As tabelas periódicas (algumas) mostram as possíveis valências para cada elemento. Sabendo disso, a nomenclatura de um composto e sua fórmula química podem ser estimadas com antecedência. As valências, como mencionado acima, estão relacionadas ao número do grupo; Embora não seja aplicável a todos os grupos.
As valências dependem mais da estrutura eletrônica dos átomos e de quais elétrons eles podem realmente perder ou ganhar.
Ao conhecer o número de elétrons de valência, você também pode começar com a estrutura de Lewis de um composto a partir dessas informações. Portanto, a tabela periódica permite que estudantes e profissionais desenhem estruturas e dêem lugar a um levantamento de possíveis geometrias e estruturas moleculares.
Tabelas periódicas digitais
Hoje, a tecnologia permite que as tabelas periódicas sejam mais versáteis e forneçam mais informações disponíveis a todos. Vários deles trazem ilustrações impressionantes de cada elemento, além de um breve resumo de seus principais usos.
A maneira como você interage com eles acelera sua compreensão e estudo. A tabela periódica deve ser uma ferramenta agradável aos olhos, fácil de explorar e o método mais eficaz para conhecer seus elementos químicos é viajar de períodos para grupos.
Importância da tabela periódica
Atualmente, a tabela periódica é o instrumento mais importante da organização química devido às relações detalhadas de seus elementos.Seu uso é essencial para estudantes e professores, bem como para pesquisadores e muitos profissionais dedicados ao campo da química e engenharia.
Apenas olhando para a tabela periódica, você obtém uma quantidade enorme de informações de maneira rápida e eficiente, como:
– Lítio (Li), berílio (Be) e boro (B) conduzem eletricidade.
– O lítio é um metal alcalino, o berílio é um metal alcalino-terroso e o boro é não-metal.
– O lítio é o melhor condutor dos três nomeados, seguido por berílio e, finalmente, boro (semicondutor).
Assim, localizando esses elementos na tabela periódica, sua tendência à condutividade elétrica pode ser concluída instantaneamente.
Referências
- Scerri, E. (2007).A tabela periódica: sua história e seu significado . Oxford Nova York: Oxford University Press.
- Scerri, E. (2011).A tabela periódica: uma introdução muito curta . Oxford Nova York: Oxford University Press.
- Moore, J. (2003).Química para manequins . Nova York, NY: Wiley Pub.
- Venable, FP. (1896). O desenvolvimento da lei periódica. Easton, Pensilvânia: Chemical Publishing Company.
- Ball, P. (2002).Os ingredientes: uma visita guiada aos elementos . Oxford Nova York: Oxford University Press.
- Whitten, Davis, Peck e Stanley. Química (8a ed.). Aprendizagem CENGAGE.
- Sociedade Real de Química. (2018). Tabela Periódica. Recuperado de: rsc.org
- Richard C. Banks (Janeiro de 2001). A tabela periódica. Recuperado de: chemistry.boisestate.edu
- Physics 2000. (sf). A origem da tabela periódica. Recuperado de: physics.bk.psu.edu
- King K. & Nazarewicz W. (7 de junho de 2018). Existe um fim para a tabela periódica? Recuperado de: msutoday.msu.edu
- Dr. Doug Stewart. (2018). A tabela periódica. Recuperado de: chemicool.com
- Mendez A. (16 de abril de 2010). A tabela periódica de Mendeleev. Recuperado de: chemistry.laguia2000.com