O teste de catalase é uma técnica utilizada para determinar a presença da enzima catalase em uma amostra biológica. A catalase é uma enzima que tem a capacidade de decompor peróxido de hidrogênio em água e oxigênio, sendo essencial para proteger as células do estresse oxidativo.
Neste teste, a presença da enzima é detectada pela liberação de oxigênio gasoso quando a catalase atua sobre o peróxido de hidrogênio. A técnica consiste em adicionar peróxido de hidrogênio à amostra e observar a formação de bolhas de oxigênio.
Este teste é amplamente utilizado em laboratórios de biologia e bioquímica para identificar a presença de catalase em diferentes tipos de células e tecidos. Além disso, também é utilizado em estudos de microbiologia para diferenciar entre diferentes tipos de bactérias com base na presença ou ausência de catalase em suas células. Em resumo, o teste de catalase é uma ferramenta importante na investigação de processos biológicos e na identificação de microrganismos.
Finalidade do teste de catalase: descobrir a presença da enzima em diferentes organismos.
A finalidade do teste de catalase é verificar a presença da enzima catalase em diferentes organismos. A catalase é uma enzima que atua na decomposição do peróxido de hidrogênio em água e oxigênio, sendo essencial para a proteção das células contra danos oxidativos. Através deste teste, é possível identificar a presença da enzima em diversos microorganismos, auxiliando no diagnóstico de infecções e na determinação de características bioquímicas dos mesmos.
Para que serve a realização do teste da catalase?
O teste da catalase é uma ferramenta importante utilizada em laboratórios de microbiologia para identificar a presença da enzima catalase em diferentes tipos de microrganismos. A catalase é uma enzima que atua na decomposição do peróxido de hidrogênio em água e oxigênio, sendo essencial para a sobrevivência de muitas bactérias.
A realização do teste da catalase é fundamental para diferenciar entre bactérias que são capazes de produzir a enzima catalase e aquelas que não possuem essa capacidade. Isso é importante na identificação e classificação de diferentes tipos de bactérias, auxiliando na escolha do tratamento mais adequado em casos de infecções bacterianas.
Além disso, o teste da catalase também pode ser utilizado para verificar a viabilidade de determinadas amostras bacterianas, uma vez que a presença da enzima catalase está diretamente relacionada à atividade metabólica das bactérias. Portanto, a realização desse teste é essencial para garantir a precisão dos resultados obtidos em análises microbiológicas.
Em resumo, o teste da catalase é uma ferramenta importante na identificação de microrganismos e na escolha do tratamento adequado em casos de infecções bacterianas. Além disso, ele também é utilizado para verificar a viabilidade das amostras bacterianas, garantindo a confiabilidade dos resultados obtidos em laboratório.
A importância da enzima catalase positiva na proteção das células contra o estresse oxidativo.
A enzima catalase desempenha um papel fundamental na proteção das células contra o estresse oxidativo. Quando as células são expostas a altos níveis de radicais livres e peróxidos, a catalase atua como uma defesa antioxidante, convertendo o peróxido de hidrogênio em água e oxigênio, evitando danos celulares e protegendo a integridade do DNA.
A presença da enzima catalase positiva é essencial para manter o equilíbrio redox nas células e prevenir danos causados pelo estresse oxidativo. Sem essa enzima, as células ficariam mais suscetíveis à oxidação e ao envelhecimento precoce, além de aumentar o risco de doenças relacionadas ao estresse oxidativo, como câncer e doenças cardiovasculares.
Por meio do teste de catalase, é possível avaliar a atividade dessa enzima em diversas amostras biológicas, identificando indivíduos com deficiência de catalase e que estão mais propensos a sofrer com os efeitos prejudiciais do estresse oxidativo. Além disso, o teste de catalase também é utilizado em pesquisas científicas para investigar os mecanismos de defesa antioxidante e desenvolver novas estratégias terapêuticas para combater o estresse oxidativo.
Em resumo, a enzima catalase desempenha um papel crucial na proteção das células contra o estresse oxidativo, e a sua avaliação por meio do teste de catalase é fundamental para identificar indivíduos com maior risco de danos celulares e desenvolver estratégias de prevenção e tratamento.
Procedimento de realização da prova enzimática para identificação da catalase em laboratório.
No laboratório, a prova enzimática para identificação da catalase é realizada para detectar a presença da enzima catalase em determinado material biológico. A catalase é uma enzima que catalisa a decomposição do peróxido de hidrogênio em água e oxigênio, sendo fundamental para proteger as células de danos oxidativos.
O procedimento de realização da prova enzimática para identificação da catalase consiste em adicionar uma solução de peróxido de hidrogênio ao material biológico em estudo e observar a liberação de oxigênio. A presença da enzima catalase resulta na formação de bolhas de oxigênio, indicando a atividade enzimática.
Para realizar o teste de catalase, é necessário preparar uma solução de peróxido de hidrogênio e coletar o material biológico a ser testado. Em seguida, adiciona-se uma pequena quantidade do material biológico à solução de peróxido de hidrogênio e observa-se a formação de bolhas de oxigênio.
A presença de bolhas de oxigênio indica a presença da enzima catalase no material biológico em estudo. Este teste é importante para identificar a presença de catalase em diferentes organismos e tecidos, bem como para estudar a atividade enzimática em condições específicas.
Em resumo, o procedimento de realização da prova enzimática para identificação da catalase em laboratório é uma técnica simples e eficaz para detectar a presença desta enzima em materiais biológicos, sendo amplamente utilizada em pesquisas e diagnósticos em diversas áreas da biologia e medicina.
Teste de catalase: justificativa, técnica e usos
O teste da catalase é uma metodologia usada em laboratórios de bacteriologia para destacar a presença da enzima catalase nas bactérias que a possuem. J pique a coloração de Gram são os principais testes que você deve executar os microorganismos recentemente isoladas. Esses testes orientam o microbiologista sobre as etapas a seguir para a identificação definitiva do microrganismo em questão.
Em geral, as bactérias que contêm citocromo possuem a enzima catalase, ou seja, as bactérias aeróbias e anaeróbicas facultativas devem possuí-la. No entanto, existem exceções, como o Streptococcus, que, apesar de serem microrganismos anaeróbicos facultativos, não possuem a enzima catalase.
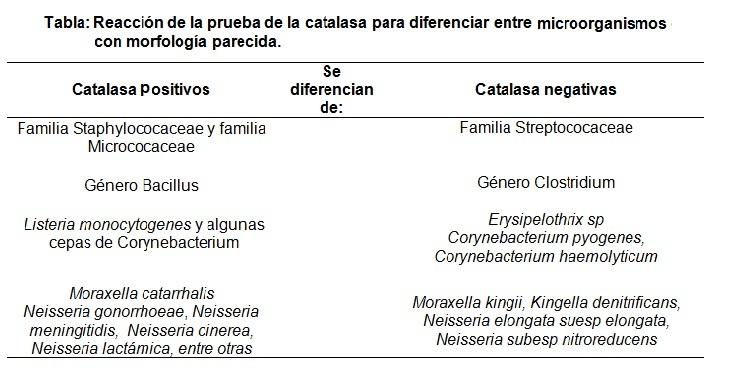
É por isso que o teste da catalase é usado principalmente para distinguir as famílias Staphylococaceae e Micrococaceae (ambas catalase positiva) da família Streptococaceae (catalase negativa).
Da mesma forma, o gênero Bacillus (catalase positiva) se distingue do gênero Clostridium (catalase negativa), entre outros.
Fundação
A catalase é uma enzima classificada como um hidroperoxidasa, isto significa utilizando como substrato de peróxido de hidrogénio (H 2 O 2 ).
Também é considerada uma oxidoredutase, pois na reação em que participa existe um elemento que serve como doador de elétrons (substância redutora) e outro como receptor de elétrons (substância oxidante).
A catalase é uma proteína que contém um grupo protético com quatro átomos de ferro trivalentes (Fe +++ ), por isso é uma homoproteína. O íon férrico permanece oxidado durante a reação.
Pode-se dizer que a catalase é uma enzima desintoxicante, pois sua função é eliminar as substâncias produzidas durante o metabolismo bacteriano que são tóxicas para as bactérias. Entre essas substâncias está o peróxido de hidrogênio.
O peróxido de hidrogênio é formado pela decomposição dos açúcares pela via aeróbica. Esse processo ocorre da seguinte maneira:
O íon superóxido (O 2 – ) ( radical livre) é formado como o produto final da assimilação de glicose pela via aeróbica. Isso é tóxico e é eliminado pela enzima superóxido dismutase que o transforma em oxigênio gasoso e peróxido de hidrogênio.
O peróxido de hidrogênio também é tóxico para as bactérias e deve ser eliminado. A enzima catalase desdobra o peróxido de hidrogênio em água e oxigênio.
A catalase pode atuar em substratos que não sejam peróxido de hidrogênio, como álcoois, aldeídos, ácidos, aminas aromáticas e fenóis. No entanto, o peróxido de hidrogênio também pode ser usado pela catalase para oxidar outros compostos tóxicos, como o álcool metílico e etílico.
Da mesma forma, a catalase está presente nas células fagocíticas, protegendo-a da ação tóxica do peróxido de hidrogênio.
Técnica de teste de rotina de catalase
Método -Slip
Materiais
3% de peróxido de hidrogênio (10 volumes).
Folha de slides
Cabo de plástico descartável ou bastão de madeira.
Procedimento
Tome o suficiente da colônia para estudar sem tocar no ágar de onde vem. A colônia deve ser fresca, ou seja, de uma colheita de 18 a 24 horas.
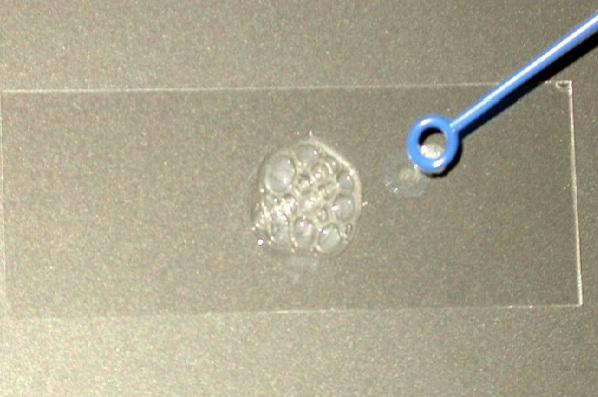
Coloque a colónia na mesma corrediça seco e adicionar uma gota de peróxido de hidrogénio a 3% (também pode utilizar H 2 O 2 30%). Observe imediatamente se as bolhas são liberadas ou não.
Interpretação
Reação positiva: evolução dos gases, evidenciada pela formação de bolhas (bolhas fortes).
Reação negativa: sem formação de bolhas.
Método direto em cultura pura
Colocar 1 ml de H 2 O 2 a 3% de uma cultura pura ou placas contendo sem manchas de sangue (de preferência nutriente de agar). Observe se há ou não formação de bolhas imediatamente. É também possível usar H 2 O 2 30%.
É interpretado da mesma forma que o método de suporte a objeto.
-Método com tubo capilar ou Fung e Petrishko
Encha um tubo capilar de 67 mm a uma altura de 20 mm com peróxido de hidrogênio a 3% por capilaridade.
Toque na colônia isolada que você deseja estudar com o capilar preenchido com 3% de H 2 O 2 . Observe se o capilar se enche de bolhas em aproximadamente 10 segundos. Este método permite semi-quantificar a reação em cruzamentos:
Sem cruzes não há bolhas (reação negativa).
+ –—- Poucas bolhas (reação fraca ou retardada).
++ – Bolhas abundantes (reação moderada).
+++ – As bolhas atingem o extremo oposto (reação energética).
-Taylor e Achanzar para testes de catalase que dão resultados duvidosos
Em uma lâmina de vidro limpa, seca colocada uma colónia isolada, em seguida, colocar uma gota de H 2 O 2 a 0,5% e cobrir com uma lamela. Observe se há ou não formação de bolhas presas.
Interpretação: a presença de bolhas indica uma reação positiva. Sem bolhas, é interpretado como uma reação negativa.
Teste de catalase para espécies de Mycobacterium
Essa técnica precisa ser feita controlando o pH e a temperatura. Ele deve ser executado sob uma cobertura de fluxo laminar, pois a manipulação das diferentes espécies de Mycobacterium é perigosa.
-Materiais
30% de peróxido de hidrogênio ou 110 volumes (superoxal).
Tampão de Fosfato pH 7
Tween 80 a 10%
Cultura de Mycobacterium em cunha 3 a 4 semanas
-Preparação de reagentes
Tampão de Fosfato pH 7
Pesar:
1,361 g de (KH 2 PO 4 ) fosfato monopotássico anidro.
1.420 g de fosfato dissódico anidro (Na2HPO3).
Dissolva ambos os sais em um pouco de água destilada estéril e complete com água até 1000 ml.
Tween 80 a 10%
Faça uma diluição 1:10 para o Tween 80 comercialmente concentrado, para fazer isso, faça o seguinte:
Tome 1 ml de Tween 80 e coloque-o em um pouco de água destilada, dissolva e complete o volume com água até 10 ml.
Reagente final
Misture uma quantidade de tampão fosfato com uma quantidade de Tween 80 a 10% (em partes iguais). Defina no laboratório quanto você deseja preparar.
-Procedimento
Coloque 5 ml de tampão fosfato em um tubo de ensaio estéril com uma tampa de rosca (baquelite).
Com uma alça de inoculação, pegue uma colônia suficiente de uma cunha semeada em Mycobacterium e dissolva-a no tampão fosfato.
Cubra o tubo sem apertar demais a linha. Coloque em banho-maria a 68 ° C por 20 a 30 minutos. Retire e deixe esfriar a 22-25 ° C
Meça 0,5 ml do reagente final (mistura) e adicione-o ao tubo com a solução fria. Observe a formação ou não de bolhas.
É interpretado da mesma forma que as técnicas anteriores.
Use
Quando um crescimento de colônia é obtido em meio enriquecido, uma coloração de Gram e um teste de catalase devem ser realizados nas colônias obtidas. Isso orientará o microbiologista sobre os procedimentos a serem seguidos para identificação definitiva.
Controle de qualidade
Para avaliar o bom funcionamento do reagente de peróxido de hidrogênio, use cepas de controle recém-cultivadas, como Staphylococcus aureus como controle positivo e Streptococcus sp como controle negativo.
Outra alternativa que serve como controle positivo é colocar uma gota de peróxido de hidrogênio no ágar sanguíneo; os eritrócitos possuem catalase; portanto, haverá uma borbulhagem se o reagente estiver em boas condições.
Um agar de chocolate pode ser usado como controle negativo, aqui os eritrócitos já estão lisados e o teste é negativo.
Limitações
-Não use culturas antigas para o teste, pois isso pode causar falsos negativos.
-Evite tomar colônias de culturas em ágar sangue, se for tomado cuidado para não tocar no ágar; Este procedimento pode causar falsos positivos, uma vez que os eritrócitos contêm catalase.
-Se você tomar a colônia com uma alça de platina, não inverta a ordem do procedimento, pois isso pode gerar falsos positivos. Isso ocorre porque a platina é capaz de reagir com peróxido de hidrogênio, causando bolhas.
-Não use o reagente de peróxido de hidrogênio se for muito antigo, pois o reagente é muito instável e tende a se decompor ao longo do tempo.
-Manter o reagente de peróxido de hidrogênio protegido da luz e na refrigeração para evitar danos.
-Faça um controle de qualidade do reagente de peróxido de hidrogênio sempre que for usado.
-Tendo em consideração que se a H é usado 2 O duas reacções de 30% são mais fortes do que as feitas com H 2 O 2 a 3%.
Referências
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnóstico microbiológico 5a ed. Editorial Panamericana SA Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnóstico microbiológico de Bailey & Scott. 12 ed. Editorial Panamericana SA Argentina.
- Mac Faddin J. (2003). Testes bioquímicos para a identificação de bactérias de importância clínica. 3rd ed. Editora Panamericana. Bons ares. Argentina
- Laboratórios BD Reagente Catalase-Gotario. Disponível em: http://winklerltda.cl
- Laboratórios Vadechemical. Água oxigenada. Equivalência entre volumes e porcentagem. Disponível em: vadequimica.com