A treonina é um dos aminoácidos essenciais para o organismo humano, o que significa que o corpo não consegue produzi-lo por conta própria e, portanto, é necessário obtê-lo através da alimentação. É fundamental para a síntese de proteínas, sendo importante para o crescimento e reparação dos tecidos. Além disso, a treonina desempenha um papel na regulação do sistema imunológico, na saúde do sistema nervoso e na produção de colágeno. Sua degradação ocorre através de processos metabólicos que convertem a treonina em outros compostos úteis para o organismo. Os benefícios da treonina incluem a manutenção da saúde dos tecidos, a regeneração muscular, o fortalecimento do sistema imunológico e a promoção da saúde da pele. É importante garantir a ingestão adequada deste aminoácido através de uma dieta balanceada e variada.
Importância da treonina para o organismo: descubra qual é sua principal função.
A treonina é um aminoácido essencial, ou seja, não pode ser sintetizado pelo organismo e precisa ser obtido através da alimentação. Sua principal função é atuar na síntese de proteínas, sendo fundamental para o crescimento e reparação dos tecidos do corpo.
Além disso, a treonina também está envolvida na produção de glicina e serina, aminoácidos que desempenham papéis importantes no sistema nervoso central. Ela é necessária para a formação de colágeno, elastina e tecido muscular, contribuindo assim para a saúde da pele, cabelos e unhas.
Quando o organismo não recebe quantidades adequadas de treonina, podem ocorrer deficiências nutricionais que afetam a saúde em geral. Entre os sintomas de deficiência de treonina estão a perda de peso, alterações no humor, fadiga e diminuição da imunidade.
Por outro lado, a suplementação de treonina pode trazer diversos benefícios para a saúde, como a melhoria da função hepática, a redução do estresse oxidativo e o fortalecimento do sistema imunológico. Ela também pode auxiliar na recuperação de lesões musculares e na manutenção da massa magra.
Por isso, é importante garantir a ingestão adequada desse aminoácido através da alimentação ou suplementação.
Qual é o papel da treonina no corpo humano e como ela atua?
A treonina é um dos aminoácidos essenciais para o corpo humano, o que significa que ele não pode ser produzido pelo organismo e deve ser obtido através da alimentação. Sua principal função é a síntese de proteínas, sendo fundamental para o crescimento e reparação dos tecidos do corpo.
Além disso, a treonina atua como precursora de importantes moléculas no organismo, como a serotonina, um neurotransmissor responsável pela regulação do humor, sono e apetite. Ela também desempenha um papel na produção de glicina e colina, substâncias essenciais para a saúde do sistema nervoso e muscular.
Quando o corpo não recebe a quantidade adequada de treonina, pode haver uma diminuição na síntese de proteínas, levando a perda de massa muscular e enfraquecimento dos tecidos. Além disso, a deficiência de treonina pode afetar a produção de neurotransmissores, resultando em problemas de humor e sono.
A treonina é degradada no organismo através de um processo conhecido como transaminação, no qual ela é convertida em outros compostos que podem ser utilizados como fonte de energia. A treonina também pode ser convertida em ácidos graxos, que são essenciais para a saúde cardiovascular e cerebral.
Entre os benefícios da treonina para o corpo humano, estão a regulação do humor, o fortalecimento dos tecidos, a melhoria da função cerebral e a saúde cardiovascular. Por isso, é importante garantir a ingestão adequada desse aminoácido através de uma alimentação balanceada e variada.
Onde encontrar a treonina na alimentação?
A treonina é um aminoácido essencial para o nosso organismo, desempenhando diversas funções importantes no corpo. Ela é um dos aminoácidos que compõem as proteínas, sendo fundamental para a síntese e manutenção dos tecidos musculares, além de participar do processo de produção de colágeno e elastina.
Para garantir a ingestão adequada de treonina, é importante incluir alimentos ricos nesse aminoácido na nossa alimentação. Alguns alimentos fontes de treonina são as carnes, peixes, ovos, laticínios, leguminosas, quinoa, semente de abóbora e semente de girassol.
Uma dieta equilibrada e variada é essencial para garantir a ingestão adequada de treonina e de outros nutrientes essenciais para o bom funcionamento do organismo. A deficiência de treonina pode levar a problemas de crescimento e desenvolvimento, fraqueza muscular, entre outros sintomas.
Além de sua importância na síntese proteica, a treonina também está envolvida no processo de degradação de aminoácidos, participando da formação de compostos que são eliminados do corpo. Ela também tem sido estudada por seus potenciais benefícios para a saúde, como por exemplo, a sua ação antioxidante e anti-inflamatória.
Portanto, é fundamental incluir alimentos ricos em treonina na nossa alimentação diária para garantir o bom funcionamento do organismo e a manutenção da saúde. Uma alimentação balanceada, aliada a hábitos saudáveis, é essencial para garantir a ingestão adequada desse importante aminoácido.
Localização da degradação dos aminoácidos no organismo humano.
A treonina é um aminoácido essencial que desempenha um papel fundamental no organismo humano. Ela é importante para a síntese de proteínas, formação de colágeno, produção de anticorpos e regulação do sistema imunológico. Além disso, a treonina está envolvida na produção de neurotransmissores e na manutenção da saúde do fígado.
Quando o organismo não consegue utilizar toda a treonina ingerida, ela passa por um processo de degradação. A degradação dos aminoácidos ocorre principalmente no fígado, onde são convertidos em compostos que podem ser utilizados como fonte de energia ou como precursores de outras moléculas essenciais para o funcionamento do corpo.
A treonina é convertida em alfa-cetoácidos, que podem ser transformados em intermediários do ciclo de Krebs para produção de energia. Além disso, a treonina também pode ser convertida em glicose através de um processo chamado gliconeogênese, que ocorre no fígado.
É importante garantir uma ingestão adequada de treonina para manter o bom funcionamento do organismo e garantir a saúde geral. A deficiência de treonina pode levar a problemas de crescimento, comprometimento do sistema imunológico e desequilíbrios hormonais.
Sua degradação ocorre principalmente no fígado, onde é convertida em compostos que podem ser utilizados como fonte de energia ou como precursores de outras moléculas essenciais. Certifique-se de incluir alimentos ricos em treonina em sua dieta para garantir uma boa saúde e funcionamento do corpo.
Treonina: características, funções, degradação, benefícios
A treonina (Thr, T) ou-LS-α-amino-butírico ácido β-treo é um dos aminoácidos constituintes das proteínas celulares. Como o homem e outros animais vertebrados não possuem vias biossintéticas para sua produção, a treonina é considerada um dos nove aminoácidos essenciais que devem ser adquiridos com a dieta.
A treonina foi o último dos 20 aminoácidos comuns descobertos nas proteínas, fato que ocorreu na história mais de um século após a descoberta da asparagina (1806), que foi o primeiro aminoácido descrito.
Foi descoberto por William Cumming Rose em 1936, que cunhou o termo “treonina” devido à semelhança estrutural que encontrou entre esse aminoácido e o ácido treônico, um composto derivado do açúcar de treose.
Como aminoácido proteico, a treonina tem múltiplas funções nas células, incluindo o local de ligação para as cadeias de carboidratos típicas das glicoproteínas e o local de reconhecimento das proteínas cinases com funções específicas (proteínas treonina / serina quinase).
Da mesma forma, a treonina é um componente essencial de proteínas como esmalte dentário, elastina e colágeno e também possui funções importantes no sistema nervoso. É usado como um complemento nutricional e como um “mitigador” dos estados fisiológicos de ansiedade e depressão.
Caracteristicas
A treonina pertence ao grupo de aminoácidos polares que possuem um grupo R ou cadeia lateral sem cargas positivas ou negativas (aminoácidos polares não carregados).
As características de seu grupo R o tornam um aminoácido altamente solúvel em água (hidrofílico ou hidrofílico), o que também é válido para os outros membros desse grupo, como cisteína, serina, asparagina e glutamina.
Juntamente com o triptofano, fenilalanina, isoleucina e tirosina, a treonina é um dos cinco aminoácidos que possui funções glicogênicas e cetogênicas, uma vez que, a partir de seu metabolismo, são produzidos intermediários relevantes, como piruvato e succinil-CoA.
Este aminoácido tem um peso molecular aproximado de 119 g / mol; Como muitos aminoácidos não carregados, possui um ponto isoelétrico em torno de 5,87 e sua frequência nas estruturas de proteínas é próxima de 6%.
Alguns autores agrupam treonina juntamente com outros aminoácidos de sabor “doce”, entre os quais, por exemplo, serina, glicina e alanina.
Estrutura
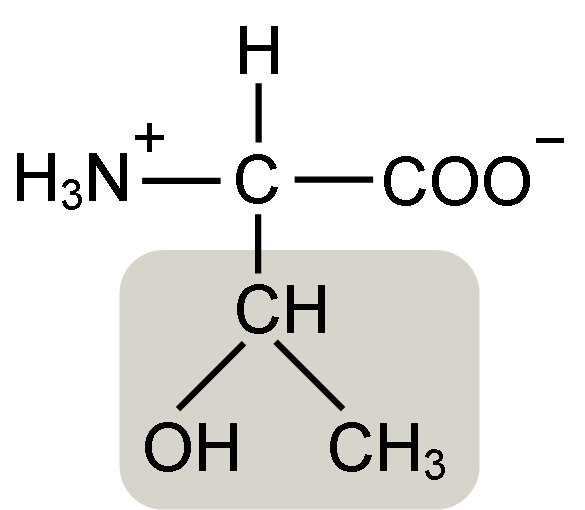
Os aminoácidos Α como a treonina têm uma estrutura geral, isto é, é comum a todos. Isso se distingue pela presença de um átomo de carbono conhecido como “carbono α”, que é quiral e ao qual estão ligados quatro tipos diferentes de moléculas ou substituintes.
Esse carbono compartilha uma de suas ligações com um átomo de hidrogênio, outra com o grupo R, característico de cada aminoácido, e os outros dois são ocupados pelos grupos amino (NH2) e carboxil (COOH), comuns a todos os aminoácidos
O grupo treonina R possui um grupo hidroxila que permite formar ligações de hidrogênio com outras moléculas em meio aquoso. Sua identidade pode ser definida como um grupo alcoólico (etanol, de dois átomos de carbono), que perdeu um de seus hidrogênios para ligar o átomo de carbono α (-CHOH-CH3).
Esse grupo -OH pode servir como uma “ponte” ou local de ligação para uma ampla variedade de moléculas (cadeias de oligossacarídeos podem ser ligadas a ele durante a formação de glicoproteínas), por isso é um dos responsáveis pela formação de derivados modificados de treonina.
A forma biologicamente ativa desse aminoácido é a L-treonina e é essa que participa tanto na conformação das estruturas proteicas quanto nos vários processos metabólicos em que atua.
Funções
Como aminoácido proteico, a treonina faz parte da estrutura de muitas proteínas da natureza, onde sua importância e riqueza dependem da identidade e função da proteína à qual pertence.
Além de suas funções estruturais na conformação da sequência peptídica de proteínas, a treonina cumpre outras funções tanto no sistema nervoso quanto no fígado, onde participa do metabolismo da gordura e impede seu acúmulo neste órgão.
A treonina faz parte das seqüências reconhecidas pelas enzimas serina / treonina quinase, responsáveis por inúmeros processos de fosforilação de proteínas, essenciais para a regulação da multiplicidade de funções e eventos de sinalização intracelular.
Também é usado no tratamento de alguns distúrbios intestinais e digestivos e provou sua utilidade na atenuação de condições patológicas, como ansiedade e depressão.
Da mesma forma, a L-treonina é um dos aminoácidos necessários para manter o estado pluripotente das células-tronco embrionárias de camundongo, fato aparentemente relacionado ao metabolismo dos eventos de metilação da S-adenosil-metionina e da histona , que estão diretamente envolvidos na expressão de genes.
Na indústria
Uma propriedade comum para muitos aminoácidos é sua capacidade de reagir com outros grupos químicos, como aldeídos ou cetonas, para a formação dos “sabores” característicos de muitos compostos.
Entre esses aminoácidos está a treonina, que, como a serina, reage com a sacarose durante a torrefação de certos alimentos e dá origem a “pirazinas”, compostos aromáticos típicos de produtos torrados, como o café.
A treonina está presente em muitos medicamentos de origem natural e também em muitas formulações de suplementos alimentares prescritos para pacientes com desnutrição ou que possuem dietas pobres nesse aminoácido.
Outra das funções mais notórias da L-treonina, e que vem crescendo ao longo do tempo, é a do aditivo na preparação de alimentos concentrados para as indústrias de produção de porcos e aves.
A L-treonina é usada nessas indústrias como um complemento nutricional em formulações pobres em proteínas, uma vez que isso fornece vantagens econômicas e alivia as deficiências de proteína bruta consumida por esses animais de fazenda.
A principal forma de produção desse aminoácido é, normalmente, por fermentação microbiana e os números da produção mundial para fins agrícolas para o ano de 2009 ultrapassaram 75 toneladas.
Biossíntese
A treonina é um dos nove aminoácidos essenciais para o homem, o que significa que não pode ser sintetizado pelas células do corpo e, portanto, deve ser adquirido a partir de proteínas animais ou vegetais fornecidas com o dieta diária
Plantas, fungos e bactérias sintetizam treonina a partir de rotas semelhantes que podem apresentar algumas discrepâncias entre si. No entanto, a maioria desses organismos deixa o aspartato como precursor, não apenas para a treonina, mas também para a metionina e a lisina.
Caminho biossintético em micróbios
A via de biossíntese da L-treonina em microorganismos como bactérias consiste em cinco etapas catalisadas por diferentes enzimas. O substrato inicial, como mencionado, é o aspartato, que é fosforilado por uma enzima aspartato-quinase dependente de ATP.
Essa reação produz o metabólito L-aspartil fosfato (L-aspartil-P) que serve como substrato da enzima aspartil semialdeído desidrogenase, que catalisa sua conversão em aspartil semialdeído de maneira dependente de NADPH.
O aspartil semialdeído pode ser usado tanto para a biossíntese de L-lisina quanto para a biossíntese de L-treonina; Neste caso, a molécula é empregada por uma enzima homoserina desidrogenase dependente de NADPH para a produção de L-homoserina.
A L-homoserina é fosforilada em L-homoserina fosfato (L-homoserina-P) por uma homoserina-quinase dependente de ATP e o referido produto da reação, por sua vez, é um substrato para a enzima treonina sintetase, capaz de sintetizar L-treonina.
A L-metionina pode ser sintetizada a partir da L-homoserina produzida na etapa anterior, portanto representa uma via “competitiva” para a síntese de L-treonina.
A L-treonina sintetizada dessa maneira pode ser usada para síntese de proteínas ou também pode ser usada a jusante para a síntese de glicina e L-leucina, dois aminoácidos também relevantes do ponto de vista da proteína.
Regulamento
É importante notar que três das cinco enzimas que participam da biossíntese de L-treonina em bactérias são reguladas pelo produto da reação por feedback negativo. Estas são aspartato-quinase, homoserina desidrogenase e homoserina-quinase.
Além disso, a regulação dessa rota biossintética também depende dos requisitos celulares de outros produtos biossintéticos relacionados a ela, uma vez que a formação de L-lisina, L-metionina, L-isoleucina e glicina depende da rota de produção de L-treonina
Degradação
A treonina pode ser degradada por duas vias diferentes para produzir piruvato ou succinil-CoA. Este último é o produto mais importante do catabolismo da treonina em humanos.
O metabolismo da treonina ocorre principalmente no fígado, mas o pâncreas, embora em menor grau, também participa desse processo. Essa rota começa com o transporte do aminoácido através da membrana plasmática dos hepatócitos por meio de transportadores específicos.
Produção de piruvato a partir de treonina
A conversão da treonina em piruvato ocorre graças à sua transformação em glicina, que ocorre em duas etapas catalíticas que começam com a formação de 2-amino-3-cetobutirato a partir da treonina e pela ação da enzima treonina desidrogenase.
Nos seres humanos, essa rota representa apenas entre 10 e 30% do catabolismo da treonina, no entanto, sua importância é relativa ao organismo considerado, já que, em outros mamíferos, por exemplo, isso é muito mais relevante para o catabolismo conversando
Produção de succinil-CoA a partir de treonina
Assim como a metionina, valina e isoleucina, os átomos de carbono da treonina também são utilizados para a produção de succunil-CoA. Este processo começa com a conversão do aminoácido em α-cetobutirato, que é subsequentemente usado como substrato para a enzima α-cetoácido desidrogenase para produzir propionil-CoA.
A transformação da treonina em α-cetobutirato é catalisada pela enzima treonina desidratase, que implica a perda de uma molécula de água (H2O) e outra de um íon amônio (NH4 +).
O propionil-CoA é carboxilado em metilmalonil-CoA através de uma reação em duas etapas que requer a entrada de um átomo de carbono na forma de bicarbonato (HCO3-). Este produto serve como substrato para uma metilmalonil-CoA mutase-coenzima B12 dependente, que “epimeriza” a molécula para produzir succinil-CoA.
Outros produtos catabólicos
Além disso, o esqueleto de carbono da treonina pode ser usado catabolicamente para a produção de acetil-CoA, que também tem importantes implicações energéticas nas células do corpo.
Em certos organismos, a treonina também funciona como substrato para algumas vias biossintéticas, como a isoleucina, por exemplo. Neste caso, através de 5 etapas catalíticas, o α-cetobutirato derivado do catabolismo da treonina pode ser direcionado para a formação de isoleucina.
Alimentos ricos em treonina
Embora a maioria dos alimentos ricos em proteínas possua uma certa porcentagem de todos os aminoácidos, foi determinado que ovos, leite, soja e gelatina são especialmente ricos no aminoácido treonina.
A treonina também é encontrada na carne de animais como frango, porco, coelho, cordeiro e diferentes tipos de aves. Nos alimentos à base de plantas, é abundante em repolho, cebola, alho, acelga e berinjela.
Também é encontrado no arroz, milho, farelo de trigo, grãos de leguminosas e em muitas frutas, como morangos, bananas, uvas, abacaxi, ameixas e outras nozes ricas em proteínas, como nozes ou Pistácios, entre outros.
Benefícios da sua ingestão
De acordo com o comitê de especialistas da Organização Mundial de Saúde para Alimentação e Agricultura (OMS, FAO), a necessidade diária de treonina para um ser humano adulto médio é de cerca de 7 mg por quilograma de peso corporal, o que deve ser adquiridos a partir de alimentos ingeridos com a dieta.
Esses números são derivados de dados experimentais obtidos de estudos realizados com homens e mulheres, nos quais essa quantidade de treonina é suficiente para obter um balanço positivo de nitrogênio nas células do corpo.
No entanto, estudos realizados com crianças entre 6 meses e um ano de idade mostraram que, para estes, os requisitos mínimos de L-treonina estão entre 50 e 60 mg por quilograma de peso por dia.
Entre os principais benefícios da ingestão de suplementos nutricionais ou medicamentos com formulações especiais ricas em L-treonina estão o tratamento da esclerose amiotrófica lateral ou da doença de Lou Gehrig.
O suprimento adicional de treonina favorece a absorção de nutrientes no intestino e também contribui para a melhoria das funções hepáticas. Também é importante para o transporte de grupos fosfato através das células.
Distúrbios de deficiência
Em crianças pequenas, existem defeitos naturais no metabolismo da treonina que causam crescimento atrofiado e outros distúrbios metabólicos relacionados.
Deficiências nesse aminoácido têm sido associadas a algumas falhas no ganho de peso infantil, além de outras patologias relacionadas à falta de retenção de nitrogênio e à perda de urina.
Os seres humanos submetidos a dietas pobres em treonina podem ter uma maior propensão a sofrer de fígado gorduroso e algumas infecções intestinais relacionadas a esse aminoácido.
Referências
- Barret, G. e Elmore, D. (2004). Aminoácidos e Peptídeos . Cambridge: Cambridge University Press.
- Borgonha, S., Regan, MM, Oh, SH, Condon, M., & Young, VR (2002). Exigência de treonina em adultos saudáveis, derivada de uma técnica de equilíbrio de aminoácidos indicador de 24 horas. American Journal of Clinical Nutrition , 75 (4), 698-704.
- Bradford, H. (1931). A história da descoberta dos aminoácidos. II Uma revisão dos aminoácidos descritos desde 1931 como componentes de proteínas nativas. Advances in Protein Chemistry , 81-171.
- Champe, P. & Harvey, R. (2003). Aminoácidos Aminoácidos. Nas Revisões Ilustradas de Lippincott: Bioquímica (3ª ed., Pp. 1–12). Lippincott
- De Lange, CFM, Gillis, AM e Simpson, GJ (2001). Influência da ingestão de treonina na deposição de proteínas de corpo inteiro e utilização de treonina em porcos em crescimento alimentados com dietas purificadas. Journal of Animal Science , 79 , 3087-3095.
- Edelman, A., Blumenthal, D., & Krebs, E. (1987). Proteína Serina / Treonina Quinases. Annu Rev. , 56 , 567–613.
- Edsall, J. (1960). Aminoácidos, proteínas e bioquímica do câncer (Vol. 241). Londres: Academic Press, Inc.
- House, JD, Hall, BN e Brosnan, JT (2001). Metabolismo da treonina em hepatócitos de ratos isolados. American Journal of Physiology – Endocrinology and Metabolism , 281 , 1300–1307.
- Hudson, B. (1992). Bioquímica de proteínas alimentares . Springer-Science + Business Media, BV
- Kaplan, M. & Flavin, M. (1965). Biossíntese de treonina. No Caminho dos Fungos e Bactérias e o Mecanismo da Reação de Isomerização. O Journal of Biological Chemistry , 240 (10), 3928-3933.
- Kidd, M. & Kerr, B. (1996). L-Treonina para Aves: uma Revisão. Applied Poultry Science, Inc. , pp. 358–367.
- Pratt, E., Snyderman, S., Cheung, M., Norton, P., & Holt, E. (1954). A exigência de treonina do bebê normal. The Journal of Nutrition , 10 (56), 231-251.
- Rigo, J. & Senterre, J. (1980). Consumo ideal de treonina para bebês prematuros alimentados com nutrição oral ou parenteral. Journal of Parenteral and Enteral Nutrition , 4 (1), 15–17.
- Shyh-Chang, N., Locasale, JW, Lyssiotis, CA, Zheng, Y., Teo, RY, Ratanasirintrawoot, S.,… Cantley, LC (2013). Influência do metabolismo da treonina na S-adenosilmetionina e na metilação da histona. Science , 339 , 222-226.
- Vickery, HB, & Schmidt, CLA (1931). A história da descoberta dos aminoácidos. Chemical Reviews , 9 (2), 169-318.
- Web MD. (nd) Recuperado em 10 de setembro de 2019, em www.webmd.com/vitamins/ai/ingredientmono-1083/threonine
- Wormser, EH e Pardee, AB (1958). Regulação da biossíntese de treonina em Escherichia coli. Arquivos de Bioquímica e Biofísica , 78 (2), 416-432.
- Xunyan, X., Quinn, P. & Xiaoyuan, X. (2012). Portão de Pesquisa Recuperado em 10 de setembro de 2019, de www.researchgate.net/figure/The-biosynthesis-pathway-of-L-threonine-The-pathway-consists-of-fi-ve-enzymatic-steps_fig1_232320671