Links interatômicos são as forças que mantêm os átomos unidos em uma estrutura sólida. Eles são responsáveis por determinar as propriedades físicas e químicas dos materiais e desempenham um papel fundamental na estabilidade e no comportamento dos sólidos. Existem diferentes tipos de links interatômicos, como ligações iônicas, covalentes, metálicas e de Van der Waals, cada um com suas próprias características e propriedades distintas. Neste artigo, exploraremos os diferentes tipos de links interatômicos e suas principais características.
Tipos de interações entre átomos: conheça as diferentes forças que atuam entre eles.
Os átomos interagem entre si por meio de forças que mantêm as substâncias unidas. Essas interações são fundamentais para entendermos as propriedades dos materiais e como eles se comportam em diferentes situações. Existem diferentes tipos de interações interatômicas, cada uma com características específicas.
Uma das principais forças que atuam entre os átomos é a ligação iônica, que ocorre entre átomos com cargas elétricas opostas. Nesse tipo de interação, um átomo doa elétrons para outro, formando íons positivos e negativos que se atraem mutuamente. Essa ligação ocorre em compostos iônicos, como o cloreto de sódio (NaCl).
Outra forma de interação entre átomos é a ligação covalente, na qual os átomos compartilham elétrons para completar suas camadas de valência. Essa ligação é mais comum em compostos moleculares, como a água (H2O) e o dióxido de carbono (CO2).
Além disso, temos a ligação metálica, que ocorre em metais e é responsável por suas propriedades únicas, como maleabilidade e condutividade elétrica. Nesse tipo de ligação, os átomos metálicos compartilham elétrons em uma “nuvem” eletrônica comum.
Essas são apenas algumas das principais interações interatômicas que ocorrem na natureza. Cada uma delas possui características específicas e influencia diretamente as propriedades dos materiais. É importante compreender essas forças para entendermos melhor o mundo ao nosso redor e desenvolver novos materiais com propriedades específicas.
Descubra os quatro tipos de ligações químicas existentes na natureza.
As ligações químicas são interações entre átomos que resultam na formação de moléculas e compostos. Existem quatro tipos principais de ligações químicas na natureza: iônica, covalente, metálica e de hidrogênio.
A ligação iônica ocorre quando átomos ganham ou perdem elétrons para formar íons. Estes íons de cargas opostas se atraem, resultando na formação de um composto iônico. Um exemplo comum de ligação iônica é o sal de cozinha, formado por íons de sódio e cloreto.
A ligação covalente ocorre quando dois átomos compartilham pares de elétrons. Este tipo de ligação é comum em compostos orgânicos, como a água, onde os átomos de hidrogênio e oxigênio compartilham elétrons para formar a molécula.
A ligação metálica ocorre em metais, onde os elétrons estão livres para se mover entre os átomos. Isso resulta em uma estrutura cristalina, com os átomos formando uma “nuvem” de elétrons ao redor deles. Esta ligação é responsável por propriedades como condutividade elétrica e maleabilidade dos metais.
Por fim, a ligação de hidrogênio é uma interação fraca que ocorre entre moléculas polares, como a água. Neste tipo de ligação, um átomo de hidrogênio ligado a um átomo eletronegativo forma uma ligação com outro átomo eletronegativo, resultando em uma atração entre as moléculas.
Em resumo, os quatro tipos de ligações químicas existentes na natureza são: iônica, covalente, metálica e de hidrogênio. Cada tipo de ligação tem suas características e propriedades únicas, contribuindo para a diversidade de compostos químicos encontrados na natureza.
Tipos de ligações dentro das moléculas: conheça os diferentes tipos de interações moleculares.
As ligações dentro das moléculas são responsáveis por manter os átomos unidos e determinar as propriedades químicas das substâncias. Existem diferentes tipos de interações moleculares que podem ocorrer, cada uma com características específicas.
Entre os principais tipos de ligações interatômicas estão as ligações iônicas, covalentes e metálicas. Nas ligações iônicas, ocorre a transferência de elétrons entre átomos de diferentes elementos, resultando na formação de íons positivos e negativos que se atraem mutuamente. Já nas ligações covalentes, os átomos compartilham pares de elétrons para completar suas camadas de valência. Por fim, nas ligações metálicas, os elétrons estão livres para se moverem entre os átomos, formando uma “nuvem” de elétrons que mantém os átomos unidos.
Além desses tipos de ligações, também existem as interações moleculares mais fracas, como as ligações de hidrogênio e as forças de Van der Waals. As ligações de hidrogênio ocorrem entre átomos de hidrogênio ligados a átomos muito eletronegativos, como o oxigênio e o nitrogênio, resultando em uma interação relativamente forte. Já as forças de Van der Waals são interações mais fracas que surgem devido a flutuações temporárias na distribuição de cargas elétricas nos átomos.
Em resumo, os diferentes tipos de ligações interatômicas são fundamentais para compreender as propriedades das substâncias e como elas se comportam em reações químicas. Cada tipo de ligação possui características específicas que determinam sua força e natureza, influenciando diretamente o comportamento das moléculas.
Características da ligação iônica: o que você precisa saber sobre essa interação química.
Características da ligação iônica: A ligação iônica é uma interação química que ocorre entre átomos de elementos com diferenças significativas de eletronegatividade. Nesse tipo de ligação, um átomo cede elétrons para outro, formando íons positivos e negativos que se atraem mutuamente. Essa atração eletrostática é responsável por manter os átomos unidos na forma de compostos iônicos.
Uma das principais características da ligação iônica é a formação de íons. Os átomos envolvidos na ligação perdem ou ganham elétrons para alcançar a estabilidade eletrônica, resultando em íons com cargas opostas. Os íons positivos, conhecidos como cátions, são formados pelos átomos que perderam elétrons, enquanto os íons negativos, chamados ânions, são resultantes daqueles que ganharam elétrons.
Outra característica importante da ligação iônica é a alta energia de ligação. Devido à forte atração entre os íons de cargas opostas, os compostos iônicos geralmente possuem pontos de fusão e ebulição elevados. Além disso, a ligação iônica é muito forte e requer uma quantidade significativa de energia para ser quebrada.
Os compostos iônicos também apresentam condutividade elétrica em solução aquosa ou em estado fundido. Isso ocorre porque os íons livres podem se mover e conduzir a corrente elétrica. No entanto, os compostos iônicos só são condutores quando estão em estado líquido ou em solução, já que no estado sólido os íons estão fixos em posições específicas na estrutura cristalina.
Em resumo, a ligação iônica é uma interação química que envolve a transferência de elétrons entre átomos, resultando na formação de íons que se atraem mutuamente. Essa ligação é caracterizada pela formação de íons, alta energia de ligação e condutividade elétrica em solução aquosa ou em estado fundido.
Links interatômicos: características e tipos
A ligação interatômica é a ligação química que se forma entre os átomos para produzir moléculas.
Embora os cientistas agora geralmente concordem que os elétrons não giram em torno do núcleo, ao longo da história, pensou-se que cada elétron orbitasse em torno do núcleo de um átomo em uma camada separada.
Hoje, os cientistas concluíram que os elétrons pairam em áreas específicas do átomo e não formam órbitas; no entanto, a camada de valência ainda é usada para descrever a disponibilidade de elétrons.
Linus Pauling contribuiu para a compreensão moderna do vínculo químico escrevendo o livro “A natureza do vínculo químico”, onde compilou idéias de Sir Isaac Newton , Étienne François Geoffroy, Edward Frankland e, em particular, Gilbert N. Lewis.
Nele, ele vinculou a física da mecânica quântica à natureza química das interações eletrônicas que ocorrem quando são feitas ligações químicas.
O trabalho de Pauling concentrou-se em estabelecer que ligações iônicas verdadeiras e ligações covalentes estão localizadas nas extremidades de um espectro de ligação e que a maioria das ligações químicas é classificada entre esses extremos.
Pauling também desenvolveu uma escala móvel do tipo de vínculo governado pela eletronegatividade dos átomos participantes do vínculo.
As imensas contribuições de Pauling à nossa compreensão moderna do vínculo químico o levaram a receber o Prêmio Nobel de 1954 por “pesquisa sobre a natureza do vínculo químico e sua aplicação na elucidação da estrutura de substâncias complexas”.
Os seres vivos são compostos de átomos, mas na maioria dos casos, esses átomos não apenas flutuam individualmente. Em vez disso, eles normalmente estão interagindo com outros átomos (ou grupos de átomos).
Por exemplo, os átomos podem ser conectados por fortes ligações e organizados em moléculas ou cristais. Ou eles podem formar laços fracos e temporários com outros átomos que colidem com eles.
Tanto as ligações fortes que ligam as moléculas quanto as ligações fracas que criam conexões temporárias são essenciais para a química de nossos corpos e para a existência da própria vida.
Os átomos tendem a se organizar nos padrões mais estáveis possíveis, o que significa que eles tendem a completar ou preencher suas órbitas elétricas mais externas.
Eles se juntam a outros átomos para fazer exatamente isso. A força que mantém os átomos juntos em coleções conhecidas como moléculas é conhecida como ligação química.
Tipos de ligações químicas interatômicas
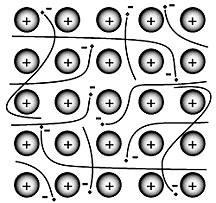
Ligação metálica
A ligação metálica é a força que mantém os átomos juntos em uma substância metálica pura. Esse sólido consiste em átomos compactados.
Na maioria dos casos, a camada de elétrons mais externa de cada um dos átomos de metal se sobrepõe a um grande número de átomos vizinhos.
Como conseqüência, os elétrons de valência se movem continuamente de um átomo para outro e não estão associados a nenhum par específico de átomos (Encyclopædia Britannica, 2016).
Os metais têm várias qualidades únicas, como a capacidade de conduzir eletricidade, baixa energia de ionização e baixa eletronegatividade (de modo que eles desistem rapidamente dos elétrons, ou seja, são cátions).
Suas propriedades físicas incluem uma aparência brilhante (brilhante) e são maleáveis e dúcteis. Os metais têm uma estrutura cristalina. No entanto, os metais também são maleáveis e dúcteis.
Na década de 1900, Paul Drüde surgiu com a teoria do mar de elétrons modelando metais como uma mistura de núcleos atômicos (núcleos atômicos = núcleos positivos = camada positiva + camada interna de elétrons) e elétrons de valência.
Nesse modelo, os elétrons de valência são livres, deslocalizados, móveis e não estão associados a nenhum átomo em particular (Clark, 2017).
Ligação iônica
As ligações iônicas são de natureza eletrostática. Eles ocorrem quando um elemento com carga positiva se liga a um com carga negativa devido a interações coulômbicas.
Elementos com baixas energias de ionização tendem a perder elétrons facilmente, enquanto elementos com alta afinidade eletrônica tendem a ganhá-los produzindo cátions e ânions respectivamente, que são os que formam as ligações iônicas.
Os compostos que mostram ligações iônicas formam cristais iônicos nos quais íons de cargas positivas e negativas oscilam próximos um do outro, mas nem sempre existe uma correlação direta 1-1 entre os íons positivos e negativos.
As ligações iônicas podem tipicamente ser quebradas por hidrogenação ou pela adição de água a um composto (Wyzant, Inc., SF).
Substâncias que são mantidas juntas por ligações iônicas (como cloreto de sódio) geralmente podem ser separadas em íons carregados verdadeiros quando uma força externa age sobre elas, como quando se dissolvem na água.
Além disso, na forma sólida, os átomos individuais não são atraídos para um vizinho individual, mas formam redes gigantes que se atraem por interações eletrostáticas entre o núcleo de cada átomo e os elétrons de valência vizinhos.
A força de atração entre os átomos vizinhos fornece aos sólidos iônicos uma estrutura extremamente ordenada, conhecida como grade iônica, onde partículas com carga oposta se alinham para criar uma estrutura rígida (Anthony Capri, 2003).
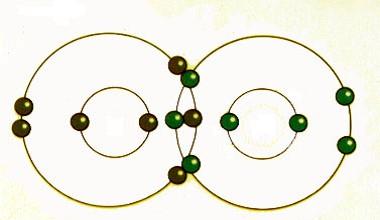
Ligação covalente
A ligação covalente ocorre quando pares de elétrons são compartilhados por átomos. Os átomos se ligam covalentemente com outros átomos para obter mais estabilidade, o que é obtido através da formação de uma camada completa de elétrons.
Ao compartilhar seus elétrons mais externos (valência), os átomos podem preencher sua camada externa de elétrons e ganhar estabilidade.
Embora se diga que os átomos compartilham elétrons quando formam ligações covalentes, eles geralmente não compartilham elétrons igualmente. Somente quando dois átomos do mesmo elemento formam uma ligação covalente os elétrons compartilhados são realmente compartilhados igualmente entre os átomos.
Quando átomos de diferentes elementos compartilham elétrons através da junção covalente, o elétron é atraído mais para o átomo com a maior eletronegatividade, resultando em uma ligação covalente polar.
Quando comparados aos compostos iônicos, os compostos covalentes costumam ter um ponto de fusão e ebulição mais baixo e menos tendência a se dissolver na água.
Os compostos covalentes podem estar no estado gasoso, líquido ou sólido e não conduzem eletricidade ou calor bem (Camy Fung, 2015).
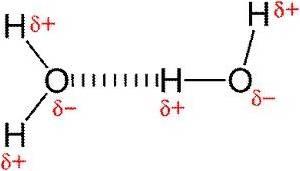
Pontes de hidrogênio
Ligações de hidrogênio ou ligações de hidrogênio são interações fracas entre um átomo de hidrogênio ligado a um elemento eletronegativo com outro elemento eletronegativo.
Em uma ligação covalente polar que contém hidrogênio (por exemplo, uma ligação OH em uma molécula de água), o hidrogênio terá uma leve carga positiva porque os elétrons da ligação são puxados mais fortemente em direção ao outro elemento.
Devido a essa leve carga positiva, o hidrogênio será atraído por qualquer carga negativa vizinha (Khan, SF).
Links de Van der Waals
São forças elétricas relativamente fracas que atraem moléculas neutras entre si em gases, gases liquefeitos e solidificados e em quase todos os líquidos orgânicos e sólidos.
As forças são nomeadas pelo físico holandês Johannes Diderik van der Waals, que em 1873 postulou essas forças intermoleculares pela primeira vez no desenvolvimento de uma teoria para explicar as propriedades dos gases reais (Encyclopædia Britannica, 2016).
Forças de Van der Waals é um termo geral usado para definir a atração de forças intermoleculares entre moléculas.
Existem dois tipos de forças de Van der Waals: as forças de dispersão de Londres que são forças dipolo-dipolo fracas e mais fortes (Kathryn Rashe, 2017).
Referências
- Anthony Capri, AD (2003). Ligação química: a natureza da ligação química . Obtido em visionlearning visionlearning.com
- Camy Fung, NM (2015, 11 de agosto). Covalente Bonds . Retirado de chem.libretexts chem.libretexts.org
- Clark, J. (2017, 25 de fevereiro). Bonding metálico . Retirado de chem.libretexts chem.libretexts.org
- Encyclopædia Britannica. (4 de abril de 2016). ligação metálica . Retirado de britannica britannica.com.
- Encyclopædia Britannica. (16 de março de 2016). Forças de Van der Waals . Retirado de britannica britannica.com
- Kathryn Rashe, LP (2017, 11 de março). Forças de Van der Waals . Retirado de chem.libretexts chem.libretexts.org.
- Khan, S. (SF). ligações químicas . Retirado de khanacademy khanacademy.org.
- Martinez, E. (2017, 24 de abril). O que é ligação atômica? Retirado de sciencing sciencing.com.
- Wyzant, Inc. (SF). Bonds . Retirado de wyzant wyzant.com.