O peróxido de bário (BaO2) é um composto químico que consiste em um íon de bário ligado a dois íons de oxigênio peróxido. Sua estrutura cristalina é semelhante à do peróxido de estrôncio, com uma geometria octaédrica em torno do átomo de bário. O peróxido de bário é um sólido branco, insolúvel em água, mas solúvel em ácidos.
Suas propriedades incluem a capacidade de liberar oxigênio quando aquecido, o que o torna útil em algumas aplicações industriais. O peróxido de bário também é um agente oxidante forte e pode ser utilizado em processos de branqueamento, desinfecção e como catalisador em reações orgânicas.
Apesar de suas propriedades úteis, o peróxido de bário é tóxico e corrosivo, sendo necessário manuseá-lo com cuidado e seguindo as medidas de segurança adequadas. Seu uso é restrito em algumas áreas devido aos riscos à saúde e ao meio ambiente.
Peróxido: definição e usos na indústria, beleza e cuidados com a saúde.
O peróxido é uma substância química que contém o grupo funcional R-O-O-R, onde R representa um radical orgânico ou inorgânico. Ele é amplamente utilizado na indústria, beleza e cuidados com a saúde devido às suas propriedades oxidantes. Na indústria, o peróxido é utilizado como agente de branqueamento em processos de fabricação de papel, tecidos e produtos químicos. Além disso, ele também é empregado como agente de polimerização em diferentes processos de fabricação de plásticos e resinas.
Na área da beleza, o peróxido é comumente utilizado em produtos para coloração capilar, pois ajuda na abertura das cutículas do cabelo, permitindo a penetração dos pigmentos de cor. Além disso, ele também é utilizado em cremes clareadores para a pele, ajudando a reduzir manchas e descolorações.
Quanto aos cuidados com a saúde, o peróxido é utilizado como agente antisséptico e desinfetante, ajudando a prevenir infecções em feridas e cortes. Além disso, ele também é utilizado em enxaguantes bucais para ajudar a combater bactérias na boca.
Peróxido de bário (BaO2): estrutura, propriedades e usos.
O peróxido de bário (BaO2) é um composto inorgânico que possui a fórmula química BaO2. Sua estrutura é composta por um átomo de bário ligado a dois átomos de oxigênio ligados por uma ligação dupla. O peróxido de bário é um sólido branco e cristalino, que é solúvel em água e possui propriedades oxidantes.
Uma das principais propriedades do peróxido de bário é sua capacidade de liberar oxigênio ativo quando em contato com ácidos. Por isso, ele é utilizado como agente oxidante em reações químicas, especialmente na fabricação de produtos químicos e na indústria de papel e celulose.
Além disso, o peróxido de bário também é utilizado na produção de oxigênio em sistemas de respiração autônoma, como em equipamentos de mergulho e em máscaras de oxigênio. Ele também pode ser utilizado como agente oxidante em fogos de artifício e em pirotecnia.
Qual a utilidade do óxido de bário na indústria e na medicina?
O peróxido de bário (BaO2) é um composto químico de grande importância na indústria e na medicina. Ele é utilizado em diversas aplicações devido às suas propriedades únicas.
Na indústria, o óxido de bário é amplamente utilizado como catalisador em reações químicas, especialmente na produção de produtos químicos orgânicos. Sua capacidade de acelerar reações químicas torna-o essencial em processos de síntese de compostos importantes para a indústria química. Além disso, o óxido de bário é utilizado na fabricação de vidros especiais, esmaltes e cerâmicas, devido às suas propriedades físicas e químicas.
Na medicina, o óxido de bário é utilizado em algumas aplicações específicas, como em exames radiológicos. Ele é utilizado como contraste em exames de imagem, auxiliando na visualização de órgãos internos. Além disso, o óxido de bário é utilizado em medicamentos para tratamento de certas condições médicas, devido às suas propriedades terapêuticas.
Suas propriedades únicas o tornam essencial em diversos processos e produtos, contribuindo para o desenvolvimento de diferentes áreas.
Formação dos peróxidos: entenda o processo de criação desta classe de compostos.
A formação dos peróxidos ocorre quando um metal alcalino ou alcalino-terroso reage com oxigênio molecular. Durante essa reação, os átomos de metal perdem elétrons para formar cátions, enquanto o oxigênio ganha elétrons para formar ânions. Esses ânions de oxigênio ligam-se entre si, formando uma ligação O-O, que é característica dos peróxidos.
O peróxido de bário (BaO2) é um exemplo de peróxido comumente utilizado na indústria. Sua estrutura consiste em íons de bário (Ba2+) e íons de peróxido (O22-), que estão ligados por ligações iônicas fortes. O peróxido de bário é um sólido branco e cristalino, com propriedades oxidantes e alvejantes.
Uma das principais propriedades do peróxido de bário é sua capacidade de liberar oxigênio quando aquecido, o que o torna útil em aplicações como agentes oxidantes em produtos químicos e branqueadores em produtos de limpeza. Além disso, o peróxido de bário também é utilizado na fabricação de compostos de bário, na indústria de vidro e cerâmica, e como catalisador em reações orgânicas.
O peróxido de bário é um exemplo importante dessa classe de compostos, com propriedades úteis e diversas aplicações industriais.
Benefícios e aplicações do peróxido de sódio: descubra como esse composto pode ajudar.
O peróxido de sódio é um composto químico com diversas aplicações e benefícios. Seu uso é bastante versátil, podendo ser encontrado em produtos de limpeza, desinfecção, branqueamento e até mesmo em tratamentos de água.
Uma das principais vantagens do peróxido de sódio é a sua eficácia na eliminação de bactérias, fungos e vírus, sendo um poderoso agente antimicrobiano. Além disso, ele também é conhecido por sua capacidade de remover manchas e odores, tornando-se um aliado na limpeza de superfícies e tecidos.
Outra aplicação importante do peróxido de sódio é na indústria de papel e celulose, onde é utilizado no processo de branqueamento de papel. Ele é capaz de oxidar compostos orgânicos presentes na matéria-prima, resultando em um produto final mais branco e de melhor qualidade.
No setor de tratamento de água, o peróxido de sódio também desempenha um papel fundamental na remoção de contaminantes e na desinfecção de sistemas de abastecimento. Sua ação rápida e eficaz o torna uma escolha popular entre os profissionais da área.
Seus benefícios vão desde a limpeza e desinfecção até o branqueamento e tratamento de água, tornando-o uma substância indispensável em muitos processos industriais e domésticos.
Peróxido de bário (BaO2): estrutura, propriedades e usos
O peróxido de bário é um composto iónico e inorgânico cuja fórmula química é BaO 2 . Sendo um composto iônico, consiste em íons Ba 2+ e O 2 2- ; O último é o que é conhecido como ânion peróxido, e por isso BaO 2 adquire seu nome. Assim, BaO 2 é um peróxido inorgânico.
As cargas de seus íons revelam como esse composto é formado a partir dos elementos. O bário metálico, Grupo 2, dar dois electrões para a molécula de oxigénio ó 2 , cujos átomos não utilizado para reduzir os óxidos, aniões O 2 , mas para ficar em conjunto por uma ligação simples, [OO] 2- .
O peróxido de bário é um sólido granular à temperatura ambiente, de cor branca com leves tons de cinza (imagem acima). Como quase todos os peróxidos, ele deve ser manuseado e armazenado com cuidado, pois pode acelerar a oxidação de certas substâncias.
De todos os peróxidos formados pelos metais do grupo 2 (Sr. Becambara), o BaO 2 é termodinamicamente o mais estável contra a decomposição térmica. Quando aquecido, ele libera oxigênio e óxido de bário , BaO, é produzido . O BaO pode reagir com o oxigênio do ambiente, a altas pressões, para formar o BaO 2 novamente .
Estrutura
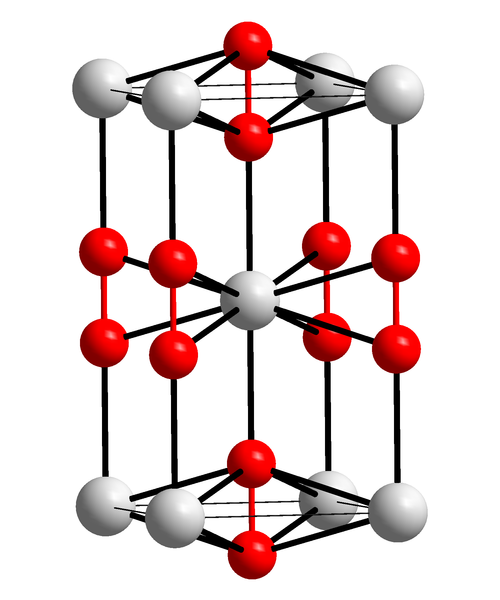
A célula unitária tetragonal de peróxido de bário é mostrada na imagem acima. Dentro pode ser a catiões Ba 2+ (áreas brancas), e os aniões de O 2 2- (esferas vermelho). Observe que as esferas vermelhas são unidas por um link simples, portanto representam a geometria linear [OO] 2- .
A partir desta célula unitária, os cristais de BaO 2 podem ser construídos . Se observado, o ânion O 2 2- é visto como cercado por seis Ba 2+ , obtendo um octaedro cujos vértices são brancos.
Por outro lado, ainda mais evidente, cada Ba 2+ é cercado por dez O 2 2- (esfera central branca). Todo o cristal consiste nessa ordem constante de curto e longo alcance.
Energia Reticular Cristalina
Se também forem observadas esferas brancas vermelhas, deve-se notar que elas não diferem muito em seus tamanhos ou raios iônicos. Isso ocorre porque o cátion Ba 2+ é muito volumoso, e suas interações com o ânion O 2 2- estabilizam a energia da rede do cristal em maior extensão em comparação com a forma como seriam, por exemplo, os cátions Ca 2+ e Mg 2+ .
Isto também explica por que BaO é o mais instável de óxidos alcalino-terrosos: iões de Ba 2+ e O 2- diferem consideravelmente em tamanho, desestabilizando cristais.
Como é mais instável, menor a tendência de o BaO 2 se decompor para formar o BaO; diferentemente dos peróxidos SrO 2 , CaO 2 e MgO 2 , cujos óxidos são mais estáveis.
Hidratos
BaO 2 pode estar na forma de hidratos, dos quais BaO 2 ∙ 8H 2 O é o mais estável de todos; e, de fato, é isso que é comercializado, em vez de peróxido de bário anidro. Para obter o produto anidro, o BaO 2 ∙ 8H 2 O deve ser seco a 350 ° C , para remover a água.
Sua estrutura cristalina também é tetragonal, mas com oito moléculas de H 2 O interagindo com o O 2 2- através de ligações de hidrogênio e com o Ba 2+ através de interações dipolo-íon.
Outros hidratos, cujas estruturas não existem muitas informações, são: BaO 2 ∙ 10H 2 O, BaO 2 ∙ 7H 2 O e BaO 2 ∙ H 2 O.
Preparação ou síntese
A preparação direta do peróxido de bário consiste na oxidação do seu óxido. Isso pode ser usado a partir da barita mineral ou do sal de nitrato de bário, Ba (NO 3 ) 2 ; ambos são aquecidos em uma atmosfera de ar ou enriquecidos com oxigênio.
Outro método é reagir em meio aquoso frio o Ba (NO 3 ) 2 com peróxido de sódio :
Ba (NO 3 ) 2 + Na 2 O 2 + xH 2 O => BaO 2 ∙ xH 2 O + 2NaNO 3
Em seguida, o hidrato de BaO 2 ∙ xH 2 O é aquecido, filtrado e seco usando vácuo.
Propriedades
Aparência física
É um sólido branco que pode ficar acinzentado se tiver impurezas (BaO, Ba (OH) 2 ou outras espécies químicas). Se for aquecido a uma temperatura muito alta, liberará chamas esverdeadas, devido às transições eletrônicas dos cátions Ba 2+ .
Massa molecular
169,33 g / mol.
Densidade
5,68 g / mL.
Ponto de fusão
450 ° C
Ponto de ebulição
800 ° C Este valor é consistente com o que deveria ser esperado de um composto iônico; e ainda mais, do peróxido alcalino-terroso mais estável. No entanto, o BaO 2 realmente não ferve , mas o oxigênio gasoso é liberado devido à sua decomposição térmica.
Solubilidade em água
Insolúvel No entanto, pode-se lentamente submetidos a hidrólise para produzir peróxido de hidrogénio , H 2 O 2 ; e além disso, sua solubilidade em meio aquoso aumenta se um ácido diluído for adicionado.
Decomposição térmica
A seguinte equação química mostra a reação de decomposição térmica à qual a BaO 2 sofre :
2BaO 2 <=> 2BaO + O 2
A reação é unidirecional somente se a temperatura for superior a 800 ° C. Se a pressão for subsequentemente aumentada e a temperatura diminuir, todo o BaO será transformado novamente em BaO 2 .
Nomenclatura
Outra maneira de nomear BaO 2 é o peróxido de bário, de acordo com a nomenclatura tradicional; já que o bário só pode ter valência +2 em seus compostos.
Erroneamente, a nomenclatura sistemática é usada para se referir a ele como dióxido de bário (binóxido), considerando-o um óxido e não um peróxido.
Usos
Produtor de oxigênio
Utilizando a barita mineral (BaO), é aquecida com correntes de ar para eliminar seu conteúdo de oxigênio, a uma temperatura em torno de 700 ° C.
Se o peróxido resultante sofrer um aquecimento leve sob vácuo, o oxigênio se regenera mais rapidamente e a barita pode ser reutilizada indefinidamente às vezes para armazenar e produzir oxigênio.
Esse processo foi desenvolvido comercialmente por LD Brin, agora obsoleto.
Produtor de peróxido de hidrogênio
O peróxido de bário reage com o ácido sulfúrico para produzir peróxido de hidrogênio:
BaO 2 + H 2 SO 4 => H 2 O 2 + BaSO 4
É, portanto, uma fonte de H 2 O 2 , manipulada especialmente com seu hidrato BaO 2 ∙ 8H 2 O.
De acordo com esses dois usos mencionados, o BaO 2 permite o desenvolvimento de O 2 e H 2 O 2 , ambos agentes oxidantes, em síntese orgânica e em processos de branqueamento na indústria têxtil e corante. Também é um bom agente desinfetante.
Além disso, a partir de BaO 2 podem ser sintetizados outros peróxidos, tais como de sódio, Na 2 O 2 , e outros sais de bário.
Referências
- SC Abrahams, J Kalnajs. (1954). A estrutura cristalina do peróxido de bário. Laboratório de Pesquisa de Isolamento, Instituto de Tecnologia de Massachusetts, Cambridge, Massachusetts, EUA
- Wikipedia (2018). Peróxido de bário Recuperado de: en.wikipedia.org
- Shiver & Atkins. (2008). Química Inorgânica (Quarta edição). Mc Graw Hill
- Atomistry (2012). Peróxido de bário Recuperado de: barium.atomistry.com
- Khokhar et al. (2011). Estudo da preparação em escala laboratorial e desenvolvimento de um processo para peróxido de bário. Recuperado de: academia.edu
- PubChem (2019). Peróxido de bário Recuperado de: pubchem.ncbi.nlm.nih.gov
- PrebChem (2016). Preparação de peróxido de bário. Recuperado de: prepchem.com