O ácido fórmico (HCOOH) é uma substância química orgânica, também conhecida como ácido metanoico, que possui uma estrutura molecular simples, sendo composta por um grupo funcional carboxila (COOH). É um líquido incolor, de odor picante e sabor ácido, sendo amplamente utilizado em diversos setores industriais, principalmente na indústria de produtos químicos, na produção de conservantes, na fabricação de couro e têxteis, e como agente de limpeza. Suas propriedades incluem a capacidade de ser um agente redutor e corrosivo, além de apresentar propriedades antimicrobianas e inseticidas. O ácido fórmico também é encontrado naturalmente em algumas espécies de formigas, que o utilizam como mecanismo de defesa.
Benefícios e aplicações do ácido fórmico na indústria e na saúde.
O ácido fórmico (HCOOH) é uma substância química incolor e altamente corrosiva, com um odor característico e sabor amargo. Sua estrutura molecular consiste em um átomo de carbono ligado a um átomo de oxigênio e a um grupo funcional hidroxila. O ácido fórmico é utilizado em diversos setores, graças aos seus benefícios e propriedades únicas.
Na indústria, o ácido fórmico é amplamente utilizado como conservante e acidificante em alimentos e rações animais. Além disso, é empregado na fabricação de produtos químicos, como tintas, resinas e agentes de tingimento. Sua ação antimicrobiana também o torna um excelente agente de limpeza e desinfetante em diversas aplicações industriais.
Na saúde, o ácido fórmico é utilizado no tratamento de algumas condições dermatológicas, como verrugas e calosidades. Sua ação queratolítica ajuda a remover a pele morta e promover a regeneração celular. Além disso, o ácido fórmico é utilizado em formulações de produtos de higiene pessoal, como cremes e loções, devido às suas propriedades antissépticas e cicatrizantes.
Em resumo, o ácido fórmico apresenta uma ampla gama de benefícios e aplicações na indústria e na saúde, sendo uma substância versátil e indispensável em diversos segmentos. Seu uso seguro e eficaz o torna uma escolha popular para diversas necessidades. Portanto, é importante conhecer e compreender as propriedades únicas do ácido fórmico para aproveitar ao máximo seus benefícios.
Locais onde o ácido fórmico pode ser encontrado.
O ácido fórmico (HCOOH), também conhecido como ácido metanóico, é uma substância naturalmente presente em diversos locais. Uma das principais fontes de ácido fórmico é o próprio organismo de algumas espécies de formigas, que o produzem como mecanismo de defesa contra predadores. Além disso, o ácido fórmico pode ser encontrado em algumas plantas, como a urtiga, onde atua como agente irritante.
Além dos organismos vivos, o ácido fórmico também pode ser produzido sinteticamente em laboratórios e indústrias químicas. É amplamente utilizado na indústria de curtumes, na produção de produtos químicos e na fabricação de pesticidas. Outra fonte comum de ácido fórmico são os venenos de abelhas, que o utilizam como componente ativo para causar dor e inflamação em suas vítimas.
Em resumo, o ácido fórmico pode ser encontrado em diversos locais da natureza, seja como produto natural de organismos vivos, como as formigas e as plantas, ou como resultado de processos industriais. Sua presença em diferentes contextos evidencia a importância e versatilidade dessa substância na vida cotidiana.
Qual é o nome do composto químico HCOOH?
O ácido fórmico, cuja fórmula química é HCOOH, é um composto orgânico incolor e de odor irritante. Também conhecido como ácido metanóico, é um ácido carboxílico simples encontrado em alguns insetos, como formigas e abelhas.
O ácido fórmico possui uma estrutura molecular composta por um átomo de carbono ligado a um átomo de oxigênio por uma ligação dupla e a um grupo hidroxila. Sua fórmula química pode ser escrita como HCOOH.
Este composto químico é amplamente utilizado em diversas indústrias, como na produção de produtos químicos, couro, têxteis e agricultura. Além disso, o ácido fórmico é utilizado como conservante de alimentos e na produção de agentes de limpeza.
Em relação às propriedades do ácido fórmico, é importante destacar que é um ácido fraco, o que significa que não se dissocia completamente em solução aquosa. Além disso, é corrosivo e pode causar irritação na pele e mucosas se manuseado incorretamente.
Em resumo, o nome do composto químico HCOOH é ácido fórmico, um composto utilizado em diversas indústrias devido às suas propriedades e usos variados.
Principais usos dos ácidos carboxílicos na indústria, medicina e alimentação: descubra suas aplicações.
Os ácidos carboxílicos são compostos orgânicos que possuem o grupo funcional carboxila (-COOH). Entre os ácidos carboxílicos mais conhecidos está o ácido fórmico (HCOOH), que possui diversas aplicações na indústria, medicina e alimentação.
Na indústria, o ácido fórmico é utilizado na produção de produtos químicos, como formiato de sódio, utilizado na fabricação de produtos de couro. Além disso, é empregado como agente conservante e acidificante em alimentos e bebidas.
Na medicina, o ácido fórmico é utilizado em produtos dermatológicos, como cremes e loções, devido às suas propriedades antibacterianas e antifúngicas. Também é empregado como agente conservante em medicamentos e vacinas.
Na alimentação, o ácido fórmico é utilizado como aditivo alimentar para acidificar e conservar alimentos, como queijos e embutidos. Além disso, é empregado na produção de aromatizantes e flavorizantes.
Com suas diversas aplicações, o ácido fórmico desempenha um papel importante em diferentes setores, contribuindo para a indústria, medicina e alimentação.
Ácido fórmico (HCOOH): estrutura, usos e propriedades
O ácido fórmico ou ácido metanóico é o mais simples e mais pequeno de todos os compostos ácidos orgânicos. Também é conhecido como ácido metanóico e sua fórmula molecular é HCOOH, possuindo apenas um átomo de hidrogênio ligado ao átomo de carbono. Seu nome deriva da palavra formica , que em latim significa ant.
Os naturalistas do século XV descobriram que certos tipos de insetos (formídeos), como formigas, cupins, abelhas e besouros, secretam esse composto responsável por suas dolorosas picadas. Além disso, esses insetos usam o ácido fórmico como mecanismo de ataque, defesa e sinalização química.

Eles têm glândulas venenosas que excretam esse e outros ácidos (por exemplo, ácido acético) como um spray externo. O ácido fórmico é mais forte do que o ácido acético (CH 3 COOH); portanto, dissolvido em quantidades iguais em água, o ácido fórmico produz soluções com valores mais baixos de pH.
O naturalista inglês John Ray conseguiu o isolamento do ácido fórmico em 1671, destilado de grandes quantidades de formigas.
Por outro lado, a primeira síntese bem-sucedida desse composto foi realizada pelo químico e físico francês Joseph Gay-Lussac, usando o ácido hidrociânico (HCN) como reagente.
Onde está?
O ácido fórmico pode estar presente nos níveis terrestres, como componente da biomassa ou na atmosfera, envolvido em um amplo espectro de reações químicas; Pode até ser encontrado sob o solo, na fase oleosa ou gasosa na superfície.
Em termos de biomassa, insetos e plantas são os principais geradores desse ácido. Quando os combustíveis fósseis são queimados, eles produzem ácido fórmico gasoso; Consequentemente, os motores dos veículos liberam ácido fórmico na atmosfera.
No entanto, a Terra abriga um número exorbitante de formigas, e entre todas elas são capazes de produzir em um ano milhares de vezes a quantidade de ácido fórmico gerado pela indústria humana. Além disso, os incêndios florestais representam fontes gasosas de ácido fórmico.
Acima, na complexa matriz atmosférica, ocorrem processos fotoquímicos que sintetizam o ácido fórmico.
Neste ponto, muitos compostos orgânicos voláteis (COV) são degradados sob os efeitos da radiação ultravioleta ou oxidados por mecanismos de radicais livres de OH. A química atmosférica rica e complexa é, de longe, a fonte predominante de ácido fórmico no planeta.
Estrutura
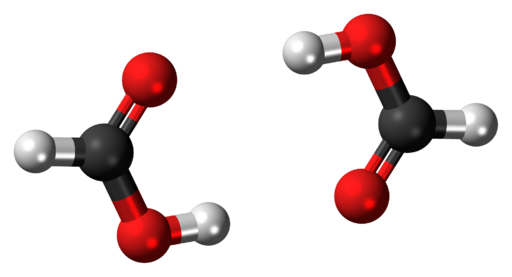
A estrutura de um dímero da fase gasosa de ácido fórmico é ilustrada na imagem acima. As esferas brancas correspondem aos átomos de hidrogênio, as vermelhas aos átomos de oxigênio e as pretas aos átomos de carbono.
Nestas moléculas, dois grupos podem ser vistos: hidroxil (–OH) e formil (–CH = O), ambos capazes de formar ligações de hidrogênio.
Essas interações são do tipo O – H – O, sendo os grupos hidroxila os doadores do H e os grupos formil os doadores do O.
No entanto, o H ligado ao átomo de carbono não possui essa capacidade. Essas interações são muito fortes e, devido ao átomo H pobre em elétrons, o hidrogênio no grupo OH é mais ácido; portanto, esse hidrogênio estabiliza ainda mais as pontes.
Como resultado do exposto acima, o ácido fórmico existe como um dímero e não como uma molécula individual.
Estrutura cristalina

À medida que a temperatura cai, o dímero orienta as suas pontes de hidrogénio para gerar a estrutura mais estável possível juntamente com os outros dímeros, criando assim cadeias infinitas α e β de ácido fórmico.
Outra nomenclatura são os conformes “cis” e “trans”. Nesse caso, “cis” é usado para designar grupos orientados na mesma direção e “trans” para esses grupos em direções opostas.
Por exemplo, na cadeia α, os grupos formil “apontam” para o mesmo lado (à esquerda), em contraste com a cadeia β, onde esses grupos formil apontam para lados opostos (imagem superior).
Essa estrutura cristalina depende das variáveis físicas que atuam sobre ela, como pressão e temperatura. Assim, as correntes são conversíveis; isto é, sob diferentes condições, uma cadeia «cis» pode ser transformada em uma cadeia «trans» e vice-versa.
Se as pressões aumentam para níveis drásticos, as cadeias são comprimidas o suficiente para serem consideradas um polímero cristalino de ácido fórmico.
Propriedades
– O ácido fórmico é um líquido à temperatura ambiente, incolor e com cheiro forte e penetrante. Tem um peso molecular de 46g / mol, derrete a 8,4 ° C e tem um ponto de ebulição de 100,8 ° C, superior ao da água.
– É miscível em água e solventes orgânicos polares, como éter, acetona, metanol e etanol.
– Por outro lado, em solventes aromáticos (como benzeno e tolueno) é levemente solúvel, porque o ácido fórmico dificilmente possui um átomo de carbono em sua estrutura.
– Possui um pKa de 3,77, mais ácido que o ácido acético, o que pode ser explicado porque o grupo metil fornece densidade eletrônica ao átomo de carbono oxidado pelos dois oxígenos. Isto traz uma ligeira diminuição da acidez do protão (CH resultante 3 COOH, HCOOH).
– Desprotonou o ácido, este se torna o formato ânion HCOO – , que pode deslocalizar a carga negativa entre os dois átomos de oxigênio. Portanto, é um ânion estável e explica a alta acidez do ácido fórmico.
Reacções
O ácido fórmico pode ser desidratado em monóxido de carbono (CO) e água. Na presença de catalisadores de platina, ele também pode se decompor em hidrogênio molecular e dióxido de carbono:
HCOOH (l) → H 2 (g) + CO 2 (g)
Essa propriedade permite que o ácido fórmico seja considerado como uma maneira segura de armazenar hidrogênio.
Usos
A indústria alimentar e a agricultura
Apesar de quão ácido fórmico prejudicial possa ser, é usado em concentrações apropriadas como conservante nos alimentos devido à sua ação antibacteriana. Pelo mesmo motivo, é utilizado na agricultura, onde também possui ação pesticida.
Também possui ação conservadora nas pastagens, o que ajuda a evitar gases intestinais nos animais reprodutores.
A indústria têxtil e de calçados
É utilizado na indústria têxtil no tingimento e refino de têxteis, sendo talvez o uso mais frequente desse ácido.
O ácido fórmico é usado no processamento do couro devido à sua ação desengordurante e na remoção de pêlos deste material.
Segurança rodoviária nas estradas
Além dos usos industriais indicados, os derivados do ácido fórmico (formatos) são usados na Suíça e na Áustria nas estradas durante o inverno, a fim de reduzir o risco de acidentes. Este tratamento é mais eficiente que o uso de sal comum.
Referências
- Tellus (1988). Ácido fórmico atmosférico de formigas formicinas: uma avaliação preliminar408, 335-339.
- B. Millet et al. (2015). Fontes e sumidouros de ácido fórmico atmosférico. Atmos Chem. Phys., 15, 6283-6304.
- Wikipedia (2018). Ácido fórmico Recuperado em 7 de abril de 2018, de: en.wikipedia.org
- Acipedia Ácido fórmico. Recuperado em 7 de abril de 2018, de: acipedia.org
- Dr. NK Patel. Módulo: 2, Palestra: 7. Ácido fórmico. Recuperado em 07 de abril de 2018, de: nptel.ac.in
- F. Goncharov, MR Manaa, JM Zaug, LE Fried, WB Montgomery. (2014). Polimerização de ácido fórmico sob alta pressão.
- Jean e Fred (14 de junho de 2017). Deixando os montes. [Figura]. Recuperado de: flickr.com
- Michelle Benningfield (21 de novembro de 2016). Usos de ácido fórmico. Retirado em 07 de abril de 2018, de: ehowenespanol.com